Менопаузальные вазомоторные симптомы (приливы жара и/или ночная потливость) и сопровождающие их симптомы нарушения сна представляют значимую социально-экономическую и медицинскую проблему, встречаясь почти у 80% женщин в пери- и у 65% женщин в постменопаузе [1, 2]. Определение этих симптомов как менопаузальных подразумевает их преходящий характер до момента самопроизвольного разрешения. Однако некоторые эксперты задаются вопросом: не преуменьшает ли данный термин биологическую суть этого явления [3]? На сегодняшний день подчеркивается необходимость более глубокого изучения патофизиологии вазомоторных симптомов менопаузы, а также лежащих в их основе процессов нейрональной дизрегуляции с целью создания адекватных терапевтических агентов, улучшения качества жизни женщин и устранения потенциальной причины развития возраст-ассоциированных заболеваний и их осложнений в будущем [4, 5].
Несмотря на внушительный объем накопленных научных данных о генезе климактерических симптомов, очевидной роли в нем эстрогенов, нейромедиаторов норадреналина (НА) и серотонина, различных вазоактивных субстанций, до настоящего времени все еще нет четко обозначенной последовательности происходящих при этом событий с описанием конкретной роли отдельных биологических агентов. Большое внимание в настоящее время уделяется относительно новым данным о ключевой роли в генезе приливов жара повышенной активности специфических эстроген-чувствительных KNDy нейронов инфундибулярного ядра гипоталамуса. KNDy нейроны и секретируемые в них пептиды (kisspeptin/neurokinin B/dynorphin ─ кисспептин/нейрокинин В/динорфин) играют центральную роль в функционировании гипоталамуса. Нейрокинин В (neurokinin B (NKB) ─ нейропептид, который связывается с рецепторами нейрокинина в гипоталамусе и наряду с кисспептином регулирует участие ГнРГ в репродуктивном процессе. Благодаря проекции в непосредственной близости от структур, участвующих в контроле терморегуляции, KNDy-нейроны и их нейропептиды, вероятно, способны влиять на терморегуляторные процессы в головном мозге и выступать в качестве триггеров вазомоторных симптомов [6].
В работах, выполненных Rance на аутопсийных материалах головного мозга, были выявлены гипертрофические изменения нейронов инфундибулярного ядра у женщин после овариэктомии или в постменопаузе в сравнении с женщинами в пременопаузе. Позже было установлено повышение экспрессии генов NKB и синтеза его м-РНК в этих нейронах [6–8]. В дальнейшем это было подкреплено результатами рандомизированного, двойного слепого, плацебо-контролируемого исследования, в котором у молодых здоровых женщин при внутривенном введении NKB возникали приливы жара, аналогичные таковым при наличии климактерического синдрома у женщин в период менопаузы [6, 9]. Несмотря на опубликованные в литературе данные исследований о влиянии антагонистов рецепторов NKВ на тяжесть и частоту вазомоторных симптомов, на момент написания статьи не найдено публикаций об изучении уровней NKВ в различные возрастные периоды жизни женщин. В связи с этим является актуальным изучение уровня NKВ в крови у женщин в постменопаузе с определением его роли в возникновении вазомоторных симптомов и нарушений сна, а также динамики его уровня на фоне проведения МГТ [6].
Материалы и методы
В исследование включили 50 женщин в возрасте от 45 до 60 лет в стадиях (+1b и +1c) согласно критериям STRAW+10 и 30 женщин репродуктивного возраста с регулярным менструальным циклом. Пациентки были стратифицированы на три группы: в 1-ю группу вошли 25 женщин по STRAW+10 (+1b и +1c) с наличием климактерических симптомов, включая нарушения сна и вазомоторные симптомы. Группу сравнения (2-я группа) составили 25 женщин по STRAW+10 (+1b и +1c), не имеющих вазомоторных симптомов и нарушений сна. В контрольную группу (3-я) вошли 30 женщин репродуктивного возраста с регулярными менструациями.
Комплексное обследование женщин включало сбор клинико-анамнестических данных, определение гинекологического статуса, исследование гормонального профиля с определением уровня ФСГ. У женщин репродуктивного возраста определение уровня ФСГ проводили на 2–4-й день менструального цикла. Также всем женщинам проводили цитологическое исследование с оценкой мазков из цервикального канала шейки матки по системе Бетесда (2004 г.), маммографию с определением маммографической плотности по BI-RADS, ультразвуковое исследование (УЗИ) органов малого таза на аппарате 2000 Toshiba SSA-240 (Япония) трансвагинальным конвексным датчиком частотой 7,5 Мгц. Исходно и в конце лечения всем пациентам проводили взятие венозной крови. Определение концентрации ФСГ в сыворотке крови выполнялось электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе Cobas е411 (Roche Diagnostics GmbH, Германия), определение уровня NKB в сыворотке крови у женщин в постменопаузе и репродуктивного возраста – иммуноферментным твердофазным методом (Neurokinin B кат. № S-1271 Peninsula Laboratories International, Inc., США).
Все участники исследования подписали добровольное информированное согласие на его проведение.
Пациентки 1-й группы в качестве терапии климактерических симптомов получали 17-β эстрадиол в виде трансдермального геля 0,75 мг 1 раз в сутки ежедневно в сочетании с микронизированным прогестероном в виде капсул в непрерывном режиме по 100 мг ежедневно вагинально. Согласно клиническим рекомендациям МЗ РФ, женщинам в менопаузе назначается наименьшая эффективная доза МГТ [13].
В качестве критериев оценки эффективности лечения климактерических симптомов, в том числе приливов жара и нарушений сна, использовали анкетирование по шкале Грина и балльную оценку субъективных характеристик сна.
Данные представлены в виде среднего ± стандартная ошибка среднего (M±m). Статистический анализ проводили в программе Excel (Microsoft) и с помощью программы Statistica 8 (Statsoft Inc). Для оценки достоверности различий между группами использовался непараметрический U-критерий Манна–Уитни, предназначенный для сравнения двух независимых выборок. Для бинарных данных определялась частота (%), отношение рисков (ОР) и его доверительный интервал (ДИ) (англ. confidence interval). Критерий χ2 применяется для сравнения групп по качественным признакам, принимающим только 2 значения. Корреляционный анализ проводился по Пирсону. Оценка диагностической значимости исследуемых показателей оценивалась по результатам ROC-анализа. Для оценки вероятностей были использованы методы регрессионного анализа (бинарная логистическая регрессия, множественная логистическая регрессия). Бинарная логистическая регрессия рассчитывает вероятность наступления события в зависимости от значений независимых переменных. Вероятность события определялась по формуле:
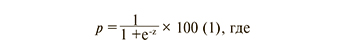
p – вероятность принадлежности к одной из анализируемых групп классификации, z – регрессионная функция, имеющая вид: z = b1*X1 + b2*Х2+ ...+ bn*Хn+ а (2).
Различие между группами считали статистически достоверным при уровне значимости р<0,05.
Результаты и обсуждение
Анализ клинико-анамнестических данных показал (табл. 1), что пациентки первых двух групп были сопоставимы по возрасту, антропометрическим и гормональным показателям. Выявлено, что у пациенток с вазомоторными симптомами и нарушениями сна вредные привычки встречались чаще в сравнении с женщинами, у которых отсутствовали данные симптомы (р=0,0001). Относительный риск (ОР) нарушений сна у курящих составил 2,5 (95% ДИ 1,3;4,5). Схожие данные были получены Smith R.L. и соавт. [10], где согласно результатам исследования женщины, бросившие курить, с меньшей вероятностью страдали от приливов жара в сравнении с курящими (OР=0,55, 0,80, 0,76), но чаще испытывали более тяжелые приливы, чем те, кто никогда не курили (OР=2,55; ДИ=1,68, 1,46). Полученные в нашем и ряде других исследований данные, однако, указывают на увеличение риска развития и степени тяжести климактерического синдрома, а также на потенциальную пользу отказа от курения как для предупреждения, так и для облегчения уже имеющихся симптомов менопаузы.

 При оценке уровня NKB в группах исследуемых пациенток было установлено, что у женщин в 1-й группе значения NKB в 4,6 раза (р1<0,001), а во 2-й группе в 2,0 раза превышали показатели, полученные в 3-й группе. При этом, показатели NKВ в 1-й и 2-й группах были статистически значимо выше в сравнении с контролем (р2<0,0001, р3=0,003) (рис. 1). Значимое повышение уровней NKB в сыворотке крови у женщин в постменопаузе в сравнении с женщинами репродуктивного возраста могут свидетельствовать о взаимосвязи этих состояний с изменениями в деятельности основных регуляторных нейропептидных систем головного мозга (KNDy нейронов), а также подтверждает повышение их активности в ответ на снижение уровня эстрогенов.
При оценке уровня NKB в группах исследуемых пациенток было установлено, что у женщин в 1-й группе значения NKB в 4,6 раза (р1<0,001), а во 2-й группе в 2,0 раза превышали показатели, полученные в 3-й группе. При этом, показатели NKВ в 1-й и 2-й группах были статистически значимо выше в сравнении с контролем (р2<0,0001, р3=0,003) (рис. 1). Значимое повышение уровней NKB в сыворотке крови у женщин в постменопаузе в сравнении с женщинами репродуктивного возраста могут свидетельствовать о взаимосвязи этих состояний с изменениями в деятельности основных регуляторных нейропептидных систем головного мозга (KNDy нейронов), а также подтверждает повышение их активности в ответ на снижение уровня эстрогенов.
В ходе дальнейшего исследования были рассчитаны пороговые значения NKB и ОР развития вазомоторных симптомов и нарушений сна у женщин в постменопаузе (табл. 2). Пороговое значение уровня NKB, превышающее 100 пг/мл, было ассоциировано с повышением ОР возникновения приливов жара – в 6,6 раза (95% ДИ=2,2;19,6), развития нарушений сна в 3,3 раза (95% ДИ=1,6;6,8).
 На основании полученных данных был проведен линейный корреляционный анализ между уровнем нейрокинина В и степенью тяжести климактерического синдрома (оценка по шкале Грина) в 1-й группе (рис. 2).
На основании полученных данных был проведен линейный корреляционный анализ между уровнем нейрокинина В и степенью тяжести климактерического синдрома (оценка по шкале Грина) в 1-й группе (рис. 2).
Значение коэффициента корреляции Пирсона (r) составило 0,99, что соответствует весьма высокой связи между уровнем NKB в сыворотке крови и выраженностью климактерического синдрома
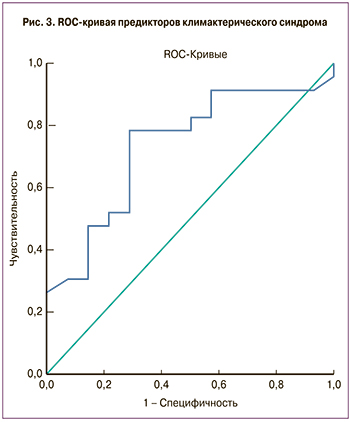
Для выявления маркеров, ассоциированных с тяжестью климактерического синдрома согласно опроснику шкалы Грина, методом логистических регрессий была построена модель (рис. 3), исходом для которой была переменная, характеризующая тяжесть климактерического синдрома, предиктором – уровень нейрокинина В. Нейрокинин В может быть использован в качестве независимого маркера для оценки тяжести климактерического синдрома у женщин в постменопаузе. Чувствительность данного метода составила 75,7%, специфичность – 71,4%. Значение площади под ROC-кривой AUС=0,733±0,085 (р=0,019).
Интересным и важным с практической точки зрения является анализ клинических и лабораторных данных после проведенного в ходе нашего исследования лечения климактерических симптомов препаратами МГТ. Из 25 пациенток 3-месячный курс лечения закончили 25 (100%) пациентки.
При анализе степени тяжести климактерических симптомов по шкале Грина на фоне проведенной терапии установлено статистически значимое снижение степени их тяжести в 1-й группе (табл. 3). Полное исчезновение приливов жара отметили 10 (40,0%) пациенток, статистически значимое облегчение – у 15 (60%). Ночная потливость значимо уменьшилась у 9 (36,0%) пациенток, полное исчезновение отметили 16 (64,0%) женщин. У 16 (64,0%) женщин отмечено уменьшение или полное исчезновение нарушений сна (р=0,0001), интенсивность симптомов нарушений сна уменьшилась у 36,0 % исследуемых женщин (р=0,0001).
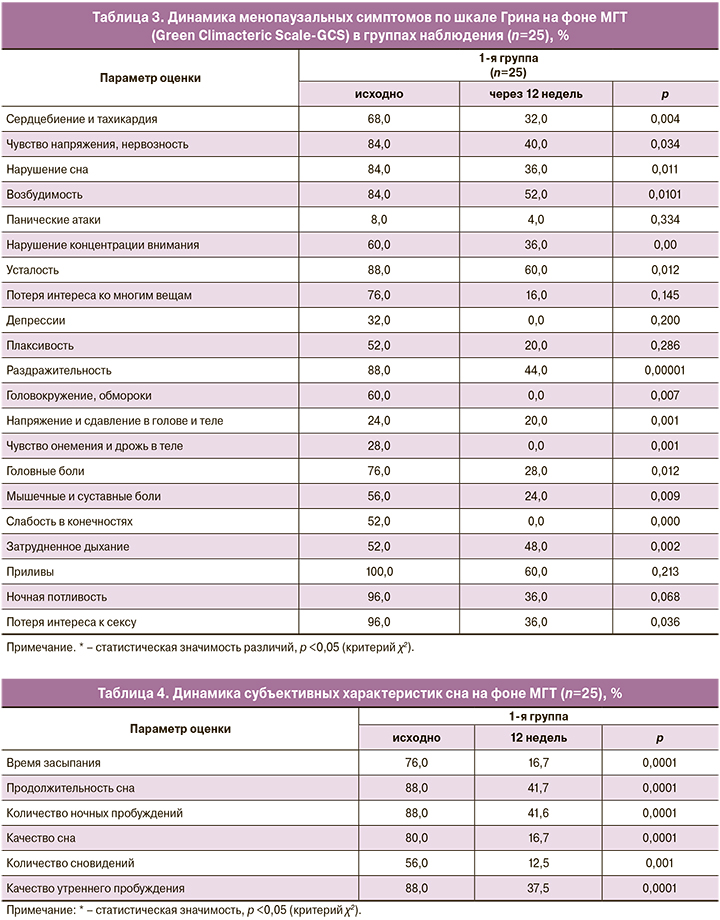
Через 12 недель лечения тяжесть климактерического синдрома соответствовала: легкая – у 12 (48%), средняя степень – 12 (48%) и тяжелая – 1 (4%) пациентка. Статистически значимое снижение вазомоторных симптомов и расстройств сна на фоне МГТ в очередной раз доказывает важную роль эстрогенов в патогенезе климактерических расстройств (табл. 3–4).
 Облегчение вазомоторных симптомов на фоне лечения, возможно, было связано с улучшением общего качества сна. Этот результат не является неожиданным, так как облегчение вазомоторных симптомов нередко используется в качестве клинического параметра, позволяющего контролировать лечение нарушений сна. В подгруппе женщин, сообщавших в начале нашего исследования об умеренных или тяжелых вазомоторных симптомах, их облегчение коррелировало с увеличением длительности сна.
Облегчение вазомоторных симптомов на фоне лечения, возможно, было связано с улучшением общего качества сна. Этот результат не является неожиданным, так как облегчение вазомоторных симптомов нередко используется в качестве клинического параметра, позволяющего контролировать лечение нарушений сна. В подгруппе женщин, сообщавших в начале нашего исследования об умеренных или тяжелых вазомоторных симптомах, их облегчение коррелировало с увеличением длительности сна.
Важно отметить, что на фоне проведенного 12-недельного курса лечения отмечено почти 3-кратное снижение уровня NKB в 1-й группе: с 269,72±40,79 пг/мл до 83,56±26,07 пг/мл (р=0,0003), МГТ оказывала значимое влияние на уровень нейрокинина В, что указывает на прямой центральный эффект препаратов половых гормонов на KND-нейроны.
Заключение
Повышение уровня NKB в сыворотке крови в постменопаузе в сравнении с контролем у женщин репродуктивного возраста, возможно, объясняется активацией гипоталамических KNDy-нейронов. Увеличение уровня NKB у пациенток с наличием климактерических симптомов в сравнении с женщинами без симтомов, а также его снижение на фоне МГТ подтверждают гипотезу о важной роли NKB в патогенезе вазомоторных симптомов и нарушений сна у женщин в постменопаузе.



