Несмотря на то что классические сердечно-сосудистые факторы риска становятся все более эффективно управляемыми, отмечается постоянное увеличение так называемого кардиометаболического риска [1].
«Гормональный хаос», возникающий у женщин переходного периода, не только характеризуется появлением вазомоторных симптомов, но и приводит к широкому спектру метаболических нарушений, накоплению основных кардиометаболических факторов риска и в значительной степени способствует развитию сердечно-сосудистых заболеваний в постменопаузальном периоде [2, 3]. Одной из причин повышенного сердечно-сосудистого риска, по-видимому, является метаболический синдром, формирование которого происходит задолго до прекращения менструальной функции – в периоде менопаузального перехода.
Несмотря на противоречивые данные о распространенности метаболического синдрома у женщин в периоде климактерия, в проведенных ранее исследованиях была показана четкая его взаимосвязь с увеличением риска сердечно-сосудистой смертности [4, 5].
В связи с чем представляют интерес оценка изменений кардиоваскулярных факторов риска у женщин на разных стадиях периода репродуктивного старения и изучение возможностей ранней коррекции возникающих метаболических нарушений.
Одним из перспективных направлений устранения вазомоторных проявлений климактерического синдрома и метаболических нарушений является стратегия раннего назначения гормональной терапии женщинам в климактерическом возрасте – от контрацепции к менопаузальной гормональной терапии [6–8]. Вместе с тем недооценка возрастных изменений функционирования репродуктивной системы, особенностей метаболических нарушений, возникающих у женщин в периоде климактерия, могут приводить к несвоевременному назначению им таковой терапии. Все это диктует необходимость более раннего и широкого применения низкодозированной комбинированной терапии (эстрогены с прогестагенами) в циклическом режиме у женщин в периоде менопаузального перехода [9].
Выбор конкретного комбинированного орального контрацептива (КОК) не ограничивается имеющимися клиническими рекомендациями, однако безопасность их применения у женщин с кардиоваскулярными факторами риска неодинакова [7–9]. До сих пор требуют изучения характер изменений кардиометаболических факторов риска и сердечно-сосудистая безопасность использования дроспиренонсодержащего КОК у женщин переходного периода.
Цель исследования: оценка изменений кардиометаболических факторов риска у женщин в периоде менопаузального перехода и возможности коррекции выявленных нарушений при применении дроспиренонсодержащей циклической гормональной терапии.
Материалы и методы
Проводилось сплошное двухэтапное открытое проспективное стратифицированное исследование с вовлечением женщин в позднем периоде менопаузального перехода с проявлениями климактерического синдрома различной выраженности и продолжительности.
Критерии включения: проявления климактерического синдрома различной выраженности и продолжительности у женщин с диагностированным, согласно универсальным критериям старения репродуктивной системы женщин STRAW+10, поздним периодом менопаузального перехода [10].
К критериям исключения относились: наличие любых острых сердечно-сосудистых событий, включая острый коронарный синдром, инсульт, тромбоэмболические события в настоящее время и в прошлом; наличие хронических заболеваний, ассоциированных с атеросклерозом (ишемическая болезнь сердца, заболевания периферических артерий и цереброваскулярные заболевания); курение в анамнезе и на момент включения в исследование, сахарный диабет 1 и 2 типа, заболевания щитовидной железы с нарушением ее функции, артериальная гипертензия в репродуктивном периоде, синдром поликистозных яичников, гистеровариэктомия, заболевание почек и печени с нарушениями их функций, онкологические заболевания в любой стадии, терапия эстрогенами и прогестагенами в настоящее время и в прошлом.
В исследование были включены 178 женщин, медиана возраста – 48,7 (48,0;50,0) года.
При включении в исследовании у всех женщин, согласно существующей клинической практике [7–9], проводился сбор анамнестических данных, физикальный осмотр; врачом-гинекологом осуществлялся осмотр шейки матки в зеркалах и онкоцитологический скрининг; всем женщинам выполнялось трансвагинальное ультразвуковое исследование.
Первый этап исследования был направлен на характеристику кардиометаболического статуса вовлеченных в исследование женщин.
Для оценки тяжести клинических проявлений климактерического синдрома проводилось анкетирование больных с использованием модифицированного менопаузального индекса (ММИ) Kupperman в модификации Е.В. Уваровой. Оценивались нейровегетативные (вазомоторные), психоэмоциональные и нейроэндокринные (метаболические) симптомы. Полученные данные при анкетировании анализировались отдельно по группам и суммарно. Нейровегетативные проявления климактерического синдрома легкой степени диагностировали при сумме баллов от 10 до 20, средней степени тяжести – при сумме баллов 21–30 и тяжелой степени – при сумме более 30 баллов.
Психоэмоциональные и нейроэндокринные проявления климактерического синдрома оценивались одинаково – легкие нарушения при сумме баллов от 1 до 7, средняя степень нарушений диагностировалась при сумме баллов от 8 до 14 и тяжелая степень – если сумма превышала 14 баллов.
Значение суммы баллов для нейровегетативных нарушений менее 10 расценивалось как отсутствие нарушений, от 10 до 20 баллов – как проявления легкой степени, от 21 до 30 баллов – средней степени тяжести, сумму баллов свыше 30 баллов – как тяжелые нарушения. Метаболические и психоэмоциональные нарушения оценивались одинаково: в пределах 1–7 баллов – легкая степень нарушений, 8–14 баллов – средняя степень тяжести, свыше 14 баллов – как тяжелая степень выраженности симптомов.
Итоговое значение ММИ оценивали с учетом суммы всех полученных данных: слабая степень выраженности – при сумме баллов 12–34, умеренные проявления – при 35–58 баллах, при сумме баллов свыше 58 диагностировали тяжелое течение климактерического синдрома.
Проводилась оценка антропометрических показателей: рассчитывали индекс массы тела (ИМТ) как частное от деления массы тела на рост, возведенный в квадрат (кг/м²), проводили измерение окружности талии (ОТ) и окружности бедер (ОБ), определяли коэффициент окружность талии/окружность бедер (ОТ/ОБ).
Определяли липидный профиль – общий холестерин (ХС), холестерин липопротеинов низкой плотности (ХС ЛПНП), холестерин липопротеинов высокой плотности (ХС ЛПВП), триглицериды (ТГ), рассчитывали холестерин не липопротеинов высокой плотности (ХС не-ЛПВП), оценивали отношение ТГ/ХС ЛПВП.
Проводили пероральный глюкозотолерантный тест с оценкой показателей гликемии натощак и через 2 ч после приема 75 г безводной глюкозы, растворенной в 250 мл воды (постпрандиальная гликемия). Для оценки показателей, характеризующих инсулинорезистентность (ИР), определяли уровень иммунореактивного инсулина (ИРИ) в плазме крови методом иммуноферментного анализа, рассчитывали индекс ИР (Homeostasis Model Assessment of Insulin Resistance, HOMA-IR) по формуле: HOMA-IR = ИРИ натощак (мкЕд/мл) × глюкоза натощак (ммоль/л)/22,5. Значения ИРИ≥12 мкЕД/мл и HOMA-IR>2,77 у.е. свидетельствовали о наличии ИР.
Второй этап исследования был направлен на оценку возможности коррекции выявленных кардиометаболических нарушений с помощью дроспиренонсодержащей циклической гормональной терапии.
Исследование проводилось в условиях реальной клинической практики: назначение дроспиренонсодержащей циклической гормональной терапии проводилось гинекологом с учетом гинекологического статуса, наличия противопоказаний и желания женщины. Все пациентки, изъявившие согласие и не имеющие противопоказаний, получали КОК «Джес» (Байер Фарма АГ), содержащий в одном блистере 24 активные таблетки этинилэстрадиола 0,02 мг и дроспиренона 3 мг и 4 таблетки плацебо (основная группа, n=87). Прием препарата осуществлялся согласно инструкции по применению и включал в себя последовательный прием по 1 таблетке в сутки на протяжении 28 дней в порядке, указанном на упаковке. Назначение КОК предшествовало наступлению менопаузы. Стратификация групп проводилась по факту проведения использования КОК. Контрольную группу составили 91 женщина, не принимавшая КОК.
Продолжительность исследования ограничивалась наступлением менопаузы и/или отменой КОК. Медиана продолжительности приема КОК составила 1,8 (1,6; 2,0) года.
Возможность коррекции имеющихся кардиометаболических нарушений оценивалась по динамике показателей ИМТ, ОТ и коэффициента ОТ/ОБ, параметрам липидного профиля и состояния углеводного обмена. Соответствующие параметры оценивались при включении пациентки в исследование, спустя 6 месяцев и по окончании исследования. В качестве первичных конечных точек были выбраны: 1) снижение или отсутствие увеличения ИМТ к окончанию исследования, 2) снижение или отсутствие увеличения ОТ к окончанию исследования, 3) достижение целевого уровня ХС ЛПНП (≤2,6 ммоль/л с учетом существующих клинических рекомендаций), 4) снижение или отсутствие повышение ИРИ≥12 мкЕД/мл [11].
Этические принципы проведения медицинских исследований соответствовали основным положениям Хельсинкской декларации. Протокол проводимого исследования предварительно был одобрен комитетом по этике ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России (протокол № 2 от 04.10.2016 г.). Все пациентки дали добровольное информированное согласие на участие в исследовании.
Статистический анализ
Статистическая обработка полученных в исследовании данных проводилась с использованием программного обеспечения SPSS 21.0 for Windows. На этапе планирования исследования расчет размера выборки проводился исходя из планируемого сравнения пропорций и проверки статистических гипотез относительно непрерывных переменных. Ожидаемые пропорции и стандартное отклонение (SD) были взяты из литературных источников и проверены при наборе ориентировочно 2/3 выборки. Мощность тестов (1-β) была принята за 80%, уровень значимости α – 5% [12].
Для оценки нормальности распределения признаков применяли W-критерия Шапиро–Уилка. Данные представлены в виде медианы (Ме) и интерквартильного размаха в формате Ме (Q1; Q3). Качественные показатели описывались в абсолютных и относительных величинах. Для проверки статистических гипотез использовали тесты Манна–Уитни, Вилкоксона и Краскелла–Уоллиса. Величину размера эффекта и точность его оценки описывали в виде разности медиан с 95% доверительным интервалом (95% ДИ) (оценка Ходжеса–Лемана). Проводилась оценка таблиц сопряженности с расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ).
Анализ различий по качественным показателям оценивался с использованием критерия Пирсона χ2. Различия считались статистически значимыми при p<0,05.
Результаты
Клиническая характеристика женщин, включенных в исследование, представлена в таблице 1.
По основным клинико-демографическим характеристикам женщины обследуемых групп значимо не отличались, за исключением преобладания женщин с повышенной массой тела в контрольной группе.
Завершили исследование 83 женщины основной группы и 87 женщин группы контроля. У одной женщины основной группы в процессе наблюдения отмечено появление желчнокаменной болезни, две женщины отменили прием препарата в связи с появлением диспепсических симптомов, у одной женщины отмечено повышение ТГ крови. Применение КОК не сопровождалось ни в одном случае развитием венозного тромбоза глубоких вен и тромбоэмболии легочной артерии, ишемического инсульта и острых коронарных событий, не отмечены случаи онкологических заболеваний.
У женщин основной группы отмечалась большая выраженность вазомоторных проявлений климактерического синдрома, что являлось дополнительным аргументом при назначении им низкодозированной гормональной терапии.
К окончанию исследования у женщин контрольной группы сохранялись и нарастали вазомоторные и обменно-эндокринные проявления климактерического синдрома, у женщин основной группы к окончанию приема КОК отмечался значимый регресс всего симптомокомплекса климактерического синдрома (табл. 2).
Повышенная масса тела встречалась у 38 (43,6%) и 52 (57,1%) женщин основной и контрольной групп соответственно (χ2=3,2, p=0,07). Исходных значимых отличий по выраженности и частоте встречаемости абдоминального ожирения и метаболического синдрома у обследованных женщин установлено не было.
Динамика массы тела и выраженности абдоминального ожирения на фоне применения дроспиренонсодержащего контрацептива представлена на рисунке.
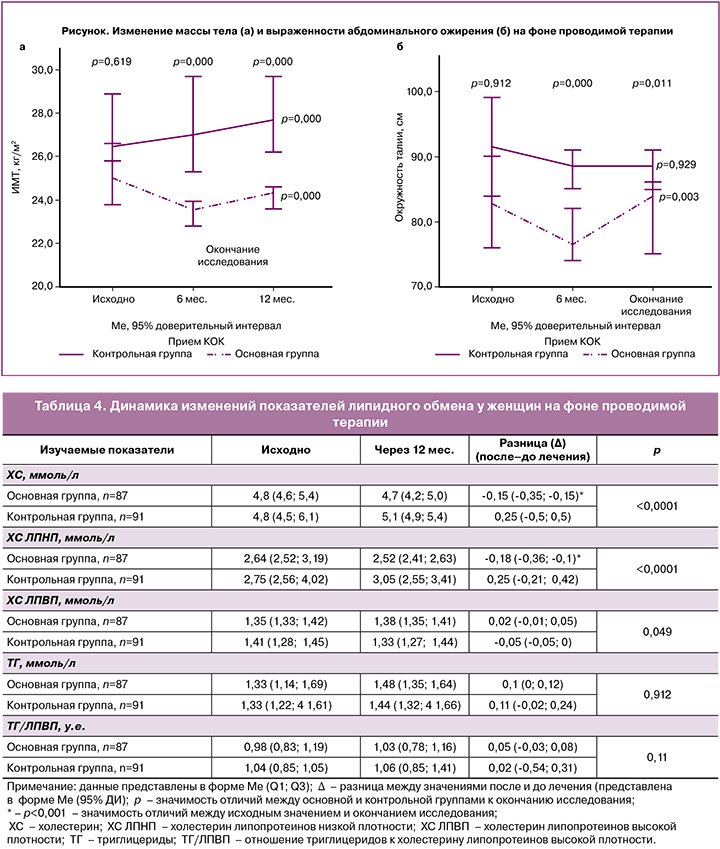
Исходных значимых отличий по ИМТ и ОТ у женщин обследованных групп отмечено не было; однако к окончанию исследования обнаружены существенные отличия изучаемых показателей: у женщин основной группы установлено значимое снижение ИМТ и ОТ, а у женщин группы контроля – значимое увеличение ИМТ и отсутствие изменений показателя ОТ. Установлено снижение риска увеличения ИМТ в основной группе (на фоне приема дроспиренонсодержащего КОК): вероятность отсутствия изменений составила ОШ 5,1 (95% ДИ 2,7;9,6), χ2=46,1 (р<0,001).
Существенной динамики показателя отношения ОТ/ОБ у обследованных женщин за период наблюдения выявлено не было. При сравнимых исходных значениях отношения ОТ/ОБ у женщин основной группы к окончанию исследования выявлена тенденция к уменьшению отношения ОТ/ОБ с 0,81 (0,79; 0,84) до 0,80 (0,78; 0,83) у.е. (р=0,07); у женщин контрольной группы значимых изменений показателя ОТ/ОБ отмечено не было – 0,81 (0,75; 0,87) и 0,82 (0,75; 0,85) у.е. (р=0,18).
Статистически значимых различий относительно риска увеличения абдоминального ожирения получено не было: ОШ 0,42 (95% ДИ 0,11; 1,48), χ2=1,8 (р=0,16).
Учитывая тесную взаимосвязь висцерального ожирения с ИР для нас представляло интерес изучение динамики ИР, показателей углеводного обмена у женщин на фоне приема КОК (табл. 3).
Исходных отличий по изучаемым показателям у женщин обследованных групп отмечено не было.
Значимой динамики уровня глюкозы крови натощак у женщин двух групп к окончанию исследования выявлено не было. Иная динамика отмечена у женщин при оценке постпрандиального уровня глюкозы крови – отсутствие значимых изменений у женщин основной группы и значимое увеличение этого показателя у женщин группы контроля (р=0,02).
У женщин контрольной группы к окончанию исследования установлено увеличение показателей ИР – отчетливая тенденция к повышению уровня ИРИ и значимое увеличение индекса ИР НОМА-IR; у женщин основной группы значимых изменений величин аналогичных показателей установлено не было.
Статистически значимых различий относительно риска увеличения ИР получено не было: ОШ 1,6 (95% ДИ 0,7; 3,7), χ2=1,9 (р=0,17).
Исходных значимых различий в показателях липидного обмена у женщин двух групп отмечено не было – в основной группе у 26 (29,8%) женщин и у 29 (31,8%) женщин в группе контроля диагностированы нарушения липидного обмена (χ2=0,9, p>0,05).
Изменение показателей липидного спектра крови представлено в таблице 4.
У женщин группы контроля к окончанию исследования значимых изменений показателей липидного спектра крови выявлено не было. На фоне приема КОК изменения липидного обмена носили иной и более выраженный характер: установлено значимое снижение атерогенных фракций липидов – уровней общего ХС и ХС ЛПНП. При этом наблюдалось снижение риска неблагоприятных изменений липидного профиля в основной группе исследования: повышение вероятности отсутствия изменений – ОШ 3,1 (95% ДИ 1,8; 5,1), χ2=26,9 (р<0,001).
Несмотря на описываемый в исследованиях риск повышения ТГ на фоне приема КОК к окончанию исследования значимых изменений его уровня, а также соотношения ТГ/ЛПВП отмечено не было.
Таким образом, к окончанию исследования у женщин контрольной группы, по сравнению с женщинами, принимавшими дроспиренонсодержащий контрацептив, наблюдались значимо более высокие уровни ХС, ХС ЛПНП и более низкий уровень ХС ЛПВП.
Обсуждение
Одним из ведущих факторов, вносящим существенный вклад в увеличение риска смерти у женщин, является метаболический синдром [13].
В некоторых исследованиях было показано, что формирование метаболического синдрома происходит в более ранние периоды старения репродуктивной системы женщин, за несколько лет до наступления менопаузы, что требует более ранних вмешательств, направленных на профилактику основных составляющих метаболического синдрома [14–16]. Однако остается неясным вопрос, сможет ли назначение КОК во время менопаузального перехода замедлить скорость прогрессирования метаболических нарушений и как это скажется на риске развития сердечно-сосудистых заболеваний в будущем [16].
Очевидно, что различные компоненты метаболического синдрома вносят неодинаковый вклад в увеличение сердечно-сосудистого риска, а наличие климактерических вазомоторных проявлений является самостоятельным фактором сердечно-сосудистого неблагополучия.
В недавно проведенных исследованиях была отмечена взаимосвязь тяжести вазомоторных симптомов и увеличения сердечно-сосудистого риска [17–19]. У женщин с тяжелыми проявлениями климактерического синдрома чаще встречался метаболический синдром [19, 20].
Учитывая тот факт, что период менопаузального перехода характеризуется «гормональным хаосом», появлением вазомоторных симптомов и накоплением кардиоваскулярных факторов риска, для нас представляло интерес изучение выраженности метаболических факторов риска, ИР и дислипидемии у женщин переходного периода.
Установлено, что более чем у половины женщин, включенных в исследование, отмечалась повышенная масса тела и признаки абдоминального ожирения, что является основой формирования метаболического синдрома [7, 8, 14, 15].
У трети женщин (55/178 (30,9%)) выявлялись нарушения липидного обмена, у 41/178 (23%) женщин диагностирован метаболический синдром. Частота встречаемости метаболического синдрома у женщин в переходном периоде в нашем исследовании соответствовала результатам, представленным в других исследованиях [15].
В связи с высокой частотой встречаемости метаболических нарушений у женщин переходного периода представляет несомненный интерес дальнейшая разработка концепции более ранней, начатой еще в переходном периоде, гормональной терапии – от контрацепции к менопаузальной гормональной терапии, что не только эффективно устраняет ранние проявления климактерического синдрома, но и, возможно, в дальнейшем будет уменьшать риск поздних сердечно-сосудистых осложнений менопаузы [3, 6].
По-прежнему остаются не вполне изученными характер и особенности изменений метаболических сердечно-сосудистых факторов риска, вопросы сердечно-сосудистой безопасности при применении КОК у женщин периода менопаузального перехода.
Наибольшие опасения вызывает возможность КОК увеличивать риски тромботических осложнений (инфаркта миокарда, ишемических инсультов и венозных тромбоэмболий) [21–23].
В ряде исследований было отмечено увеличение риска венозных тромбоэмболических осложнений и артериальных тромбозов при использовании комбинированной гормональной терапии, содержащей дроспиренон, что в большей степени связано с применением высоких доз дроспиренона, а также вида и дозы эстрогена, входящего в состав КОК [24, 25].
В проведенном нами исследовании мы использовали низкодозовую комбинацию этинилэстрадиола 20 мкг и дроспиренона 3 мг. За весь период наблюдения ни у одной из обследованных женщин не зарегистрировано развитие острых тромботических событий на фоне приема дроспиренонсодержащего орального контрацептива.
Некоторые исследователи объясняют возможное незначительное повышение указанных рисков с недиагностированной исходной тромбофилией у женщин с изначально неблагоприятным фоном (при наличии ожирения, сахарного диабета, артериальной гипертонии) [23, 24].
Вместе с тем, учитывая возраст женщин, абсолютный риск развития осложнений, как правило, незначительный и считается приемлемым с медицинской точки зрения, учитывая те преимущества, которые женщины могут получить при использовании КОК [21, 23].
Проведенные исследования, касающиеся влияния оральных контрацептивов на показатели углеводного и липидного обмена, массу тела неоднозначны.
Очевидно, что входящие в состав оральных контрацептивов активные компоненты оказывают разнонаправленное действие в зависимости от их соотношения и биологических свойств. Так, по данным ряда исследований, использование высокодозированных КОК или КОК, содержащих прогестин с андрогенным эффектом, в большинстве случаев сопровождалось нарушением толерантности к глюкозе и повышением ИР, увеличением массы тела и повышением артериального давления [9, 21], нивелировало положительные эффекты эстрогенов в отношении липидов крови, увеличивало тромбогенные риски [26].
Выбор КОК в проведенном нами исследовании обусловлен тем фактом, что этинилэстрадиол – синтетический эстрадиол с более выраженными эстрогенными свойствами и устойчивостью к метаболизму в печени, чем натуральный, и может применяться у женщин с избыточной массой тела или ожирением [26].
Дроспиренон по своему фармакологическому профилю наиболее близок к эндогенному прогестерону и обладает высоким сродством к минералокортикоидным рецепторам, умеренным антиандрогенным влиянием, у него отсутствует остаточная глюкокортикоидная активность, что особенно важно при его применении у женщин с метаболическими факторами риска и ожирением [27, 28].
В проведенном исследовании у женщин основной группы выявлено значимое уменьшение массы тела, выраженности абдоминального ожирения, не отмечено изменений показателей углеводного обмена и ИР, выявлено уменьшение атерогенности плазмы крови. На фоне приема дроспиренонсодержащего КОК установлено снижение риска увеличения ИМТ и ОТ, неблагоприятных изменений липидного профиля.
Возможно, что сердечно-сосудистые эффекты гормональной терапии зависят от времени ее инициации (раннее назначение комбинированной гормональной терапии), что позволит разработать оптимальные режимы ее применения.
Заключение
В проведенном исследовании установлена высокая частота встречаемости метаболических факторов риска у женщин в периоде менопаузального перехода – более чем у половины женщин, включенных в исследование, отмечались повышенная масса тела и признаки абдоминального ожирения, у трети женщин выявлялись нарушения липидного обмена, почти четверть женщин имели метаболический синдром.
Раннее назначение (при появлении первых симптомов климактерия) женщинам в периоде менопаузального перехода дроспиренонсодержащей гормональной терапии препятствует увеличению массы тела и выраженности висцерального ожирения, способствует уменьшению ИР и нарушений углеводного обмена, благоприятно влияет на показатели липидного обмена, что имеет важное значение для профилактики менопаузального метаболического синдрома.
Ограничения исследования
Ограничением проведенного исследования является относительно небольшая продолжительность наблюдения за женщинами, принимавшими дроспиренонсодержащий КОК. Ограниченное число участниц исследования не позволило выделить отдельные группы женщин с ожирением, метаболическим синдромом с целью оценки эффективности и безопасности применения КОК у женщин этих групп.
Представляет несомненный интерес изучение отдаленных кардиопротективных эффектов применения КОК у женщин в периоде менопаузального перехода. Необходимы дальнейшие исследования, чтобы определить, могут ли вмешательства во время менопаузального перехода, в том числе с применением КОК, замедлить скорость прогрессирования тяжести метаболического синдрома и снизить риск заболевания в будущем.



