Одним из значимых для женского организма периодов является прекращение функции яичников. Однако изменения, которые достигают кульминации в постменопаузе, стартуют в ряде случаев уже за 4–8 лет до последней менструации (в фазе менопаузального перехода (МП)) [1, 2] и проявляются снижением фертильности, нарушением менструального цикла, вазомоторными симптомами (ВМС), нарушениями сна, психоэмоциональными изменениями, нарушениями метаболизма и ощущением сухости во влагалище, существенно влияя на качество жизни женщины [3]. Наиболее распространенные признаки дефицита женских половых гормонов – ВМС (приливы жара, повышенная потливость, ознобы) отмечают до 80% женщин в постменопаузе [4] и более 60% женщин уже в период МП [5]. ВМС могут продолжаться в течение длительного периода, в среднем в течение 7–9 лет, а у одной трети женщин – более 10 лет [4]. МП представляет собой физиологический этап, в течение которого у женщин на фоне возрастных изменений происходят постепенное снижение функции яичников и прекращение выработки эстрогенов [6]. Тяжесть менопаузальных симптомов в МП зависит от генетических особенностей, соматического состояния и образа жизни, степени выраженности и длительности гипоэстрогении. В связи с этим менопаузальные симптомы более ярко протекают в позднюю фазу МП. Более того, этот период является решающим в формировании кардиометаболических рисков [7, 8]. Нарушение липидного спектра крови, изменение композиционного состава тела в сторону накопления висцеральной жировой ткани, саркопения, гормональные изменения и сама по себе выраженность ВМС оказывают влияние на развитие атеросклероза, сердечно-сосудистой патологии и постменопаузального остеопороза. Поэтому МП по праву можно назвать особым периодом в жизни женщин, требующим повышенного внимания со стороны акушеров-гинекологов [7, 8].
Коррекция менопаузальных симптомов
Современная концепция ведения женщин с менопаузальными симптомами подразумевает ранний старт их коррекции c целью не только улучшения качества жизни, но и профилактики поздних осложнений дефицита эстрогенов. Согласно современным рекомендациям, наиболее эффективным средством борьбы с климактерическими расстройствами остается менопаузальная гормональная терапия (МГТ) [9, 10], которая способствует также купированию признаков генитоуринарного менопаузального синдрома, предотвращению потери костной массы и переломов, значительно улучшая качество жизни женщин. Также есть данные о позитивном влиянии МГТ на кардиометаболические риски [10].
Однако в ряде случаев эффект от приема МГТ (в определенной дозировке) может оказываться недостаточным [11]. По данным клинического опыта, это может происходить на этапе старта гормональной терапии (первые 1–3 месяца), при недостаточном купировании ВМС на фоне общей удовлетворенности проводимой МГТ, при снижении дозы гормонов по мере увеличения возраста и длительности постменопаузы, на фоне низких доз эстрогенов в составе МГТ при отсутствии возможности их повышения (наличие нежелательных эффектов от стандартных доз, наличие относительных противопоказаний, когда ожидаемые риски превышают пользу от увеличения дозы).
Из-за личных предпочтений, иногда – недостатка информации о преимуществах и рисках МГТ, возможных, как и для любого вида терапии, побочных эффектов многие женщины до сих пор воздерживаются от гормонального лечения. Кроме этого, МГТ имеет ряд противопоказаний, среди которых абсолютными являются рак молочной железы, эстрогензависимые злокачественные новообразования (эндометрия, яичников, матки), тромбозы и тромбоэмболии, инфаркт миокарда, ишемические или геморрагические цереброваскулярные нарушения и ряд других [12]. В то же время ограничением для применения МГТ могут стать относительные противопоказания (ожирение, сахарный диабет, хронические заболевания печени, мигрень, дислипидемия, неконтролируемая артериальная гипертензия, курение, миома матки, эндометриоз, отягощенный семейный анамнез по венозным тромбоэмболиям, отягощенный акушерский анамнез, повышенный риск рака молочной железы, эпилепсия и др.), особенно их комбинации, когда ожидаемые риски становятся более значимыми, чем польза. К показаниям для МГТ не относятся ВМС легкой степени, а также другие симптомы дефицита эстрогенов, с которыми женщина периодически сталкивается в ранней фазе МП [12].
В связи с этим для данных категорий пациенток, женщин на этапе обследования перед назначением МГТ в течение первых месяцев приема или в отсутствие возможности увеличить дозу гормонов при неполном купировании симптомов на фоне проводимой МГТ, а также для облегчения симптомов на фоне лечения доброкачественных заболеваний органов репродуктивной системы агонистами гонадотропин-рилизинг-гормона остается актуальным поиск альтернативных методов коррекции менопаузальных расстройств. Согласно современным руководящим документам, в настоящее время используют изменение образа жизни и диеты (к которым также относятся пищевые добавки), физические упражнения, негормональные препараты и поведенческие и альтернативные методы лечения [12, 13].
Альтернативные методы коррекции менопаузальных симптомов
Одними из наиболее изученных веществ растительного происхождения являются фитоэстрогены, среди различных групп которых для купирования гипоэстрогенных симптомов широко используют изофлавоны. Они присутствуют в таких пищевых продуктах, как соевые, зерновые и бобовые культуры, льняные семена, орехи, травы (красный клевер, куркума), но в менее биодоступных формах. Изофлавоны отличают отсутствие токсичности, антиоксидантные свойства, а также способность связываться с эстрогеновыми рецепторами, действуя в различных тканях как агонисты или антагонисты эстрогенов [14, 15]. Селективная модуляция эстрогеновых рецепторов изофлавонами объясняет их обсуждаемые эффекты в купировании менопаузальных симптомов, в профилактике кардиометаболических нарушений, а также в снижении риска некоторых эстроген-чувствительных видов рака [16, 17]. Антиэстрогенное действие изофлавонов проявляется, вероятно, в условиях высокой эстрогенной насыщенности. Результатами проведенного в 2022 г. метаанализа доказано, что потребление изофлавонов сои может снизить риск рака молочной железы у женщин в пери- и постменопаузе [18]. В ряде исследований проапоптотический и антипролиферативный эффекты объясняются способностью изофлавонов сои снижать рост раковых клеток за счет независимого от эстрогеновых рецепторов ингибирования ДНК-топоизомераз и тирозинкиназ [14, 18], а также антиангиогенными и противовоспалительными свойствами за счет регуляции экспрессии сосудистого эндотелиального фактора роста и рецептора-2 сосудистого эндотелиального фактора роста [14, 19, 20].
В условиях эстрогенного дефицита изофлавоны реализуют свою гормоноподобную активность, не препятствуя связыванию с рецепторами остаточного эндогенного эстрадиола [21]. Причина эстрогеноподобной активности изофлавонов (генистеина и даидзеина) и их активных метаболитов заключается в структурном сходстве со стероидным ядром эстрогенов [17]. Кроме этого, известно, что изофлавоны имеют большее сродство с эстрогеновым рецептором β (в 83 раза больше), чем с эстрогеновым рецептором α, что объясняет низкий риск развития рака молочной железы на фоне применения даже высоких их доз [22].
Соевые изофлавоны обычно существуют в виде биологически неактивных форм – D-гликозида, генистеина и даидзина, имеют низкую биодоступность и плохо всасываются в желудочно-кишечном тракте [16]. Попадая в кишечник, такие гликозидные формы могут быть деконъюгированы ферментами кишечных микроорганизмов – β-глюкозидазами – с образованием неконъюгированных (активных) форм, таких как даидзеин и генистеин [23]. Даидзеин может метаболизироваться далее в просвете кишечника бактериями в эквол и О-десметил-анголензин. Наибольшее сродство с эстрогеновыми рецепторами имеет эквол [24]. Однако из-за существующих различий в кишечном микробиоме на сегодняшний день известно, что только 30–50% населения способны продуцировать эквол [25], что, вероятно, объясняет довольно разнородные результаты клинических исследований, оценивающих свойства изофлавонов [16]. Существуют данные, что курение и высокое потребление жиров с пищей могут оказать негативное влияние на способность кишечных бактерий вырабатывать эквол; тогда как пища, богатая углеводами, напротив, оказывает противоположное действие [26, 27]. По оценкам экспертов, существуют различия среди исследуемых популяций. Так, у азиатских женщин выявлена более низкая частота ВМС (10–25%) по сравнению с женщинами западных стран (60–90%), что объясняется более низкой продукцией активного метаболита в кишечнике и низким содержанием изофлавонов в рационе питания последних [28].
Данными исследований показано, что потребление изофлавонов ежедневно в течение 12 недель способствует снижению частоты и выраженности ВМС у женщин в перименопаузе на 20,4–42,5% [29, 30], в постменопаузе – на 33,1% [22]. Систематический обзор и метаанализ 2015 г. показали, что прием изофлавонов от 3 до 12 месяцев снижает частоту приливов у женщин в возрасте от 48 до 60,1 года без серьезных побочных эффектов [31]. В работе Khapree S. et al. также отмечено улучшение соматических и психологических симптомов, оцененных по Рейтинговой шкале менопаузы (MRS), на 42,5% на фоне приема изофлавонов у женщин в перименопаузе [22].
Снижая ВМС, изофлавоны сои действуют и на кардиометаболические нарушения. Выявлена способность даидзеина и эквола усиливать дифференцировку адипоцитов и активировать рецепторы PPAR (рецепторы, активируемые пероксисомным пролифератором), способствуя повышению чувствительности к инсулину жировой, мышечной и печеночной тканей в клеточных линиях мышей in vitro и in vivo [32]. Исследования показали, что добавки изофлавонов сои могут способствовать снижению риска сердечно-сосудистых заболеваний за счет изменения липидного профиля, преимущественно снижая уровни общего холестерина (ХС) и липопротеинов низкой плотности (ЛПНП) [33], противовоспалительного и антиоксидантного действий [16].
Известно, что женщины в постменопаузе при регулярном потреблении в пищу продуктов, богатых соей, имеют более высокие показатели минеральной плотности кости (МПК) [34]. Максимальная потеря МПК происходит за 1 год до наступления менопаузы и в течение 2 лет после последней менструации, по сравнению с периодом между 2-м и 5-м годами постменопаузы [35]. Сигнальный путь RANK/RANKL/OPG контролирует костный метаболизм путем индукции синтеза RANKL (Receptor activator of nuclear factor kappa-B ligand – лиганд рецептора активатора ядерного фактора каппа-В) остеобластами и подавляя продукцию OPG (остеопротегерина). Tousen Y. et al. показано, что изофлавоны сои могут способствовать снижению уровня RANKL и повышению OPG [36], позитивно влияя на костный метаболизм и снижая резорбцию кости [37]. В исследовании Sathyapalan T. продемонстрировано значительное снижение уровня маркера костной резорбции β-cross laps (С-концевые телопептиды коллагена I типа) и маркера костеобразования P1NP (проколлаген‑N‑пропептид I типа) через 6 месяцев приема биологически активных добавок (БАД) с изофлавоном сои [38]. Метаанализ 2008 г. показал значительное снижение потери МПК поясничного отдела позвоночника через 6 месяцев потребления 90 мг/день изофлавона сои [39].
Возможности БАД «Эстровэл»
Для достижения большего терапевтического эффекта в лечении менопаузальных симптомов изофлавоны сои применяются в комплексе с экстрактами других растений, витаминами и микроэлементами в виде БАД. Одной из наиболее удачных комбинаций является БАД «Эстровэл». В его состав входят помимо семян сои, являющихся источником изофлавонов, экстракты плодов витекса священного, корневища с корнями диоскореи, L-5-гидрокситриптофан, индол-3-карбинол, фолиевая кислота, витамин В6 и другие (таблица). Необходимо отметить, что, потенцируя действия друг друга, компоненты Эстровэла оказывают свои дополнительные эффекты.
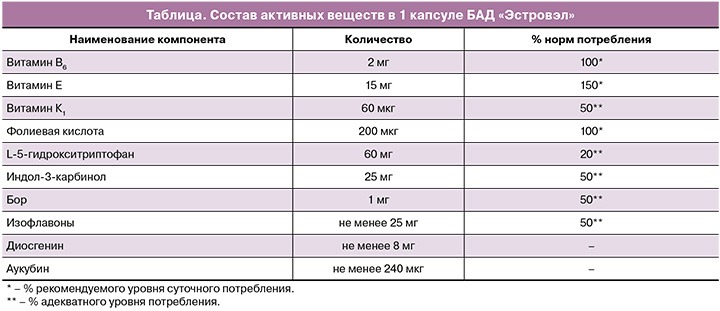
Ряд компонентов проявляет выраженное антидепрессивное действие, что несомненно является важным аспектом в оказании помощи женщинам с менопаузальными симптомами. Так, аминокислота L-5-гидрокситриптофан, являясь предшественником серотонина, в сочетании с витамином В6 способствует повышению устойчивости к стрессам, нормализации психоэмоционального состояния и сна [40]. Фолиевая кислота (витамин B9) не синтезируется в организме, но, попадая в него, превращается в l-метилфолат [41], который проникает через гематоэнцефалический барьер и влияет на синтез моноаминов: серотонина, адреналина и норадреналина [42, 43]. Участвуя в продукции нейротрансмиттеров, фолиевая кислота также может оказывать антидепрессивный эффект [42]. Ограниченное число данных свидетельствует о способности фолиевой кислоты купировать приливы жара у женщин в постменопаузе, вероятно, путем взаимодействия с моноаминовыми нейротрансмиттерами головного мозга [43–45].
Влияние экстракта плодов витекса священного на дофаминергическую нейромедиаторную систему у женщин с гипоэстрогенными симптомами определяет его положительный эффект на эмоциональное состояние женщин в виде снижения тревожности и раздражительности [46].
Витамин К1 также не синтезируется в организме человека, но оказывает влияние на костный метаболизм. Среди обсуждаемых его механизмов профилактики остеопороза и переломов – карбоксилирование остеокальцина, которое, в свою очередь, способствует связыванию кальция в костях и переходу остеобластов в остеоциты, подавляя остеокластогенез [47].
Антипролиферативное действие индол-3-карбинола обусловлено его способностью восстанавливать поврежденную ДНК, угнетать активность стимуляторов клеточного цикла, влиять на ядерные транскрипционные факторы и индуцировать апоптоз. На сегодняшний день накапливаются данные об эффективности использования индол-3-карбинола в лечении и профилактике гиперпластических процессов органов репродуктивной системы. Показано, что органами-мишенями могут быть молочная железа, миометрий, эндометрий и другие гормонозависимые ткани [48].
Эффективность уникального состава БАД «Эстровэл», сочетающего большое количество активных компонентов с доказанным механизмом действия, продемонстрирована рядом исследований. В нерандомизированном плацебо-неконтролируемом проспективном сравнительном исследовании терапия Эстровэлом в течение 2 месяцев способствовала снижению количества и интенсивности приливов, нормализации психоэмоционального фона в виде снижения нервозности и тревожности, повышению работоспособности, снижению масталгии, вздутия живота, гипергидроза, купированию головных болей, улучшению качества сна у 25 женщин в возрасте от 48 до 53 лет с явлениями климактерического синдрома средней степени тяжести. При оценке качества жизни все пациентки отметили «умеренную» и «высокую» степень удовлетворенности качеством жизни после курса лечения. Применение БАД привело к улучшению метаболических показателей. Так, уровни ХС и ЛПНП, а также масса тела имели тенденцию к снижению, а уровень триглицеридов (ТГ) стал статистически значимо ниже исходного уровня. Кроме этого, Эстровэл показал высокий профиль безопасности в виде отсутствия активации пролиферации эндометрия и эпизодов аномального маточного кровотечения, негативного влияния на свертывающую систему крови и серьезных нежелательных явлений на фоне курса лечения [49].
Эффекты комплекса «Эстровэл» на качество жизни, менопаузальные симптомы и кардиометаболический риск у женщин в пери- и постменопаузе были изучены в открытом рандомизированном контролируемом исследовании. Удовлетворенность лечением отметили 83,3% женщин в связи с купированием психоэмоциональных и вазомоторных нарушений полностью или до уровня, не влияющего на качество жизни, почти у половины пациенток (46,67%), исчезновением жалоб на нехватку воздуха, повышенную утомляемость и нарушения сна у 60,7%, снижением уровня тревоги и улучшением показателей эмоционального пищевого поведения. Положительное действие БАД «Эстровэл» на липидный профиль (снижение уровня ХС, ЛПНП, ТГ), артериальное давление (тенденция к снижению систолического и диастолического артериального давления), а также отсутствие увеличения окружности талии на всем протяжении терапии свидетельствуют о профилактическом потенциале в отношении кардиоваскулярного риска при 12-месячном использовании Эстровэла [50].
Заключение
Таким образом, появление менопаузальных симптомов требует особого внимания со стороны врача и своевременного назначения необходимой терапии. Альтернативные методы коррекции менопаузальных расстройств целесообразно рассмотреть в следующих группах женщин:
- не желающие принимать МГТ;
- с абсолютными противопоказаниями к МГТ;
- с относительными противопоказаниями к МГТ или их комбинацией, когда ожидаемые риски становятся более значимыми, чем польза;
- с побочными эффектами на фоне МГТ;
- проходящие обследование перед назначением МГТ или на фоне вынужденной отмены МГТ;
- при старте приема МГТ, пока не реализовался полностью ее эффект;
- в качестве дополнительного к МГТ метода лечения при неполном купировании ВМС в следующих ситуациях:
- на фоне общей удовлетворенности МГТ в принимаемой дозировке, но при наличии легких проявлений ВМС;
- на фоне низких доз эстрогенов в составе МГТ при отсутствии возможности их повышения (наличие нежелательных эффектов от стандартных доз, относительных противопоказаний);
- при снижении дозы гормонов по мере увеличения возраста и длительности постменопаузы и появлении легких ВМС на начальном этапе;
- с климактерическим синдромом легкой степени тяжести;
- в качестве терапии симптомов гипоэстрогении на фоне лечения агонистами гонадотропин-рилизинг-гормона, когда отсутствует возможность или показания к добавлению МГТ.
Достаточная база данных литературы дает возможность рассматривать изофлавоны сои в качестве эффективного средства растительного происхождения для данных категорий женщин. Удачное сочетание изофлавонов сои с другими растительными компонентами, микроэлементами и витаминами в виде БАД «Эстровэл» может применяться и для коррекции психоэмоционального фона, нейровегетативных изменений, оказывая профилактическое влияние на развитие метаболических нарушений и сердечно-сосудистых заболеваний у женщин как в постменопаузе, так и в фазе МП.



