Нарушения менструального цикла относятся к одной из наиболее частых причин обращений к акушеру-гинекологу, который по итогам клинической оценки определяет причину нерегулярных менструаций, устанавливает диагноз и назначает соответствующую коррекцию. При этом среди множества нозологических форм и синдромов, проявляющихся олиго- и аменореей, наибольшие сложности в настоящее время возникают при верификации диагноза «функциональная гипоталамическая аменорея» (ФГА). Согласно определению Европейского эндокринологического общества (ESE), ФГА – это форма хронической ановуляции, при которой происходит нарушение регуляции гипоталамо-гипофизарно-яичниковой (ГГЯ) оси, развивающееся, как правило, вследствие психогенного или метаболического стресса, снижения массы тела из-за недостатка питания, в том числе при расстройствах пищевого поведения (РПП), или вследствие избыточного расхода энергии в связи с чрезмерными физическими нагрузками либо их комбинации [1]. Причинами ФГА могут быть энергетический дисбаланс, сопутствующий травме, ожогу, тяжелой инфекции, гипертиреозу, мальабсорбции на фоне глютеновой энтеропатии, целиакии, а также намеренное исключение определенных продуктов питания, в частности животных жиров, даже при достаточной суточной калорийности [2–4]. Хотя общепринятым считается тот факт, что ФГА не имеет генетической основы, тем не менее очевидно наличие заметной вариабельности в степени потери массы тела или уровня физических нагрузок, необходимых для того, чтобы вызвать аменорею у разных женщин. По данным отдельных исследований, большая склонность к развитию аменореи (ФГА) как реакции на возникающий дефицит энергии наблюдается у пациенток с гетерозиготными мутациями в некоторых генах (KAL1, FGFR1, PROKR2, GNRHR), регулирующих синтез гонадолиберина [5].
Распространенность ФГА в когорте женщин со вторичными олиго- и аменореями достаточно высока и, по некоторым данным, достигает 20–35% [6].
Знание патогенетических механизмов формирования ФГА позволяет акушеру-гинекологу изначально наметить корректные терапевтические мишени во избежание распространенных шаблонных подходов к восстановлению менструального цикла при ФГА с помощью комбинированных гормональных контрацептивов (КГК). Назначение КГК женщине с ФГА не устранит причин заболевания, которое под «маской благополучия» будет прогрессировать до угрожающих здоровью и жизни последствий [7].
В последние годы стали известны молекулярные механизмы влияния метаболических процессов на работу женской репродуктивной системы, реализуемые посредством стимулирующего эффекта лептина адипоцитов подкожножировой клетчатки на гипоталамическую зону KND-y нейронов, а именно – на kiss-нейроны, которые функционально ответственны за синтез одноименного гормона кисспептина. В свою очередь, установлено, что кисспептин индуцирует секрецию гонадолиберина другими нейронами гипоталамуса, что приводит к «запуску» ГГЯ оси в пубертате [8, 9].
Резкое сокращение объема жировой клетчатки при ФГА приводит к снижению уровня лептина и, в итоге, нарушению секреции гонадолиберина, частота выделения которого падает до одного пика в 3 ч (вместо ежечасного высвобождения), что изменяет секрецию гонадотропинов вплоть до исчезновения овуляторного пика лютеинизирующего гормона (ЛГ), клинически проявляющегося ановуляцией и аменореей [10]. В 2003 г. Loucks A.B. и Thuma J.R. выявили уровень необходимой калорийности (30 ккал/кг), ниже которого нарушается пульсация ЛГ [11, 12]. Характерным для ФГА считается более выраженное снижение уровня ЛГ по сравнению с нормальным или низким уровнем фолликулостимулирующего гормона (ФСГ), что в эндокринологическом аспекте дублирует гормональный статус девочки в препубертате и проявляется гипогонадотропным гипогонадизмом [1]. Психоэмоциональный стресс вдобавок к метаболическому может стать причиной изменений сигналов, стимулирующих и подавляющих активность гипоталамического ядра, вследствие ингибирующего эффекта кортикотропин-рилизинг-гормона и кортизола на гипоталамо-гипофизарные отделы женской репродуктивной системы [13]. Влияние энергетического дефицита и стресса не ограничивается блокировкой работы ГГЯ-оси, а распространяется на эндокринные системы, в регуляции которых принимают участие гипоталамические структуры [14]. В этой связи гормональные изменения при ФГА, помимо низких сывороточных уровней ФГС и ЛГ и гипоэстрогении, могут быть дополнены легкой гиперкортизолемией, снижением концентраций трийодтиронина, андрогенов и пролактина и, самое важное, подавлением синтеза в печени важнейшего костно-трофического гормона, инсулиноподобного фактора роста 1 (ИФР-1), несмотря на некоторое повышение уровня соматотропного гормона по механизму отрицательной обратной связи [15]. Низкая эстрогенная насыщенность при ФГА проявляется отсутствием кровотечения отмены при проведении пробы с прогестероном, особенно по мере прогрессирования заболевания [10].
Таким образом, характерный клинический портрет пациентки с ФГА может быть представлен молодой женщиной с индексом массы тела (ИМТ) менее 18,5 кг/м2, которая придерживается строгой диеты (в ряде случаев страдающей РПП по типу нервной анорексии или булимии) и/или регулярно занимается спортом, постоянно находится в состоянии тревоги и стресса. Также наглядным клиническим примером ФГА является аменорея у профессиональных спортсменок, расходующих во время физических упражнений большее количество калорий, чем ими потребляется в сутки. Дефицит энергии, который может возникать независимо от изменений массы тела, по-видимому, является критическим фактором как при снижении массы тела, так и при формах ФГА, вызванных чрезмерной физической нагрузкой. Указанное послужило предпосылкой к появлению в спортивной медицине термина «женская атлетическая триада», включающего (помимо энергетического дефицита и аменореи) третий компонент – остеопороз, приводящий к возникновению малотравматичных переломов у спортсменок в молодом возрасте [16]. Установлено, что для женщин без опыта спортивных тренировок начало интенсивных физических нагрузок при одновременном ограничении калорийности рациона питания до минимально допустимого значения в 1200–1400 ккал в сутки существенно повышает риски развития ФГА в достаточно короткие сроки [10]. Минимальный уровень эстрадиола в сыворотке, поддерживающий нормальный уровень костного метаболизма, составляет 40–50 пг/мл, в то время как при ФГА сывороточная концентрация эстрадиола составляет менее 20 пг/мл [17]. Принимая во внимание тот факт, что гипоэстрогения при ФГА усугубляется гиперкортизолемией, гипофункцией щитовидной железы, а также падением ИФР-1, потеря минеральной плотности костей (МПК) при данном заболевании может происходить более интенсивно по сравнению с пациентками с преждевременной недостаточностью яичников, где дефицит эстрогенов выступает единственным этиологическим фактором остеопороза [1]. Несмотря на то что продолжительность аменореи положительно коррелирует с выраженностью остеопороза, самая быстрая потеря МПК происходит в первые месяцы после наступления аменореи [18]. Подсчитано, что средняя МПК молодой женщины с гипоэстрогенемией продолжительностью 6 месяцев эквивалентна таковой у женщины 51,2 года [19]. Не исключено, что потеря МПК может начинаться на фоне прогрессирующего снижения эстрогенной насыщенности на этапе олигоменореи до полного отсутствия менструаций, однако исследований, подтверждающих данное предположение, в доступной литературе не найдено.
Необходимо напомнить о долгосрочных последствиях ФГА, которые связаны с увеличением риска развития сердечно-сосудистых заболеваний [20–22]. Известно, что пациентки в пременопаузе, у которых ранее диагностировали ФГА, имели более высокий риск развития ишемической болезни сердца, что, вероятно, связано с недостаточным ангиопротективным эффектом эстрогенов в условиях их выраженного дефицита при ФГА [23]. У спортсменок с ФГА подтверждено формирование эндотелиальной дисфункции, а также изменение липидного профиля в сторону повышения уровня холестерина и липопротеидов низкой плотности [22].
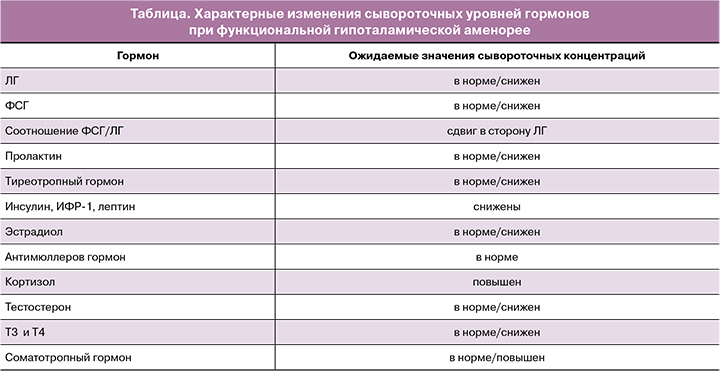
Диагноз ФГА устанавливается на основании жалоб на увеличение продолжительности менструального цикла более 45 дней или на отсутствие менструаций в течение 3 месяцев после исключения иных причин олиго- аменорей (заболеваний щитовидной железы, нарушения функции гипофиза, надпочечников, синдрома поликистозных яичников (СПЯ)) при наличии указаний на изменения веса по причине диет и/или интенсивных занятий спортом, перенесенный стресс [4, 24]. Патогенетические механизмы формирования ФГА обусловливают характерные изменения концентраций сывороточных гормонов, которые определяются в любой день на фоне аменореи (таблица). При этом «визитной эндокринологической карточкой» ФГА можно считать снижение уровней ЛГ и ФСГ в сыворотке, сдвиг соотношения ЛГ/ФСГ в сторону ЛГ, падение концентраций эстрадиола и лептина. Однако на ранних этапах развития ФГА практически все анализируемые гормональные параметры могут находиться в пределах референсного интервала, что нередко затрудняет своевременную диагностику ФГА.
При жалобах на наличие очаговой неврологической симптоматики (головной боли, тошноты, рвоты или нарушение зрения) рекомендовано выполнение магнитно-резонансной томографии (МРТ) головного мозга [25]. При длительности аменореи более 6 месяцев после установления диагноза ФГА для оценки МПК вне зависимости от возраста пациентки требуется проведение двухэнергетической рентгеновской асборциометрии [1].
Терапевтические подходы к пациенткам с ФГА требуют междисциплинарного участия и кардинально отличаются от лечебных стратегий при коррекции проявлений СПЯ, преждевременной недостаточности яичников и других заболеваний, сопровождающихся аменореей.
К первой линии терапии пациенток с ФГА относится лечение у специалистов в области психического здоровья. Посредством когнитивно-поведенческой психотерапии и других методов нивелируются последствия стресса и РПП на репродуктивную систему [26]. Врач-диетолог или эндокринолог осуществляет коррекцию пищевого рациона, направленную чаще всего на увеличение ИМТ путем повышения энергетической ценности пищи и сбалансированности нутриентов с обязательным включением добавок кальция и витамина D. Достаточное содержание подкожножирового слоя в организме является необходимым, но недостаточным условием для возобновления менструаций. Так, после корректировки веса и нормализации энергетического баланса время до восстановления менструаций варьирует от 11 недель до 33 месяцев [27–30]. В одном наблюдении была обнаружена корреляция между продолжительностью аменореи и временем, необходимым для восстановления менструаций, не подтвержденная в другом исследовании [28]. Golden N.H. et al. показали, что значением массы тела, необходимым для восстановления менструации, является повышение на 2 кг выше веса, при котором прекратились менструации [31].
Назначение КГК пациенткам с ФГА на фоне нервной анорексии для восстановления и поддержания МПК оказалось неэффективным [32, 33]. Более того, Rickenlund A. et al. показали, что, несмотря на нормализацию эндотелиальной функции на фоне КГК в течение 9 месяцев, нарушенные показатели липидного профиля у пациенток с ФГА существенно не изменились, что также ограничивает применение КГК у пациентов данного профиля [34].
Бисфосфонаты не могут использоваться в подобных клинических ситуациях из соображений безопасности в связи с потенциальным тератогенным влиянием лекарственного препарата на будущий плод по прошествии даже нескольких лет вследствие длительного периода полувыведения. Исследований, доказывающих эффективность и безопасность деносумаба для пациенток с ФГА, к настоящему моменту не проводилось.
Для профилактики и лечения остеопороза при ФГА показано использование эстрогенов в составе заместительной гормональной терапии (ЗГТ) после 6 месяцев неэффективных мероприятий по устранению энергетического дефицита и стресса [1]. Нередким заблуждением в процессе принятия клинического решения о назначении терапии пациенткам с уже установленным диагнозом ФГА является отказ от ЗГТ с трансдермальными эстрогенами по причине отсутствия отклонений в концентрациях гонадотропных гормонов (ФСГ, ЛГ) за пределы референсного интервала. Важно объяснить пациентке с аменореей, что на начальных этапах развития ФГА уровни ФСГ и ЛГ не выходят за пределы физиологических значений, а целями ЗГТ являются поддержание и восстановление МПК, лечение вульвовагинальной атрофии, сексуальной дисфункции у молодых женщин, а также профилактика сердечно-сосудистых заболеваний в отдаленной перспективе, риски которых существенно повышаются при возникновении гипоэстрогении в репродуктивном периоде [1].
При этом влияние на МПК пероральной ЗГТ в виде ежедневого приема конъюгированных эстрогенов в дозе 0,625 мг в сочетании с медроксипрогестерона ацетатом в дозе 10 мг каждые 10 дней месяца по сравнению с плацебо не отличалось [35].
Предположительно, отсутствие эффектов ЗГТ пероральными эстрогенами в направлении восстановления МПК связано с тем, что первичный печеночный метаболизм пероральных эстрогенов приводит к угнетению синтеза в печени костно-трофического гормона ИФР-1, изначально пониженного у пациенток с ФГА [36–39].
В соответствии с международными и российскими рекомендациями ЗГТ при ФГА проводится исключительно с применением трансдермальных препаратов эстрадиола (например, 0,1% гель эстрадиола гемигидрата) с циклическим микронизированным прогестероном 200 мг в течение 12 последних календарных дней каждого месяца для профилактики гиперпластических процессов эндометрия [1, 40].
Эстрадиол в форме трансдермального геля используется у женщин с ФГА непрерывно в высоких дозах, достигающих 1–2 мг в сутки, или в виде пластыря – 50–100 мкг в сутки (последний в настоящий момент снят с производства), поскольку предполагается, что назначение минимальных доз эстрогенов не приведет к ожидаемым результатам в поддержании и восстановлении МПК [7]. Практическому врачу крайне важно в рамках консультирования объяснить пациентке с ФГА безопасность ЗГТ, чтобы исключить экстраполяцию данных о рисках менопаузальной гормональной терапии, установленных для женщин перименопаузального периода, на популяцию молодых женщин. Рекомендуемые дозировки эстрогенов обеспечивают молодым женщинам с ФГА сывороточную концентрацию эстрадиола, эквивалентную пролиферативной фазе естественного менструального цикла, что не повышает риски венозных тромбоэмболических осложнений, рака молочной железы, а также не подавляет овуляцию по механизму «отрицательной обратной связи» на фоне ЗГТ в случае ее восстановления в отличие от КГК [1]. Длительность ЗГТ определяется в каждом случае индивидуально в зависимости от «ответа» на психотерапевтические и диетические вмешательства и колеблется, по данным литературы, в широком диапазоне от 6 месяцев до 2 и более лет [7].
Отмена ЗГТ происходит при условии устранения психических расстройств, восстановления нормального ИМТ, возникновения спонтанной овуляции, а также при наступлении беременности на фоне ЗГТ.
В нормативных документах РФ основные принципы диагностики и лечения ФГА впервые представлены в клинических рекомендациях «Олигоменорея и аменорея» (2021) Российского общества акушеров-гинекологов [2].
Приведенное ниже клиническое наблюдение пациентки с аменореей, связанной с метаболическим и психологическим стрессом, демонстрирует основные возможные затруднения в диагностике заболевания и эффективность различных терапевтических стратегий.
Клиническое наблюдение
Пациентка М., 25 лет, обратилась на очередной прием с жалобами на отсутствие самостоятельных менструаций на протяжении более 10 лет, а также с целью планирования беременности.
Оперативные вмешательства, вредные привычки, аллергические реакции отрицает, наследственность не отягощена. Из экстрагенитальных заболеваний указывает на наличие железодефицитной анемии. Из анамнеза: беременностей не было, менархе с 13 лет, регулярный менструальный цикл не установился, в последующие 5 лет на фоне различных диет с ограничением калорийности питания до 1000–1200 ккал/сутки самостоятельные менструации не регистрировались. К 18 годам ИМТ составил 16,3 кг/м2 (дефицит массы тела), пациентка впервые обратилась к гинекологу с жалобами на отсутствие менструации. После обследования был установлен диагноз СПЯ на основании следующих критериев: наличие ановуляции/аменореи и проявлений клинической гиперандрогении в виде acne vulgaris, а также поликистозной трансформации яичников по данным ультразвукового исследования (УЗИ). Клиническая оценка симптомов соответствовала «классическому фенотипу СПЯ» по Роттердамским критериям 2003 г. [41]. Однако использование указанных диагностических критериев в подростковом возрасте в течение первых 8 лет после менархе имеет объективные затруднения, поскольку клиническая гиперандрогения и поликистоз яичников по ультразвуковой картине относятся к физиологическим находкам в пубертате [42]. Вероятно, традиционное обследование с целью дифференциальной диагностики между ФГА и СПЯ у девушек и молодых женщин целесообразно дополнять определением сывороточного уровня лептина и проведением пробы с прогестероном. С целью «восстановления» менструального цикла назначены дроспиренон-содержащие КГК, а также даны рекомендации по набору массы тела. Пациентка начала интенсивно заниматься регулярными силовыми тренировками дважды в сутки по 2 часа, в связи с чем ИМТ увеличился до 21,2 кг/м2 за счет набора мышечной массы. При попытках отказа от КГК самостоятельной менструации не наступало. Использование гестагенов 10-дневными курсами (дидрогестерона, микронизированного прогестерона) не приводило к кровотечению отмены, что трактуется как отрицательная проба с прогестероном. Лечение с помощью фитопрепаратов, гомеопатических добавок, физиотерапевтических воздействий и циклической витаминотерапии было неэффективно.
С 19 лет у пациентки началась регулярная сексуальная жизнь с постоянным половым партнером, контрацепция – КГК или барьерные методы, в последние три года отдавала предпочтение последним. Пациентка продолжала интенсивно заниматься спортом и придерживаться ограничительных диет вплоть до 25 лет.
На момент осмотра ИМТ составлял 16,4 кг/м2, признаков клинической гиперандрогении не обнаружено. По данным УЗИ были обнаружены признаки поликистозной трансформации яичников. Результаты лабораторного обследования: ТТГ – 1,09 мМЕ/л; Т4 свободный – 10,7 пмоль/л; ЛГ – 0,05 МЕ/л; ФСГ – 1,53 МЕ/л; эстрадиол – 85 пмоль/л; пролактин – 99 мМЕ/л; АМГ – 7,8 нг/мл, тестостерон – 1,28 нмоль/л, лептин – 1,5 нг/мл (референсный интервал 3,7–11,1 нг/мл).
Наличие двух Роттердамских критериев (ановуляция и поликистозная морфология яичников по УЗИ) не исключает диагноза «СПЯ, неадрогенный фенотип». Однако, учитывая анамнестические данные, характерные изменения в соотношениях ФСГ и ЛГ, низкий уровень лептина, был установлен клинический диагноз ФГА.
Пациентке разъяснены причины отсутствия менструаций, вероятные осложнения, к которым приводит заболевание, в том числе возникновение ановуляторного бесплодия. Рекомендовано отменить интенсивные занятия спортом, повысить суточную калорийность питания до 2000–2500 ккал, консультация и наблюдение у психолога, а также проведение двухэнергетической рентгеновской абсорбциометрии и МРТ головного мозга. Очаговой патологии в головном мозге выявлено не было. Оценка МПК показала снижение Z-критерия до 2,3 в первом поясничном позвонке, что указывало на наличие остеопоротических изменений.
Фармакологическая коррекция выявленных нарушений включала назначение ЗГТ с трансдермальными эстрогенами. Пациентке было рекомендовано использование 1,5 мг трансдермального 0,1% геля эстрадиола гемигидрата (Дивигель) (в саше или в виде помпы) с циклическим микронизированным прогестероном 200 мг в течение 12 дней ежемесячно 6 месяцев, жевательные таблетки витамина D 2000 МЕ.
Через 6 месяцев на фоне выполнения вышеуказанных рекомендаций повышение ИМТ до 18,5 кг/м2. Данные двухэнергетической рентгеновской абсорбциометрии свидетельствовали о положительной динамике в восстановлении МПК: увеличение Z-критерия до 1,0 в первом поясничном позвонке. При УЗИ органов малого таза были обнаружены стигмы овуляторного менструального цикла. Рекомендованы завершение ЗГТ и планирование беременности. После отмены ЗГТ у женщины восстановился менструальный цикл и наступила спонтанная беременность в третьем естественном цикле без дополнительной фармакологической поддержки.
Таким образом, в представленном клиническом наблюдении несвоевременно верифицированный диагноз ФГА послужил причиной некорректной терапии с помощью КГК, потери МПК у девушки в период набора пиковой костной массы, субфертильности, а также, вероятно, ряда последствий со стороны сердечно-сосудистой системы в будущем.
Отсроченная диагностика ФГА у пациенток с аменореями, продемонстрированная на примере клинического случая, к сожалению, нередкое явление в реальной российской клинической практике. Указанное обусловлено тем, что ФГА представляет собой относительно новую нозологическую форму, начальные этапы развития заболевания не сопровождаются выраженными и специфическими изменениями лабораторных показателей, а верификация ФГА требует последовательного исключения всех возможных причин нарушений менструального цикла, что требует определенного времени. Более того, проведение дифференциальной диагностики между неандрогенным фенотипом СПЯ и ФГА сопряжено с объективными трудностями, поскольку у 50% пациенток с обозначенным фенотипом СПЯ (олигоановуляция и поликистозная морфология яичников при УЗИ) может быть диагностирована ФГА [43]. В этой связи крайне важно перед назначением КГК, создающих, по сути, «иллюзию благополучия», убедиться в правильности выставленного диагноза заболевания, проявляющегося ановуляцией/аменореей. Во избежание попадания в диагностические «ловушки» требуется глубокое понимание патофизиологических механизмов развития ФГА и СПЯ, которые определяют направление и объем диагностического обследования пациенток с олиго- и аменореями.
Следует отметить, что при оказании помощи пациенткам с ФГА необходимо привлечение специалистов в области психического здоровья и диетологов; избегать назначения КГК для «восстановления» менструального цикла, а также ЗГТ с пероральными эстрогенами вместо единственно эффективных при ФГА трансдермальных форм (в частности, 0,1% геля эстрадиола гемигидрата (Дивигель) в виде саше или помпы). При этом ЗГТ для пациенток с ФГА подразумевает применение не низких доз эстрогенов, как у женщин перименопаузального периода, а, напротив, использование высоких доз, что относится к безопасному вмешательству, не блокирующему восстановление естественных овуляторных менструальных циклов после нормализации энергетического баланса или устранения стрессового фактора.
Заключение
Проведение последовательных диагностических мероприятий, следование четким алгоритмам, позволяющим своевременно верифицировать ФГА, и корректно подобранная заместительная гормональная терапия с трансдермальными эстрогенами позволят нивелировать симптомы заболевания, предотвратить развитие отдаленных осложнений в виде остеопороза и сердечно-сосудистых заболеваний.



