Активация тромбоцитов является не только важной составляющей физиологического функционирования системы гемостаза, ангиогенеза, реализации иммунологических реакций, но и патогенетической основой развития тромбозов, инфаркта миокарда, инсультов и других тромбоэмболических нарушений. Среднее количество тромбоцитов в крови беременных женщин составляет 213 000–250 000×109/л [1]. Тромбоцитопения характеризуется снижением количества тромбоцитов <150×109/л, является частым цитопеническим синдромом при гестации и встречается у 7–12% беременных женщин [2, 3]. До 75% тромбоцитопений патогенетически связаны с самой беременностью [4]. По некоторым данным, от 5–21% всех случаев тромбоцитопении у беременных развивается в результате активации внутрисосудистого свертывания крови на фоне гестационных осложнений, чаще всего преэклампсии [5]. Под воздействием таких факторов, как тромбин, коллаген, АДФ происходит активация тромбоцитов, которая функционально проявляется изменением формы и экспонированием вторичных рецепторов и белков клеточной поверхности тромбоцитов, ключевыми из которых являются GpIIb/IIIa и P-селектин [6]. Гетеродимер GpIIb/IIIa является наиболее многочисленным поверхностным рецептором тромбоцитов, активация которого происходит в результате передачи сигнала от рецепторов адгезии GPVI и GpIb/IX/V, рецепторов, связанных с G-белком, и рецепторов АДФ (P2Y1 и P2Y12). В процессе Сa2+-зависимой активации комплекс претерпевает ряд изменений, которые обеспечивают возможность связывания тромбоцита с фибриногеном [7–9]. Р-селектин (CD 62P) является белком клеточной поверхности и основным компонентом, который ответственен за образование тромбоцитарно-лейкоцитарных агрегатов и экспрессируется только активированными тромбоцитами [10]. Экспрессирование Р-селектина на поверхности тромбоцитов наиболее информативно в отношении оценки функциональной активности тромбоцитов, в том числе и на фоне применения антиагрегантных препаратов. Адекватный контроль функциональной активности тромбоцитов в настоящее время является нерешенной проблемой клинической лабораторной диагностики [11], в то время как оценка агрегационной активности тромбоцитов имеет большое значение, а контролируемая противотромботическая профилактика и терапия при подтвержденной активации внутрисосудистого свертывания позволяют предупредить развитие плацента-ассоциированных осложнений беременности.
На сегодняшний день основным, часто используемым и доступным методом, позволяющим оценить активность тромбоцитов, является оптический метод оценки индуцированной агрегации тромбоцитов по степени светопропускания [12]. Метод имеет ряд недостатков: условия забора крови при данном методе и последующее центрифугирование образцов активируют тромбоциты и искажают результат; нет четких критериев по концентрации индукторов, и в полной мере метод не позволяет достоверно оценить степень гиперагрегации тромбоцитов [11, 12]. Одним из современных иммунологических методов анализа структурных компонентов клеток крови является проточная цитометрия, которая проводится с использованием антител, меченных различными флуоресцентными красителями [6, 13–17]. По сравнению с другими способами оценки функциональной активности тромбоцитов, проточная цитометрия, возможно, наиболее адекватно отражает ситуацию in vivo, так как в основе заложена высокоспецифичная реакция антиген–антитело.
Цитометрический анализ с использованием различных флуоресцентных красителей и специфичных антител позволяет оценить показатели, напрямую связанные с гиперагрегацией тромбоцитов: образование микровезикул, тромбоцитарных и тромбоцитарно-лейкоцитарных агрегатов, экспрессирование и активацию рецепторов на поверхности тромбоцитов [12, 18, 19].
Цель исследования: изучить клиническую значимость иммунологического метода анализа функциональной активности тромбоцитов у беременных с тромбоцитопенией на фоне активации системы гемостаза.
Материалы и методы
В период с 2013–2018 гг. в ФГБНУ «НИИ АГиР им. Д.О. Отта» и в СПб ГБУЗ «Родильный дом № 6 им. проф. В.Ф. Снегирева» было проведено проспективное исследование с включением 299 беременных женщин в III триместре беременности. Выделено 2 группы: основную (n=249) составили пациентки с тромбоцитопенией (уровень тромбоцитов <150×109/л), контрольную (n=50) – женщины с нормальными показателями тромбоцитов при физиологически протекающей беременности.
Критерии включения в основную группу: беременные с тромбоцитопенией (количество тромбоцитов менее 150×109/л) в III триместре беременности (сроком гестации 28–30 недель) в возрасте от 20 до 40 лет.
Критерии исключения из основной группы: беременные с иммунной тромбоцитопенией (идиопатическая тромбоцитопеническая пурпура), с врожденной тромбоцитопенией, с наследственными и приобретенными коагулопатиями, системными аутоиммунными заболеваниями, сахарным диабетом 1 типа с генерализованными осложнениями, с тромбоцитопенией менее 50×109/л.
Критерии включения в группу контроля: беременные женщины в III триместре беременности, с нормальными показателями тромбоцитов, с физиологически протекающей беременностью.
Критерии исключения из группы контроля: беременные женщины в III триместре беременности с наличием акушерских осложнений: преэклампсия, плацентарная недостаточность, беременные с соматическими, хроническими заболеваниями.
Всем беременным женщинам, которые входили в группы исследования и находились под наблюдением, было проведено полное клинико-лабораторное и анамнестическое обследование, назначена индивидуальная терапия.
Наряду со стандартными методами обследования (клинический анализа крови с определением количества тромбоцитов, уровня гемоглобина, анализ коагулограммы) всем пациенткам, включенным в исследование, проводилась оценка индуцированной агрегации тромбоцитов (с АДФ в концентрации 2 мкМ и 0,2 мкМ) и оценка агрегационной активности тромбоцитов методом проточной цитофлуориметрии.
Технология проведения цитометрического исследования
Для исследования тромбоцитарной агрегации, определения количества GP IIb/IIIa и экспрессии Р-селектина на поверхности тромбоцитов венозную кровь собирали в вакуумные пробирки, содержащие 3,8% цитрата натрия в качестве антикоагулянта. Содержание количества рецепторов GP IIb/IIIa и Р-селектина на поверхности тромбоцитов определялись методом проточной цитометрии с использованием флуоресцентно меченых моноклональных антител CD61-FITC и CD62P-PE соответственно на проточном цитометре CYTOMICS FC 500 (Beckman Coulter, US).
Статистический анализ
Статистический анализ полученных данных проводился с использованием прикладных программ Microsoft Excel 2010 и IBM SPSS Statictics 23. Описание количественных данных представлены в виде медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1;Q3). Для проверки гипотезы о нормальности распределения применяли критерий Шапиро–Уилка. U-критерий Манна–Уитни применяли с целью обнаружения различий между выборками.
Для показателей, характеризующих качественные признаки, указывали абсолютное значение и относительную величину в процентах, проверку статистических гипотез о совпадении наблюдаемых и ожидаемых частот осуществляли с использованием точного критерия Фишера. Для бинарных признаков вычисляли отношение шансов (OШ) и 95%-ный доверительный интервал (95% ДИ). Критический уровень значимости различий (p), определен как p<0,05 .
Результаты
Группы были сопоставимы по возрасту (p=0,68); средний возраст пациенток основной группы составил 31,1 (27,8;35,0) года, контрольной – 30,7 (28,0;34,8) года. Медиана регистрации тромбоцитопении в основной группе определена как 23,1 (22,5;29,0) недели. Срок включения в исследование значимо в группах не различался и составил 28,8 (28,0;30,0) недели в основной группе и 29,4 (28,5;30,0) – в контрольной группе (p=0,15). Беременность без применения вспомогательных репродуктивных технологий наступила у 225(90,3%) женщин в основной группе и у 45(90%) женщин в контрольной группе (p=1).
Из всех обследованных женщин первобеременных в основной группе было 83 (33,3%) и в контрольной группе 19 (38%) женщин. Статистически значимые различия по паритету между группами не выявлены (p=0,52). Репродуктивные потери: неразвивающиеся беременности, выкидыши в анамнезе были, как в основной, так и в контрольной группе. Значимых отличий между группами нет (p>0,05).
Подробная сравнительная характеристика сопутствующей соматической и акушерской патологии представлена в таблице 1.

Как видно из таблицы 1, в результате анализа экстрагенитальной патологии выявлено, что частота встречаемости варикозной болезни с поражением вен нижних конечностей была значительно выше в группе беременных женщин с тромбоцитопенией – 71 (28,5%) по сравнению с группой беременных с нормальным количеством тромбоцитов и с физиологически протекающей беременностью – 6 (12%) (p=0,01). В результате изучения анамнеза было отмечено, что встречаемость преждевременной отслойки нормально расположенной плаценты и преждевременных родов были выявлены только у беременных с тромбоцитопенией 14 (5,6%) и 15 (5,8%), в контрольной же группе женщин с физиологически протекающей беременностью таких случаев отмечено не было 0(50) (p<0,05). У женщин с физиологически протекающей беременностью также не было в анамнезе случаев антенатальной и интранатальной гибели плода 0(50), по сравнению с женщинами с тромбоцитопенией (p<0,05). Анализ гинекологического анамнеза показал, что статистически значимые различия между группами отсутствуют (p=0,32). Наличие тромбоэмболических осложнений в анамнезе отмечено только в основной группе у 5(2%) женщин, в контрольной группе таких данных не получено (p=0,05). Подробная сравнительная характеристика показателей системы гемостаза обеих групп представлена в таблице 2.
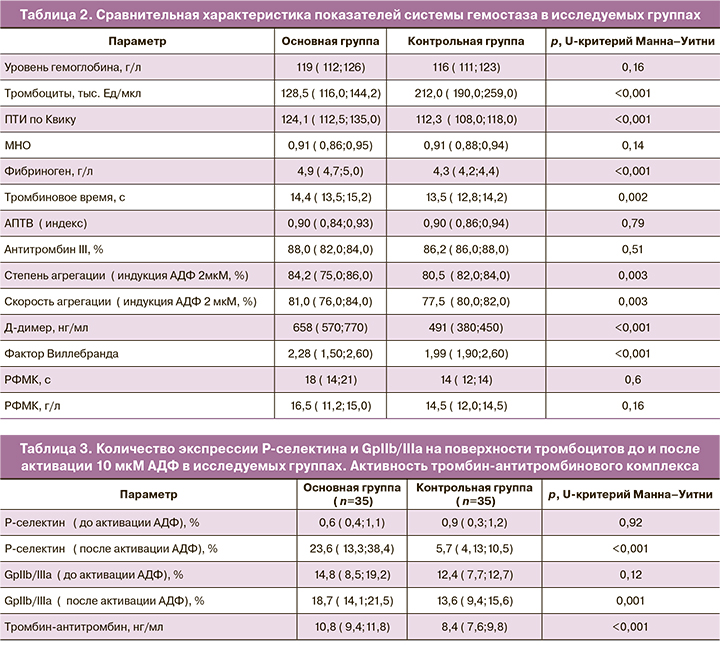
При анализе коагулологических показателей, которые представлены в таблице 2, уровни протромбинового индекса (ПТИ), тромбинового времени, фибриногена, Д-димера и количество фактора Виллебранда были значимо выше у беременных с тромбоцитопенией, по сравнению с женщинами с физиологически протекающей беременностью (p<0,05). Показатели: активированное парциальное тромбопластиновое время (АПТВ), антитромбин III, растворимый фибрин-мономерный комплекс (РФМК) и уровень международного нормализованного отношения (МНО) значимо не различались в исследуемых группах (p>0,05). Все числовые показатели крови, представленные в таблице 2, свидетельствуют в пользу активации внутрисосудистого свертывания крови в основной группе беременных женщин с тромбоцитопенией, по сравнению с контрольной группой.
Степень агрегации тромбоцитов в основной группе обследованных женщин была значимо выше, чем в контрольной группе и составила 84,2 (75,0;86,0), в контрольной группе – 80,5 (82,0;84,0) (p=0,003) (табл. 2). Скорость агрегации тромбоцитов в основной группе обследованных женщин была также выше, чем в контрольной группе и составила 81,0 (76,0;84,0), в контрольной группе – 77,5 (80,0;82,0) (p=0,003). Несмотря на статистически значимые различия между группами, разница в цифровых показателях незначительная.
 Анализ функциональной активности тромбоцитов с использованием проточной цитометрии у обследованных беременных женщин показал, что экспрессия P-селектина до активации АДФ в основной группе составила 0,6(0,4;1,1) в контрольной группе – 0,9 (0,3;1,2). Значимых различий в группах выявлено не было (p=0,92). После активации 10 мкМ АДФ отмечено статистически значимое увеличение экспрессии Р-селектина на поверхности тромбоцитов в основной группе – 23,6 (13,3;38,4), по сравнению с группой контроля – 5,7 (4,1;10,5) (p<0,001) (табл. 3). Наиболее выраженная экспрессия P-селектина после активации 10 мкМ АДФ была выявлена у беременных женщин с тромбоцитопенией (рис. 1), что доказывает активацию внутрисосудистого свертывания крови и высокую гиперагрегацию тромбоцитов. Количество GP IIb–IIIа на поверхности тромбоцитов до активации АДФ в основной группе составляло 14,8 (8,5;19,2), в контрольной группе – 12,3 (7,7;12,7) (табл. 3). Следует отметить, что количество рецепторов GP IIb/IIIa на поверхности тромбоцитов в отсутствие АДФ было несколько выше у беременных с тромбоцитопенией, чем в группе женщин с физиологически протекающей беременностью (p=0,12). Но статистически значимых различий в группах выявлено не было. После активации АДФ отмечается значимое увеличение количества GP IIb/IIIа в основной группе – 18,7 (14,1;24,5) по сравнению с контрольной группой – 13,6 (9,4;15,6) (рис. 2). Достоверное увеличение количества GP IIb/IIIа на поверхности тромбоцитов в группе беременных женщин с тромбоцитопенией свидетельствует в пользу значительной активации системы гемостаза, по сравнению с контрольной группой (p=0,001).
Анализ функциональной активности тромбоцитов с использованием проточной цитометрии у обследованных беременных женщин показал, что экспрессия P-селектина до активации АДФ в основной группе составила 0,6(0,4;1,1) в контрольной группе – 0,9 (0,3;1,2). Значимых различий в группах выявлено не было (p=0,92). После активации 10 мкМ АДФ отмечено статистически значимое увеличение экспрессии Р-селектина на поверхности тромбоцитов в основной группе – 23,6 (13,3;38,4), по сравнению с группой контроля – 5,7 (4,1;10,5) (p<0,001) (табл. 3). Наиболее выраженная экспрессия P-селектина после активации 10 мкМ АДФ была выявлена у беременных женщин с тромбоцитопенией (рис. 1), что доказывает активацию внутрисосудистого свертывания крови и высокую гиперагрегацию тромбоцитов. Количество GP IIb–IIIа на поверхности тромбоцитов до активации АДФ в основной группе составляло 14,8 (8,5;19,2), в контрольной группе – 12,3 (7,7;12,7) (табл. 3). Следует отметить, что количество рецепторов GP IIb/IIIa на поверхности тромбоцитов в отсутствие АДФ было несколько выше у беременных с тромбоцитопенией, чем в группе женщин с физиологически протекающей беременностью (p=0,12). Но статистически значимых различий в группах выявлено не было. После активации АДФ отмечается значимое увеличение количества GP IIb/IIIа в основной группе – 18,7 (14,1;24,5) по сравнению с контрольной группой – 13,6 (9,4;15,6) (рис. 2). Достоверное увеличение количества GP IIb/IIIа на поверхности тромбоцитов в группе беременных женщин с тромбоцитопенией свидетельствует в пользу значительной активации системы гемостаза, по сравнению с контрольной группой (p=0,001).
 Также проведен количественный анализ тромбин-антитромбинового комплекса, который представлен на рисунке 3, который показал, что у беременных с тромбоцитопенией данный показатель был достоверно выше и составил 10,8 (9,4;11,8), по сравнению с группой беременных с физиологически протекающей беременностью – 8,4 (7,6;9,8) (р<0,001) (табл. 3). Таким образом, все данные, полученные в исследовании, подтверждают гиперагрегацию тромбоцитов у беременных женщин с тромбоцитопенией, доказывают необходимость назначения препаратов ацетилсалициловой кислоты и низкомолекулярных гепаринов у данной группы пациенток с целью профилактики развития акушерских, плацента-ассоциированных осложнений беременности.
Также проведен количественный анализ тромбин-антитромбинового комплекса, который представлен на рисунке 3, который показал, что у беременных с тромбоцитопенией данный показатель был достоверно выше и составил 10,8 (9,4;11,8), по сравнению с группой беременных с физиологически протекающей беременностью – 8,4 (7,6;9,8) (р<0,001) (табл. 3). Таким образом, все данные, полученные в исследовании, подтверждают гиперагрегацию тромбоцитов у беременных женщин с тромбоцитопенией, доказывают необходимость назначения препаратов ацетилсалициловой кислоты и низкомолекулярных гепаринов у данной группы пациенток с целью профилактики развития акушерских, плацента-ассоциированных осложнений беременности.
Обсуждение
Активация системы гемостаза при беременности является фактором риска развития тромбогеморрагических осложнений как во время беременности, в родах, так и в послеродовом периоде. Женщины с наличием врожденных и приобретенных дефектов системы гемостаза составляют группу высокого риска по развитию гиперагрегации и гиперкоагуляции при беременности, что приводит к повышенному потреблению тромбоцитов и факторов коагуляции, нарушаются процессы имплантации и плацентации, происходит отложение фибрина и иммунных комплексов на мембране синцитиотрофобласта. Все эти процессы являются фактором риска развития плацента-ассоциированных осложнений беременности, таких как невынашивание беременности, преэклампсия, антенатальная гибель плода, плацентарная недостаточность и преждевременная отслойка нормально расположенной плаценты [20, 21]. В настоящее время золотым стандартом для анализа активности тромбоцитов выступает оптический метод оценки индуцированной агрегации тромбоцитов, предложенный Борном в 60-х гг. прошлого века. Данный метод хорошо подходит для анализа недостаточности функциональной активности тромбоцитов, но не дает полной информации об их гиперактивности [14]. Существенным недостатком метода индуцированной агрегации тромбоцитов также является длительность пробоподготовки, воздействие на тромбоциты ускорений при центрифугировании, потеря при этом наиболее активной фракции пластинок, а также эритроцитов и лейкоцитов, существенно влияющих на активность пластинок, трудность регистрации активации тромбоцитов по пропусканию в плазме [22]. Исследование трудоемкое, не может быть выполнено у постели больного. Оптические агрегометры способны обнаруживать только крупные тромбоцитарные сгустки, состоящие из более 100 клеток [22]. Поэтому многие исследователи рассчитывают изучить характеристику тромбоцитов с помощью проточной цитометрии. Данный метод используется для определения иммунного статуса пациентов, иммунофенотипирования при онкогематологических заболеваниях и других параметров иммунной системы [12, 23]. На сегодняшний день мало публикаций об использовании метода проточной цитометрии с целью определения содержания рецепторов GP IIb/IIIa и Р-селектина, как маркеров активации тромбоцитов, и факторов индивидуальной чувствительности клеток к антиагрегантным препаратам [18, 24, 25]. В исследовании Hollander J.E. et al. проведено изучение чувствительности и специфичности выявления P селектина на поверхности тромбоцитов с целью диагностики острой коронарной патологии. Доказана высокая специфичность данного показателя (71%) при выявлении острого инфаркта миокарда у пациентов с типичными клиническими проявлениями [26]. В работе отечественных исследователей Сироткиной О.В. проведена оценка содержания рецептора GP IIb/IIIa и экспрессирования Р-селектина на поверхности тромбоцитов до и после активации АДФ у пациентов с острым инфарктом миокарда. Количество GP IIb/IIIa на фоне АДФ у пациентов, получавших лечение препаратами ацетилсалициловой кислоты и клопидогрелем, составило менее 10%; число клеток, связывающихся с антителами к Р-селектину, на фоне приема аспирина увеличилось на 17%, при применении клопидогреля – лишь на 5%, что говорит об успешности применения препарата у данной категории больных [12]. В нашем исследовании мы оценили метод проточной цитометрии у беременных женщин с тромбоцитопенией в III триместре беременности с целью подтверждения гиперагрегации тромбоцитов. Мы анализировали содержание гликопротеинового рецептора GP IIb/IIIa и экспрессирование Р-селектина на поверхности неактивных тромбоцитов и клеток, активированных инкубацией с 10 мкм АДФ. У беременных женщин с тромбоцитопенией количество рецептора GP IIb/IIIa значительно возрастало после активации АДФ по сравнению с контрольной группой женщин с нормальным уровнем тромбоцитов и физиологически протекающей беременностью (p<0,05).
Однако наиболее информативным и наглядным в отношении оценки функциональной активности тромбоцитов оказалось экспрессирование Р-селектина на поверхности тромбоцитов. После активации АДФ количество клеток, экспрессирующих P-селектин, возрастало практически в 40 раз в группе беременных женщин с тромбоцитопенией и всего в 5 раз – в группе беременных с нормальным количеством тромбоцитов (p<0,01). Таким образом, можно считать, что параметр Р-селектин адекватно отражает активность тромбоцитов и может выступать маркером их гиперфункции. Метод проточной цитометрии может быть использован с целью подтверждения гиперагрегации тромбоцитов.
Заключение
Новые методики оценки функциональной активности тромбоцитов и лабораторного контроля ответа на антиагрегантную терапию крайне важны как для оценки целесообразности назначения препаратов ацетилсалициловой кислоты и низкомолекулярных гепаринов, индивидуальной чувствительности к аспиринсодержащим препаратам, так и для коррекции дозировок препаратов непосредственно во время лечения. Анализ функциональной активности тромбоцитов методом проточной цитометрии показал высокую чувствительность и эффективность у беременных с тромбоцитопенией, позволил подтвердить высокую функциональную активность тромбоцитов у данной группы пациенток и в дальнейшем вполне может быть использован в качестве лабораторного критерия для оценки гиперагрегации тромбоцитов наряду с оптическим методом оценки индуцированной агрегации тромбоцитов.



