Идиопатический привычный выкидыш (ПВ) – одна из дискуссионных проблем в современном акушерстве. При исключении генетических, анатомических, эндокринных, аутоиммунных, инфекционных и тромбофилических нарушений можно говорить об идиопатическом ПВ, когда иммунная система материнского организма отторгает антигены плода, ограничивая рост и инвазию трофобласта. Беременные с ПВ в анамнезе составляют группу риска по развитию поздних гестационных осложнений, связанных с плацентарной недостаточностью: задержки роста плода, антенатальной гибели плода, отслойки плаценты, преждевременных родов, хронической гипоксии плода.
Патогенез идиопатического ПВ активно изучается. В качестве одной из причин рассматривается слабая аллогенная стимуляция иммунной системы матери антигенами плода отцовского происхождения. Для усиления специфического ответа иммунной системы женщины на аллоантигены партнера используется процедура иммунизации женщин лимфоцитами полового партнера – иммуноцитотерапия (ИЦТ) [1, 2], которая проводится как в период прегравидарной подготовки, так и в первом триместре беременности. Еще одним методом предгестационной подготовки является гестагенная поддержка вне беременности второй фазы менструального цикла. Показано, что пероральный прием дидрогестерона в суточной дозе 20 мг оказывает иммуномодулирующее действие, опосредуемое CD8+-клетками, продукцией интерлейкина-4 (IL-4), индукцией локальных клеточных взаимодействий через звено Т-хелперов [3].
Один из показателей формирования ответа иммунной системы женщины на введение лимфоцитов партнера – появление в сыворотке крови антител к отцовским антигенам лейкоцитов: антиотцовских антилейкоцитарных антител (АОАТ). Мнения о возможности использования АОАТ в качестве маркера эффективности ИЦТ при привычном невынашивании беременности неоднозначны [4]. Среди причин противоречивых представлений о значимости АОАТ можно назвать отсутствие единого метода их определения, отсутствие рекомендаций по оптимальным срокам их выявления после иммунизации, а также возможные особенности структуры самих антител, появляющихся во время беременности [5].
Перспективным является метод определения АОАТ с помощью проточной цитометрии. Ранее нами было показано, что метод перекрестного реагирования позволяет выявлять АОАТ после ИЦТ в прегравидарной подготовке пациенток с идиопатическим ПВ [6, 7]. Однако до настоящего времени динамика продукции АОАТ в течение беременности, пролонгированной на фоне ИЦТ, не изучалась.
Целью настоящей работы было выявление закономерностей развития гуморальных иммунных реакций на фоне предгестационной ИЦТ и при ИЦТ во время беременности у пациенток с ПВ с помощью оценки уровня АОАТ.
Материал и методы исследования
Критериями включения в исследование явились: подписание формы информированного согласия на участие в исследовании, возраст женщины от 20 до 40 лет, самопроизвольное наступление беременности, отсутствие тяжелой соматической экстрагенитальной патологии.
Основную группу исследования составили 92 женщины с идиопатическим ПВ.
Критериями включения в группу пациенток с ПВ явились: наличие не менее 2 выкидышей до 12 недель гестации от одного и того же партнера (если в каждом случае был подтвержден нормальный кариотип абортуса), нормальный кариотип партнеров, отсутствие анатомических, аутоиммунных, тромбофилических, инфекционных и эндокринологических факторов потерь беременности.
Женщины основной группы были подразделены на следующие подгруппы: 23 женщины без предгестационной подготовки (группа БПП), которые обратились в Центр на ранних сроках беременности, в связи с чем обследование и подготовка не были проведены и 69 женщин с проведенной предгестационной подготовкой (группа с ПП).
ПП состояла из полного клинико-лабораторного обследования, терапии воспалительных заболеваний органов малого таза при их выявлении (в 81% случаев выявляли хронический эндометрит, сальпингит, цервицита, вагинит и др.). Толщина эндометрия у данных женщин во второй фазе менструального цикла была более 8 мм. Им был назначен пероральный прием фолиевой кислоты в дозе 1 мг в сутки. После проведения данных мероприятий приступали к проведению иммунотерапии в двух вариантах.
Первый вариант включал ИЦТ как монотерапию (группа ИЦТ, n=45), которую проводили дважды с интервалом в один месяц на 5–9-й день менструального цикла. При этом пациенткам внутрикожно вводили 50 млн клеток лимфоцитарной взвеси партнера в ладонную поверхность предплечья в 10–12 точек.
Второй вариант включал комбинацию ИЦТ с пероральным приемом дидрогестерона в дозе по 10 мг 2 раза в день с 14-го по 25-й день менструального цикла (группа ИЦТ+Д, n=24). Выбор гестагена – дидрогестерона – был обусловлен результатами исследования его эффективности у женщин с ПВ [8–10].
Во время беременности всем пациенткам основной группы проводили ИЦТ дважды с интервалом в один месяц на сроке в 5–6 недель и 8–9 недель согласно протоколу ведения беременности у пациенток с ПВ в сочетании с приемом дидрогестерона в дозах от 20 до 40 мг в зависимости от отсутствия или наличия признаков угрожающего выкидыша [2].
Определение АОАТ проводили через три недели после аллоиммунизации, соответственно в 8 и 12 недель гестации.
Контрольную группу составили 85 женщин на разных сроках физиологической беременности, среди которых было 57 первобеременных и 28 повторно беременных.
Кровь у женщин для исследования забирали натощак из локтевой вены на сроках 5–6, 8–9, 12, 16, 20, 25, 30, 34, 38 недель гестации.
Лимфоциты из цельной крови мужчины выделяли стандартным методом центрифугирования в градиенте плотности с использованием смеси фиколл-верографин плотностью 1,077 [11]. Сыворотку крови женщин получали после образования в течение 30 минут при комнатной температуре кровяного сгустка, который осаждали центрифугированием при 900 g в течение 10 минут. Перед проведением анализа сыворотку инактивировали в течение 30 минут при 56°С. Затем мужские лимфоциты инкубировали с женской сывороткой. АОАТ определяли методом перекрестного реагирования с помощью проточной цитометрии [12]. Уровень АОАТ в сыворотке женщины соответствовал доле мужских лимфоцитов, покрытых антителами к Fc-фрагменту иммуноглобулина G. В качестве контроля неспецифического связывания использовали инактивированную пулированную АВ-сыворотку. Определяли долю покрытых антителами Т-лимфоцитов, которые выявляли с помощью моноклональных антител к CD3, меченых фикоэритрином (Beckman Coulter, США). Анализ проводили на проточном цитофлуориметре FacsCalibur (Beckton Dickinson, США).
Статистическую обработку результатов проводили общепринятыми методами вариационной статистики с использованием пакета статистических программ для Microsoft Office Excel 2007 и с использованием программы MedCalc12 для Windows 7. Проверку гипотезы о нормальном распределении осуществляли, используя критерий Шапиро–Уилка. Представлены медиана, минимум и максимум распределения, а также среднее значение и стандартное отклонение (Mean±SD). Поскольку распределение данных отличалось от нормального, для оценки различий применяли U-критерий Манна–Уитни для независимых выборок. Различия считали достоверными при уровне значимости р<0,05.
Результаты исследований
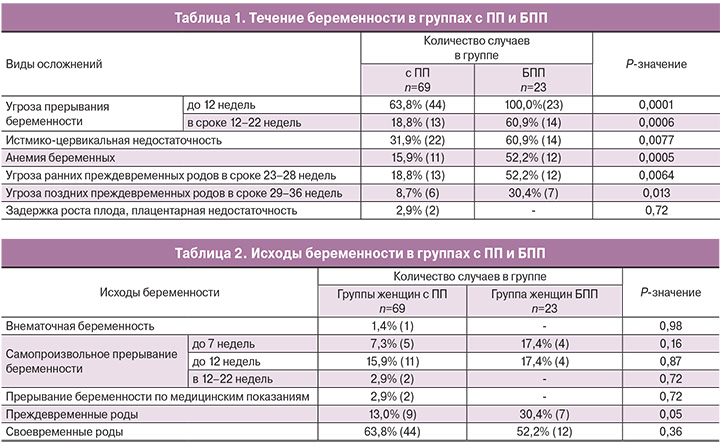
В табл. 1 и 2 представлен анализ течения и исходов беременностей, наблюдаемых в данном исследовании.
Установлено, что количество случаев осложненного течения беременности в группе БПП значимо выше (табл. 1), чем в группах с ПП, при этом у всех женщин группы БПП наблюдалась угроза прерывания беременности в I триместре, а угроза ранних преждевременных родов – в 52,2% случаев.
Своевременные роды в группе с ПП имели место в 63,8%, в группе БПП – в 52,2% наблюдений (табл. 2). Однако доля преждевременных родов в группе БПП была значимо выше (30,4%), чем в группе пациенток с ПП (13,0%). ПП в 81% случаев на первом этапе включала противовоспалительную терапию для пациенток с хроническими заболеваниями органов малого таза. Поэтому увеличение частоты преждевременных родов в группе БПП можно связать с отсутствием у этих пациенток такой терапии вне беременности.
По остальным критериям исходы беременностей у пациенток с разными видами иммуномодулирующей терапии, как свидетельствуют представленные данные, достоверно не различались. Во всех случаях неразвивающихся беременностей были диагностированы аномалии кариотипа у плода. Необходимо отметить, что всем пациенткам за период наблюдения во время беременности проводилась идентичная терапия, направленная на пролонгирование беременности и лечение возникающих осложнений (прием дидрогестерона, токолитическая терапия по показаниям). По-видимому, этим фактом обусловлено отсутствие достоверных различий в исходах беременностей в группе с ПП и группе БПП.
У пациенток всех трех групп проведена оценка динамики АОАТ на фоне ИЦТ.
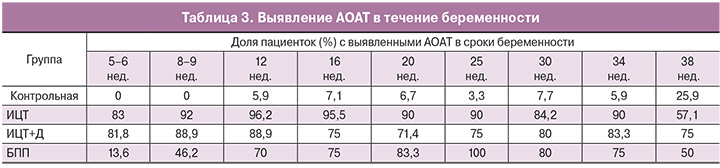
В табл. 3 представлены данные о частоте выявления АОАТ в течение беременности, пролонгированной на фоне ИЦТ, проведенной в I триместре и у женщин контрольной группы.

Как следует из данных табл. 3, в группах пациенток, прошедших ПП, включающую ИЦТ, частота выявления АОАТ варьировала от 75 до 90%, начиная с 5–6 недель до 34 недель беременности, при этом не отличалась в группах с ИЦТ и ИЦТ+Д и не зависела от срока беременности. В группе БПП частота выявления АОАТ в 5–6 недель и в 8–9 недель была ниже по сравнению с группами с ПП, а начиная с 12 недель гестации уровень АОАТ во всех подгруппах основной группы был одинаков. В контрольной группе беременных АОАТ выявлялись не более чем в 7,7% случаев до 34 недели беременности, однако перед родами количество случаев выявления существенно увеличилось, что может указывать на активацию иммунной системы женщин перед родами. Анализ абсолютных значений уровня АОАТ представлен в табл. 4.
При анализе данных табл. 4 обращает на себя внимание, что в 5–6 и 8–9 недель гестации уровень АОАТ в группах ИЦТ и ИЦТ+Д был значительно выше, чем в контрольной группе и в группе БПП (р<0,05). Начиная с 12 недель уровень АОАТ у пациенток в группе БПП стал сходным с уровнем в группах с прегравидарной иммунотерапией, включающей ИЦТ, и оставался на таком уровне непосредственно до родов.
Динамика выработки АОАТ в исследуемых группах представлена на рисунке.
Как видно на рисунке, в сроке 38 недель отмечается увеличение содержания АОАТ в контрольной группе, но оно оказалось незначимым по сравнению с уровнем в начальные сроки беременности. Интересно, что в группе ИЦТ содержание АОАТ в 38 недель обнаружило яркую тенденцию к снижению (р=0,055). При этом перед родами различий в уровне АОАТ между группами не выявлено.
Обсуждение
Интерес к исследованиям АОАТ обусловливается одной из гипотез о формировании толерантности во время беременности, связанной c преимущественно гуморальным типом иммунного реагирования иммунной системы матери на аллоантигены плода во время беременности. Полученные в данной работе результаты в целом не противоречат уже известным данным. Например, известно, что у женщин с физиологическим течением беременности регистрируется низкий уровень антител, но они могут быть обнаружены начиная с 28 недели гестации [13]. В нашей работе показано увеличение случаев выявления АОАТ к концу беременности. Возможно, это связано с преобладанием в нашей выборке пациенток с физиологическим течением первой беременности (в два раза больше, чем повторно беременных) и с отсутствием многорожавших женщин, для которых характерен высокий уровень АОАТ [14, 15]. Также есть данные о том, что в первом триместре беременности антитела зарегистрированы только у 5% женщин с нормально протекающей беременностью и у 10% женщин с ПВ [9]. По нашим данным, у 5–10% женщин АОАТ выявлялись, начиная с 12 и до 30 недель гестации, а у женщин с ПВ, не получавших предварительную ПП, в 5–6 недель АОАТ были выявлены у 13,6%. АОАТ при физиологической беременности практически не выявляются и, возможно, это обусловлено их особой структурой, вследствие чего их обозначают как асимметричные антитела [5]. Показано, что во время беременности прогестерон-индуцированный блокирующий фактор (ПИБФ), продуцируемый активированными лимфоцитами, оказывает влияние на В-лимфоциты, заключающееся в увеличенной продукции асимметричных антител, которые не обладают эффекторными функциями, но посредством блокирования антигенов плода способствуют развитию механизмов его защиты. Было показано, что пропорция асимметричных IgG была значимо выше в супернатантах культур гибридомных клеток, культивируемых в присутствии ПИБФ, и выявлена положительная связь между содержанием асимметричных антител в сыворотке крови и экспрессией ПИБФ на лимфоцитах [16].

Целью настоящей работы была оценка динамики АОАТ у пациенток с ПВ на фоне ИЦТ – иммунизации клетками лимфоцитарной взвеси партнера. Ранее нами было показано, что уровень АОАТ, достигнутый после ИЦТ в качестве ПП пациенток с ПВ, сохраняется в I триместре беременности [7]. Результаты данной работы свидетельствуют о том, что у пациенток с ПВ БПП, но получающих ИЦТ в ранние сроки наступившей беременности, уровень АОАТ увеличивается к концу I триместра, и достигнутый уровень становится сходным с таковым в группах пациенток с ПВ, получавших ИЦТ также и в качестве ПП.
Обнаруженная яркая тенденция к снижению уровня АОАТ к моменту родов (р=0,055, рисунок) в группе ИЦТ, возможно, свидетельствует об естественном снижении уровня выявляемых антител, связанном с увеличением временного периода после окончания иммунизации. Отсутствие различий в содержании АОАТ между группами в сроке 38 недель наряду с увеличением уровня АОАТ в этом сроке в контрольной группе может объясняться изменением состояния иммунной системы беременных перед родами.
Заключение
Значимое превышение доли преждевременных родов в группе пациенток с ПВ в группе забеременевших БПП, а также течение беременности у этих пациенток с большим числом осложнений в сроках до 22 недель свидетельствует о необходимости проведения ПП, включающей этап противовоспалительной терапии. Уровень АОАТ в ранние сроки беременности значимо выше у пациенток с прегравидарной иммунотерапией, включающей иммунизацию женщин аллогенными лимфоцитами партнера. У пациенток БПП уровень АОАТ постепенно нарастает после каждой процедуры иммунизации в I триместре до уровня у пациенток с ПП. Следовательно, появление АОАТ во время беременности у пациенток с ПВ является следствием процедуры иммунизации женщин клетками лимфоцитарной взвеси партнеров, что свидетельствует о значимости теста АОАТ как отражающего иммуномодулирующее действие процедуры аллоиммунизации.



