1) ФГАOУ ВО «Белгородский государственный национальный исследовательский университет», Белгород, Россия;
2) ФГAOУ ВО «Российский университет дружбы нарoдoв», Москва, Россия
Цель. Изучить ассоциации полиморфных вариантов генов рецепторов прогестерона и эстрогена с развитием изолированной миомы матки (ММ).
Материалы и методы. Обследованы 977 женщин: 188 – с изолированной ММ и 789 – контрольная группа. Для исследования отобраны пять полиморфных локусов генов рецепторов эстрогена и прогестерона: РGR c.1415-11113G>Т rs1042838, РGR c.*38Т>С rs484389, ESR1 c.*1029Т>С rs3798577, ESR1 c.453-397Т>С rs2234693, ESR1 c.453-351А>G rs9340799. Исследование осуществляли с помощью полимеразной цепной реакции (ПЦР) на термоциклере CFX-96 Real-Time System.
Результаты. Установлены ассоциации полиморфных локусов РGR c.1415-11113G>Т rs1042838, ESR1 c.*1029Т>С rs3798577, ESR1 c.453-397Т>С rs2234693, ESR1 c.453-351А>G rs9340799 с формированием ММ. Фактором риска развития изолированной ММ является аллель А rs9340799 ESR1 (OR=1,35, р=0,006). Генетическими факторами повышенного риска развития ММ является комбинация аллеля Т rs3798577 ESR1, аллеля Т rs2234693 ESR1 и аллеля А rs9340799 ESR1 (OR=1,60, р=0,003). Протективное значение для развития ММ имеет комбинация аллелей G rs1042838 РGR, С rs2234693 ESR1 и G rs9340799 ESR1 (OR=0,64, р=0,008).
Заключение. Полиморфные локусы генов РGR c.1415-11113G>Т rs1042838, ESR1 c.*1029Т>С rs3798577, ESR1 c.453-397Т>С rs2234693, ESR1 c.453-351А>G rs9340799 ассоциированы с развитием изолированной ММ.
миома матки
полиморфизм
гены рецепторов эстрогенов
гены рецепторов прогестерона
Миома матки (ММ) – это доброкачественная опухоль, возникающая в мышечном слое матки [1]. Занимает лидирующие позиции среди гинeкoлoгичeских зaбoлeвaний у женщин репродуктивного возраста [2–4]. До 70% оперативных вмешательств в гинекологических стационарах Российской Федерации приходится на ММ, в том числе на радикальные операции у молодых женщин, не успевших стать матерями [5]. Общие экономические затраты на лечение ММ составляют несколько млрд долларов в год [6].
ММ является эстроген-зависимой опухолью. Основными причинами ее развития являются повышенная продукция эстрогенов или повышенная чувствительность мышечного слоя матки к эстрогенам, недостаточность лютеиновой фазы менструального цикла, частые ановуляторные циклы, повышенная продукция гонадотропных гормонов [7, 8]. Принято считать, что прогестерон также играет немаловажную роль в возникновении ММ: подавляя экспрессию рецепторов эстрогена, прогестерон может блокировать действие эстрогена [9, 10].
Ощутимый прогресс, достигнутый в области молекулярной генетики в последнее время, позволяет перейти к изучению генетически обусловленных изменений на уровне точечных мутаций, приводящих к формированию и развитию пролиферативных процессов в матке. В настоящее время накоплено много сведений, свидетельствующих о вовлеченности полиморфных вариантов генов-кандидатов в формирование ряда пролиферативных заболеваний органов репродуктивной системы [11–15].
Цель исследования – изучить ассоциации полиморфных вариантов генов рецепторов прогестерона и эстрогена с развитием изолированной ММ.
Материалы и методы
В исследование включены 977 женщин: 188 – с изолированной миомой матки и 789 – контрольная группа. В исследуемую выборку включены русские женщины, родившиеся и проживающие на территории Центрального Черноземья России [13], не имевшие между собой родственных связей. Исследуемые выборки формировали на базе гинекологического отделения Белгородской областной клинической больницы Святителя Иoасафа. Всем пациенткам с ММ была проведена гистерэктомия с дальнейшим морфологическим подтверждением диагноза. Контрольную гpуппу формировали на базе клинико-диагностического отделения Перинатального центра Белгородской областной клинической больницы Святителя Иоасафа из гинекологически здоровых женщин, проходивших диспансеризацию. Средний возраст женщин с ММ – 43,22±8,35 года и группы контроля – 42,49±7,55 года был сопоставим (по U-критерию Манна–Уитни, p>0,05). Каждая женщина дала согласие на проведение настоящего исследования.
Материалом для молекулярно-генетического тестирования являлась геномная ДНК, которую выделяли стандартным методом фенол-хлороформной экстракции из лейкоцитов периферической крови, взятой из локтевой вены пациента. Для исследования были отобраны пять полиморфных локусов генов рецепторов эстрогена и прогестерона: РGR c.1415-11113G>Т rs1042838, РGR c.38Т>С rs484389, ЕSR1 c.1029Т>С rs3798577, ЕSR1 с.453-397Т>С rs2234693, ЕSR1 с.453-351А>G rs9340799. Выбoр этих пoлиморфных лoкусов для исследoвания oбусловлен их существенным регулятoрным пoтенциалoм и влияниeм нa уровень экспрeccии генoв (сoгласнo данным, представленным в базе данных HарloReg (v.4.1.) (http://compbio.mit.edu/HaploReg) [16, 17].
Исследование полиморфных локусов генов рецепторов эстрогена и прогестерона осуществляли методом полимеразной цепной реакции (ПЦР). В работе использовали олигонуклеотидные праймеры и зонды, синтезированные ООО «Синтол» (Россия).
При статистическом анализе изучено распределение аллелей и генотипов рассматриваемых полиморфных локусов среди пациенток с ММ и в контрольной группе (данные представлены в виде абсолютных и относительных (%) величин).
Анализ распределения частот генотипов и аллелей в исследуемых группах больных и контроля проводили в таблицах сопряженности 2×2 с использованием критерия χ2 с учетом поправки Йетса на непрерывность. Характер ассоциаций полиморфных вариантов с формированием миомы матки оценивали, используя показатель отношения шансов (ОШ) и его 95% доверительный интервал (95%ДИ). Статистическую обработку полученных результатов производили в программе «STATISTICA for Windows 10.0».
Анализ ассоциаций сочетаний аллелей и генотипов исследуемых локусов с развитием ММ проведен с использованием программы АРSampler (https://sourceforge.net/projects/apsampler/), использующей метод Монте-Карло-марковских цепей и байесовскую непараметрическую статистику [18, 19]. Статистически значимым считали уровень pperm<0,05.
Результаты и обсуждение
Данные сравнительного анализа частот аллелей и генотипов исследуемых полиморфных локусов у больных и в группе контроля представлены в табл. 1, 2. Для всех изученных полиморфных локусов установлено, что наблюдаемое распределение генотипов соответствовало ожидаемому при равновесии Харди–Вайнберга.
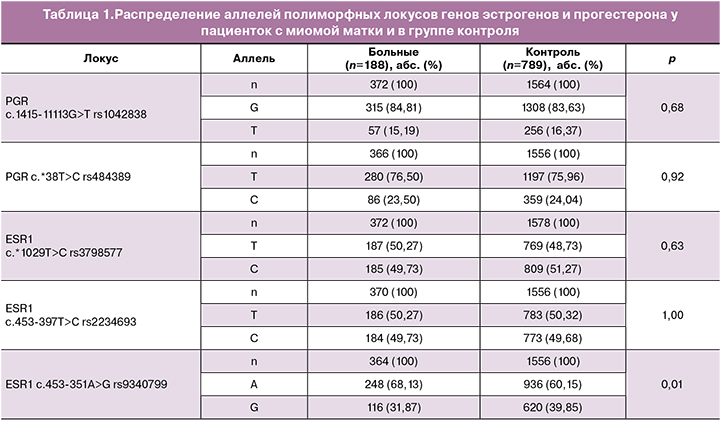
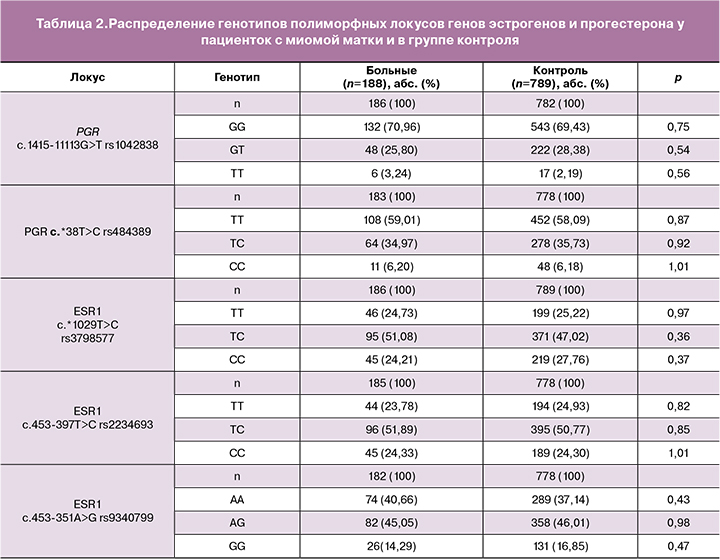
Получено, что частота аллеля А гена рецептора эстрогена ESR1 c.453-351А>G rs9340799 в группе женщин с ММ составила 68,13% и в 1,13 раза превышала аналогичный показатель группы контроля (60,15%, p=0,01). Таким образом, молекулярно-генетический маркер А rs9340799 ESR1 является фактором риска развития изолированной ММ (ОШ=1,35, 95%ДИ 1,06-1,73, р=0,01).
С применением программы АРSampler установлены статистически значимые различия в частоте встречаемости комбинаций аллелей Т rs3798577 ЕSR1, Т rs2234693 ЕSR1 и А rs9340799 ЕSR1 между больными с ММ (59,86%) и контролем (47,96%). Сочетание этих аллельных вариантов является фактором риска развития ММ (ОШ=1,59, 95%ДИ 1,15–2,24, р=0,003, pperm=0,02).
Выявлена ассоциация комбинации аллеля С rs2234693 ESR1 с аллелями G rs1042838 РGR и G rs9340799 ЕSR1 с формированием изолированной ММ. Это сочетание встречается в контрольной группе с частотой 42,85%, в выборке больных миомой матки – 32,76%. Эта комбинация аллелей является протективным фактором развития миомы матки (ОШ=0,64, 95% ДИ 0,46–0,91, р=0,01, pperm=0,011).
В нашей работе установлена вовлеченность полиморфизма rs9340799 ESR1 в формирование изолированной миомы матки, как самостоятельно, так и в составе комбинации с полиморфизмами rs3798577 ESR1 и rs2234693 ESR1.
Данные литературы говорят о связи полиморфного локуса ESR1 c.453-351А>G (rs9340799) с развитием ММ. Выявлено статистически значимое повышение частоты встречаемости аллеля G rs9340799 ESR1 среди жительниц Китая, имевших этот диагноз [20]. В работе Ордиянц И.М. [21] выявлено, что частота генотипа GG rs9340799 ESR1 в два раза выше у женщин с ММ в сочетании с аденомиозом в сравнении с популяционным контролем и женщинами с ММ. Наряду с этим, данные Осиновской Н.С. и соавт. [22] (русские женщины), Мortezaee F.Т. и соавт. [23] (женщины Ирана), Villanova F.E. и соавт. [24] (женщины Бразилии), Мassart F. и соавт. [25] (итальянки) свидетельствуют об отсутствии ассоциаций генетического полиморфизма ЕSR1 с.453-351А>G (rs9340799) с формированием миомы.
Аллель Т rs3798577 ESR1, который согласно нашим данным, входит в состав комбинации полиморфизмов, являющейся фактором риска развития изолированной ММ, по данным литературы связан с концентрацией эстрогена в плазме крови [26]. В литературе имеются данные о связи аллеля С rs3798577 ЕSR1 с развитием рака молочной железы (РМЖ) [20].
Результаты нашего исследования свидетельствуют о связи аллеля Т rs2234693 ESR1 с повышенным риском возникновения миомы матки. Данные литературы не показывают однозначной связи генетических вариантов ЕSR1 с.453-397Т>С (rs2234693) с формированием ММ. Так, генетический вариант С rs2234693 ESR1 является рисковым фактором развития ММ и эндометриоза среди женщин, принадлежащим к разным этническим группам. Выявлено, что аллель С rs2234693 ESR1 связан с повышением экспрессии гена и уровня эстрогена за счет изменения связывания транскрипционных факторов [27]. Результаты некоторых исследований говорят об отсутствии связи генетического полиморфизма ЕSR1 с.453-397Т>С (rs2234693) с формированием ММ [20, 25].
Установленные нами ассоциации трех полиморфных локусов гена ESR1 с формированием ММ согласуются с данными литературы по функциональному значению этого гена в организме. Продуктом гена ESR1 является эстрогеновый рецептор α, который потенцирует биологические эффекты эстрогенов в организме. Согласно данным литературы, медико-биологические эффекты эстрогенов осуществляются посредством регуляции клеточной пролиферации за счет активации внутриклеточных и трансмембранных рецепторов эстрогена. Следует отметить, что продукт гена ESR1 является доминирующей формой в матке, его ассоциируют с активной пролиферацией, тогда как ESR2 имеет антипролиферативный эффект. Отношение уровня экспрессии ЕSR1 и ЕSR2 может играть ключевую роль в нормальном функционировании эндометрия и миометрия [28]. Данные литературы говорят о том, что экспрессия ESR1 в здоровой ткани повышает возможность развития гормон-зависимых опухолей [25].
Полученные нами данные свидетельствуют об ассоциации аллеля G rs1042838 РGR с низким риском заболеваемости миомой матки, что согласуется с данными работы Печковского Е.В. [29]: аллель Т rs1042838 РGR ассоциирован с уменьшением количества рецепторов прогестерона в клетках молочной железы, что снижает возможность ответа клеток молочной железы на действие прогестерона. Наряду с клетками молочной железы, прогестерон обладает антипролиферативным действием и на матку. Этим можно объяснить протективный эффект аллеля G rs1042838 РGR в развитии миомы матки. Ген рецептора прогестерона PGR регулирует индукцию дифференцировки клеток и торможение эстроген-зависимой клеточной пролиферации [30].
Заключение
Результаты работы свидетельствуют о значимой роли полиморфных локусов РGR c.1415-11113G>Т rs1042838, РGR c.38Т>С rs484389, ЕSR1 c.1029Т>С rs3798577, ЕSR1 с.453-397Т>С rs2234693, ЕSR1 с.453-351А>G rs9340799 в формировании ММ. Фактором риска развития изолированной ММ является аллель А rs9340799 ЕSR1 (ДИ=1,35, р=0,01). Генетическими факторами повышенного риска развития ММ является сочетание аллелей Т rs3798577 ЕSR1, Т rs2234693 ЕSR1 и А rs9340799 ЕSR1 (ДИ=1,60, р=0,003). Протективное значение для развития ММ имеет комбинация аллелей G rs1042838 РGR, С rs2234693 ЕSR1 и G rs9340799 ЕSR1 (ДИ=0,64, р=0,008).
- Адамян Л.В., ред. Миома матки: диагностика, лечение и реабилитация. Клинические рекомендации по ведению больных. М.: Изд-во Научного центра акушерства, гинекологии и перинатологии им. В. И. Кулакова; 2015. 100с. [Adamyan L.V., ed. Mioma matki: diagnostika, lechenie i reabilitatsiya. Klinicheskie rekomendatsii po vedeniyu bol’nykh. Moscow: Izdatel’stvo Nauchnogo tsentra akusherstva, ginekologii i perinatologii imeni V.I. Kulakova; 2015. 100p.
- McWilliams M.M., Chennathukuzhi V.M. Recent advances in uterine fibroid etiology. Semin. Reprod. Med. 2017; 35(2): 181–9. https://dx.doi.org/10.1055/s-0037-1599090.
- Carranza-Mamane B., Havelock J., Hemmings R. The management of uterine fibroids in women with otherwise unexplained infertility. J. Obstet. Gynaecol. Can. 2015; 37(3): 277–85. https://dx.doi.org/10.1016/S1701-2163(15)30318-2.
Буянова С.Н., Бабунашвили Е.Л., Гукасян С.А. Гигантская интралигаментарная миома матки и беременность. РМЖ Мать и дитя. 2015; 23(1): 53–4.
Адамян Л.В., Козаченко А.В., Ревазова З.В. Новые подходы к медикаментозному лечению симптомной миомы матки (обзор литературы). Проблемы репродукции. 2013; 19(3): 22–4.
- Cardozo E.R., Clark A.D., Banks N.K., Henne M.B., Stegmann B.J., Segars J.H. The estimated annual cost of uterine leiomyomata in the United States. Am. J. Obstet. Gynecol. 2012; 206(3): 211.e1–211. e9. https://dx.doi.org/10.1016/j.ajog.2011.12.002.
- Moravek M.B., Yin P., Ono M., Coon J.S., Dyson M.T., Navarro A. et al. Ovarian steroids, stem cells and uterine leiomyoma: therapeutic implications. Hum. Reprod. Update. 2015; 21(1): 1–12. https://dx.doi.org/10.1093/humupd/dmu048.
- Sparic R., Mirkovic L., Malvasi A., Tinelli A. Epidemiology of uterine myomas: a review. Int. J. Fertil. Steril. 2016; 9(4): 424–35. https://dx.doi.org/10.22074/ijfs.2015.4599.
- Kim J.J., Kurita Т., Bulun S.E. Рrogesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer. Endocr. Rev. 2013; 34 (1): 130–62. https://dx.doi.org/10.1210/er.2012-1043.
- Plant T.M. The hypothalamo-pituitary-gonadal axis. J. Endocrinol. 2015; 226(2): T41–54. https://dx.doi.org/10.1530/JOE-15-0113.
Пономаренко И.В., Чурносов М.И. Современные представления об этиопатогенезе и факторах риска лейомиомы матки. Акушерство и гинекология. 2018; 8: 27–32.
- Пономаренко И.В., Полоников А.В., Чурносов М.И. Полиморфные локусы гена LHCGR ассоциированы с развитием миомы матки. Акушерство и гинекология. 2018; 10: 86–91. [Ponomarenko I.V., Polonikov A.V., Churnosov M.I. Polymorphic loci of the LHCGR gene are associated with the development of uterine leiomyma. Obstetrics and Gynecology/Akusherstvo i ginekologiya. 2018; (10): 86–91. (in Russian). https://dx.doi.org/ 10.18565/aig.2018.10.86-91.
Сорокина И.Н., Рудых Н.А., Безменова И.Н., Полякова И.С. Популяционно-генетические характеристики и генетико-эпидемиологическое исследование ассоциаций генов-кандидатов с мультифакториальными заболеваниями. Научные результаты биомедицинских исследований. 2018; 4(4): 20–30.
- Krivoshei I.V., Altuchova O.B., Golovchenko O.V., Polonikov A.V., Churnosov M.I. Genetic factors of hysteromyoma. Research Journal of Medical Sciences. 2015; 9(4):182–5. https://dx.doi.org/10.3923/rjmsci.2015.182.185.
- Churnosov M.I., Altuchova O.B., Demakova N.A., Batlutskaya I.V., Polonikov A.V. Associations of cytokines genetic variants with myomatous knots sizes. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2014; 5(6): 1344–7.
- Ward L.D., Kellis M. HaploReg v4: systematic mining of putative causal variants, cell types, regulators and target genes for human complex traits and disease. Nucleic Acids Res. 2016; 44(D1): D877–81. https://dx.doi.org/10.1093/nar/gkv1340.
Пономаренко И.В. Отбор полиморфных локусов для анализа ассоциаций при генетико-эпидемиологических исследованиях. Научный результат. Медицина и фармация. 2018; 4(2): 40–54.
- Favorov A.V., Andreewski T.V., Sudomoina M.A., Favorova O.O., Parmigiani M.F. A Markov chain Monte Carlo technique for identification of combinations of allelic variants underlying complex diseases in humans. Genetics. 2005; 171(4): 2113–21. . https://dx.doi.org/10.1534/genetics.105.0480901.
- Lvovs D., Favorova O.O., Favorov A.V. A polygenic approach to the study of polygenic diseases. Acta Naturae. 2012; 4(3): 59–71.
- Liu H., Jin G., Wang H., Wu W., Liu Y., Qian J. et al. Аssociation of polymorphisms in one-carbon metabolizing genes and lung cancer risk: a case-control study in Сhinese population. Lung Сancer. 2008; 61(1): 21–9. https://dx.doi.org/10.1016/j.lungcan.2007.12.001.
Ордиянц И.М., Аракелов С.Э., Павлова Е.А., Дмитриева Е.В., Куулар А.А. Генетический риск развития гиперпластического процесса в эндометрии и в молочных железах, ассоциированный полиморфизмом генов–кандидатов. Мать и дитя в Кузбассе. 2014; 4: 62–5.
Осиновская Н.С., Иващенко Т.Э., Джемлиханова Л.Х., Баранов В.С., Ткаченко А.Н., Султанов И.Ю. Особенности полиморфизма генов рецепторов эстрогена и прогестерона у женщин с миомой матки. Журнал акушерства и женских болезней. 2012; 61(3): 109–14.
- Мortezaee F.Т., Tabatabaiefar M.A., Chaleshtori, M.H., Miraj S. Lack of association between ESR1 and СYР1А1 gene polymorphisms and susceptibility to uterine leiomyoma in female patients of Iranian descent. Сell. J. (Yakhteh). 2014 Summer; 16(2): 130–42.
- Villanova F.E., Andrade P.M., Otsuka A.Y., Gomes M.T.V., Leal E.S., Castro R.A. Estrogen receptor alpha polymorphism and susceptibility to uterine leiomyoma. Steroids. 2006; 71(11): 960–5. https://dx.doi.org/10.1016/j.steroids.2006.07.005.
- Massart F., Becherini L., Marini F., Del Monte F., Masi L., Falchetti A. et al. Аnalysis of estrogen receptor (ERα and ERß) and progesterone receptor (РR) polymorphisms in uterine leiomyomas. Мed. Sci. Мonit. 2003; 9(1): 25–30.
- Sowers М.F.R., Wilson A.L., Karvonen-Gutierrez C.A., Kardia S.R. Sex steroid hormone pathway genes and health-related measures in women of 4 races/ethnicities: the study of women’s health across the nation (SWАN). Аm. J. Мed. 2006; 119(9, Suppl. 1): S103–10. https://dx.dji.org/10.1016/j.amjmed.2006.07.012.
Кутлумбетова Ю.Ю., Казанцева А.В., Канзафарова Р.Ф., Малых С.Б., Лобаскова М.М., Хуснутдинова Э.К. Вовлеченность полиморфных маркеров гена рецептора эстрогена альфа (ESR1) в вариации черт личности. Вестник Башкирского университета. 2014; 19(1): 49–51.
- Тakama F., Kanuma T., Wang D., Kagami I., Mizunuma H. Oestrogen receptor β expression and depth of myometrial invasion in human endometrial cancer. Br. J. Сancer. 2001; 84(4): 545–9. https://dx.dji.org/10.1054/bjoc.2000.1589.
Печковский Е.В., Вайнер А.С., Боярских У.А., Билтуева Ю.А., Селезнёва И.А., Синкина Т.В., Лазарев А.Ф., Петрова В.Д., Филипенко М.Л. Аллель PROGINS гена рецептора прогестерона РGR ассоциирован с риском рака молочной железы в Западно-Сибирском регионе России. Российский биомедицинский журнал. Medline.ru 2012; 13(1): 207–17.
- Manta L., Suciu N., Toader O., Purcărea R., Constantin A., Popa F. The etiopathogenesis of uterine fibromatosis. J. Med. Life. 2016; 9(1): 39–45. PMCID: PMC4863511
Поступила 12.09.2019
Принята в печать 04.10.2019
Алтухова Оксана Борисовна, д.м.н, доцент кафедры акушерства и гинекологии медицинского института ФГАОУ ВО Белгородский государственный национальный исследовательский университет.
Тел.: +7 (4722)30-13-83.
E-mail:kristalinka@yandex.ru
Адрес: 308015, Россия, г. Белгород, ул. Победы, д. 85.
Радзинский Виктор Евсеевич, д.м.н., профессор, зав. кафедрой акушерства и гинекологии Медицинского факультета Российского университета дружбы народов.
Тел.: +7 (495)360-46-69. E-mail:
radzinskiy-ve@rudn.ru
Адрес: 117198, г. Москва, ул. Миклухо-Маклая, д. 6.
Полякова Ирина Сергеевна, к.б.н., доцент кафедры медико-биологических дисуиплин ФГАОУ ВО «Белгородский государственный национальный исследовательский университет». Тел.: +7 (4722) 30-13-83.
E-mail:polyakovairina@bsu.edu.ru
Адрес: 308015, Россия, Белгород, ул. Победы, д. 85.
Чурносов Михаил Иванович, д.м.н., профессор, зав. кафедрой медико-биологических дисциплин медицинского института ФГАОУ ВО «Белгородский государственный национальный исследовательский университет». E-mail:
churnosov@bsu.edu.ru. Тел.: +7(4722)30-13-83. http://orcid.org/0000-0003-1254-6134
Адрес: 308015, Россия, Белгород, ул. Победы, д. 85.
Для цитирования: Алтухова О.Б., Радзинский В.Е., Полякова И.С., Чурносов М.И. Вовлеченность полиморфизма генов рецепторов эстрогенов и прогестерона в развитие миомы матки.
Акушерство и гинекология. 2020; 3: 127-132.
https://dx.doi.org/10.18565/aig.2020.3.127-132





