В настоящее время отмечается увеличение количества случаев хронических воспалительных заболеваний внутренних половых органов у женщин, и в особенности, хронического эндометрита (ХЭ), частота которого составляет от 2,6% до 71% [1, 2]. ХЭ занимает первое место среди внутриматочной патологии у пациенток с бесплодием, встречаясь у 65,2% из них [3]. Еще более часто он отмечается у женщин с привычным невынашиванием беременности – от 45 до 86,7% случаев и более [3].
Известно, что для нормального развития беременности фундаментальное значение имеет полноценная имплантация, которая возможна только при наличии рецептивного эндометрия, эмбриона, достигшего стадии бластоцисты, и локальной иммуносупрессии [4].
Молекулярные исследования, посвященные изучению рецептивности при патологии эндометрия, позволили идентифицировать маркеры имплантации такие, как пиноподии, интегрин αvβ3, LIF, Е-катгерины, HOX-гены и др. [5]. Однако они применяются лишь в научных исследованиях, а использование даже наиболее изученных из них, в настоящее время в клинической практике не доступно [5].
Одним из маркеров рецептивности эндометрия является а2-микроглобулин фертильности (АМГФ), или гликоделин А, который представляет собой димерный гликопротеин, продуцируемый железами секреторного эндометрия. Данные многих авторов свидетельствуют о том, что нарушения имплантации и/или плацентации, ведущие к потере беременности, связаны среди прочих и с дефицитом продукции АМГФ в эндометрии [6]. В исследованиях проведенных Bastu E. et al. (2015) замечено, что у пациенток с невынашиванием беременности и бесплодием неясного генеза значительно снижен уровень АМГФ в крови в период «окна имплантации» [7].
В отечественной и зарубежной литературе встречаются противоречивые данные об информативности показателей сывороточного и тканевого уровня АМГФ для прогнозирования репродуктивных нарушений, а его динамика на фоне комплексного восстановительного лечения у женщин после несостоявшегося выкидыша остается неизученной.
Цель исследования – оценить уровни АМГФ у пациенток после несостоявшегося выкидыша и в динамике восстановительного лечения.
Материал и методы исследования
Дизайн: простое открытое проспективное нерандомизированное паралелелльное клиническое исследование.
Объект исследования: включено 90 пациенток после вакуум-аспирации полости матки по поводу несостоявшегося выкидыша (НВ) в первом триместре гестации. Они случайным образом были разделены на три группы: I – 30 пациенток, которым были проведены процедуры орошения полости матки кавитированными растворами в комплексе с пелоидотерапией на фоне антибактериальной терапии; II – 30 пациенток получали курс сочетанной пелоидетерапии и антибактериальную терапию; III – 30 пациенток, получавшие только антибиотик. Кроме того была сформирована контрольная (IV) группа из 28 женщин без НВ в анамнезе для контроля показателей АМГФ.
Критерии включения в исследование: возраст 25–35 лет; НВ в сроке до 12 недель (код по МКБ-10: O02.1); овуляторный менструальный цикл; изокоагуляция крови; наличие добровольного информированного согласия.
Критерии исключения из исследования: острые инфекционные заболевания; гинекологические заболевания: миома матки, эндометриоз, пороки развития; ИППП без предварительной санации; резус-отрицательная кровь; злокачественные новообразования любой локализации; тяжелая соматическая патология; туберкулез любой локализации; заболевания эндокринной системы; аллергические реакции на используемые для орошения полости матки лекарственные растворы; противопоказания к ультразвуковой и пелоидотерапии.
Методы исследования: использованы методы исследования, применяемые в общей клинической практике и в гинекологии, по стандартным методикам: лабораторные – микроскопия мазков влагалищного секрета; функциональные – ультразвуковое исследование органов малого таза в динамике во II фазу менструального цикла (на 21–23 дни) в период «окна имплантации»; морфологические – исследование биоптатов эндометрия в цикле прерывания НВ и на 7–10 день шестого менструального цикла после прерывания НВ.
Содержание АМГФ оценивалось в менструальной крови трехкратно после каждого курса лечения (забор проводился на второй день цикла). Менструальная кровь собиралась с помощью вагинального зеркала, откуда ее аспирировали пипеткой, помещали в пробирку Эппендорфа и отправляли для исследования. Концентрацию АМГФ определяли методом иммуноферментного анализа с использованием наборов реагентов ООО «Диатех-ЭМ» по инструкции производителей.
Основанием для забора материала на 2-й день менструального цикла являлось: увеличение концентрации АМГФ начинается во время последней недели лютеиновой фазы («окно имплантации») и достигает пика к началу менструации; высокий уровень АМГФ сохраняется в течение первых дней следующего цикла [8].
Методы лечения: антибактериальная терапия проводилась пациенткам всех 3-х групп в соответствие с клиническими рекомендациями и включала доксициклин в дозе 100 мг два раза в день в течение 5–7 дней.
Пациентки I группы получали процедуры орошения полости матки с помощью растворов, кавитированных низкочастотным ультразвуком аппаратом ФОТЕК АК101. Использовали: во время 1-го курса – 0,05% раствор водного хлоргексидина, во 2 и 3-м – 0,05% раствор имунофана со стерильным физиологическим раствором в соотношении 1/50. Частота ультразвуковых колебаний 25 кГц, расход лекарственного раствора 100–150 мл/мин., объем инфузии 200–300 мл. Курс состоял из пяти процедур, каждая из которых длилась 3–4 минуты. Первый курс лечения проводили в цикле прерывания НВ начиная с 5–7-х суток и далее – в каждом последующем менструальном цикле в эти же дни, всего – 3 курса.
Выбор лекарственных препаратов сделан на основании характеристик, представленных в инструкции к препаратам. Основные параметры предложенного способа лечения, такие как применение препаратов хлоргексидин и имунофан по новому назначению в растворах для ультразвукового орошения полости матки, количество и длительность процедур, а также количество курсов лечения определены на основании предыдущих исследований, обоснованы к применению, как дающие в своем комплексе положительный лечебный результат (подтверждено патентом на изобретение №2571236 от 19 ноября 2015 г.) [9]. Методика рекомендована для использования в учреждениях практического здравоохранения [10].
Для пелоидотерапии применяли иловые сульфидные грязи озера Тамбукан (Кабардино-Балкария) минерализацией 83 г/л, влажностью 60%, в состав которой входят: органические вещества в пересчете на сухую грязь – 2,2–2,5%, сульфиды в пересчете на сырую грязь – 0,15–0,26%, катионы магния, натрия, калия, сернистого железа, анионы хлора.
В I группе во время 3-го курса кавитационного орошения полости матки непосредственно после процедуры вводили грязевые тампоны per rectum в объеме 200–250 г. Во II группе также применяли грязевые тампоны per rectum и накладывали грязевые аппликации на низ живота толщиной 2,5–3 см. Пелоид применяли на 5–7 день в третьем менструальном цикле после прерывания НВ температурой 38–42◦С, продолжительностью 15–20 мин, на курс – 10 процедур. Методика рекомендована для использования в учреждениях практического здравоохранения [11, 12].
Проводился один курс пелоидотерапии в обеих группах. Обосновано это тем, что реакции организма, вызванные применением пелоидов, и их лечебное действие продолжаются и после окончания процедур (фаза последействия) еще на протяжении 3–4 месяцев.
Комплексное применение ультразвукового орошения с пелоидотерапией взаимно потенцирует лечебный эффект обоих способов и обосновано Рационализаторским предложением (№ 18–1522 от 12.04.2018) [13]. Основанием для проведения восстановительного лечения явилось положение о высокой частоте развития ХЭ после НВ (по данным отдельных авторов – до 100%) при отсутствии реабилитационных мероприятий [14].
Исследование проведено с учетом требований международных и российских законодательных актов о юридических и этических принципах медико-биологических исследований у человека, одобрено этическим комитетом Дагестанского государственного медицинского университета Минздрава России (протокол № 5 от 23 марта 2017 г.). Все пациентки дали свое информированное добровольное согласие на участие в исследовании.
Статистическая обработка полученных результатов проведена с помощью пакета прикладных программ Statistica.6.0 и программного обеспечения Microsoft Excel 2000. Нормальность распределения определяли с помощью критерия Колмогорова-Смирнова. Оценка статистической значимости различий средних величин проведена с использованием t-критерия (критерия Стьюдента). Полученные данные представлены в виде среднего и стандартного отклонения [M(SD)]. При сравнении нескольких групп между собой использовали поправку Бонферрони. За уровень значимости в исследовании принято р<0,05. Количественную оценку взаимосвязи лечебного фактора и исхода оценивали по величине отношения шансов (ОШ). Для демонстрации силы связи вычисляли 95% доверительный интервал (95% ДИ) по методу Woolf. С помощью расчета относительного риска (ОР) проводили количественную оценку вероятности исхода, связанного с действием лечебного фактора. Рассчитывали также число больных, которых необходимо лечить (от англ. number needed to treat – NNT) — эпидемиологический показатель, используемый в оценке эффективности медицинского вмешательства (идеальный показатель NNT равен 1, когда все больные выздоравливают от лечения, а в контрольной группе никто не выздоравливает). Данный показатель в настоящей работе использовали для оценки эффективности лечения по второй контрольной точке – частоте наступления беременности (в течение одного года после лечения по данным катамнеза). Расчет проводился по формуле:
NNT = 1 / (АСР),
где: АСР – абсолютное снижение риска, или – разница между частотой событий (наступление беременностей) в экспериментальной и контрольной группах, при этом частота наступления беременностей представлялась дробным числом по отношению к общему числу наблюдений в группе.
Результаты исследования
Общая клиническая характеристика пациенток. Возраст варьировал от 26 до 35 лет и в среднем составил 29,8(8,2): в I группе – 31,3(3,5), во II – 28,5(6,8) (рI-II =0,08), в III – 29,7(7,7) лет (рI-III =0,09, рII-III =0,09).
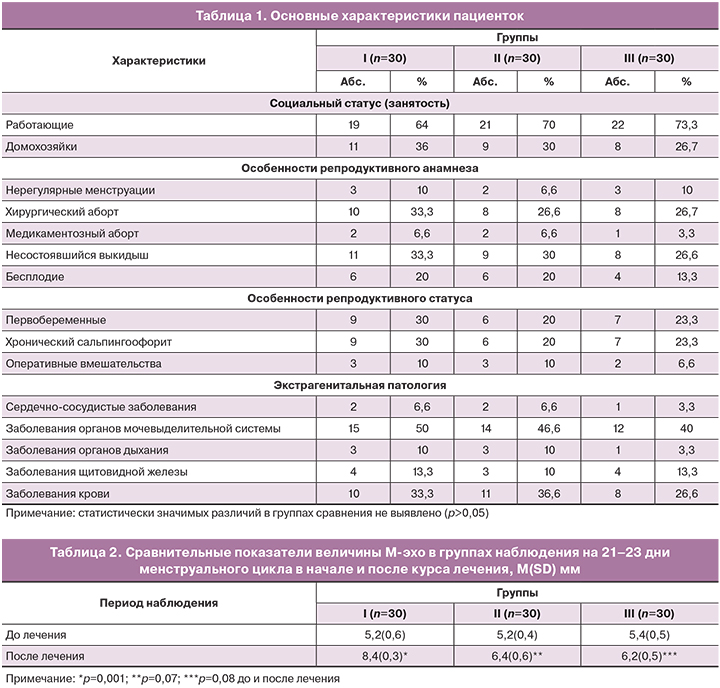
Клинико-статистический анализ анамнеза, социального статуса, состояния репродуктивного и общесоматического здоровья, показал, что группы были сопоставимы по основным анализируемым в работе параметрам (табл. 1). Все обследованные женщины проживали в идентичных климато-географических условиях (г. Махачкала), имели среднее (18,5%), средне-специальное (40,9%) и высшее (40,6%) образование. Вредных условий труда среди работающих не выявлено.
Гестация прекратилась в первом триместре в 100% случаев. Чаще всего беременность останавливалась в сроке 7 недель – 43,4%.
Контрольную группу составили 28 условно здоровых женщин в возрасте 30,5(4,4) лет (р=0,09 по сравнению с I, II группами), которые не имели в анамнезе самопроизвольных выкидышей или неразвивающихся беременностей, воспалительных заболеваний женской репродуктивной системы, имели регулярный овуляторный менструальный цикл и обратились в женскую консультацию для выбора контрацепции. Их социальные характеристики были аналогичны I и II группам, и они отвечали критериям исключения.
Пациентки I, II групп предъявляли жалобы, наиболее частыми из которых были кровянистые выделения и ноющие боли внизу живота – 46,6%, только ноющие боли – 27%, мажущие выделения из половых путей – 4,5%, общая слабость – 4,1%, не имели жалоб – 17,8%.
Результаты функциональных методов исследования. Проведена оценка толщины М-эхо по данным УЗИ в динамике терапии (табл. 2). Статистически значимые различия данного показателя до и после лечения получены только в I группе пациенток, получавших комплексное лечение.
Результаты лабораторных методов исследования. По результатам анализа микрофлоры вагинального тракта у каждой третьей женщины с НВ выявлен дисбиоз различной степени выраженности, динамика которого в результате лечения представлена в таблице 3.

Морфологическое исследование аспирата из полости матки при прерывании НВ показало признаки неразвивающейся беременности с различной степенью выраженности отека и некроза стромы ворсин хориона, признаками гнойного (15, 10, 12% в I, II и III группах соответственно, р=0,10) или серозного (33, 30, 29% соответственно, р=0,09) воспаления децидуальной ткани.
Через 6 месяцев после лечения в I и II группах гистологическая картина, которая соответствовала ранней стадии фазы пролиферации без признаков воспалительной реакции стромы, встречалась у 75 и 54% пациенток соответственно (р=0,003), умеренная стромальная лимфоидная инфильтрация – у 20 и 31% соответственно (р=0,06), гистологическая картина не соответствовала фазе менструального цикла и была выявлена децидуализация стромы – у 5% в обеих группах. Гипертрофический эндометрит был выявлен в 10% случаев – только во II группе.
В сравнении с этими данными, в III группе пациенток гистологическая картина ранней стадии фазы пролиферации без признаков стромальной лимфоидной инфильтрации отмечалась только в 35% наблюдениях (рI-III=0,001, рII-III=0,003). Наиболее часто определялась картина гипертрофического эндометрита – в 42% случаев (р=0,001 по сравнению с I и II группами). Картина эпителия желез эндометрия в фазе пролиферации со стромальной лимфоидной реакцией – в 13%, децидуализация стромы эндометрия – в 5%, атрофический эндометрит – в 5% случаев. То есть, морфологическая картина ХЭ в III группе наблюдалась у 65% пациенток.
Во всех трех группах (суммарно) выявлено статистически значимое (р<0,001) снижение содержания АМГФ в 4,5 раз по сравнению с группой контроля (табл. 4).
После трех курсов восстановительного лечения в I группе удалось достичь нормального уровня содержания исследуемого белка. У пациенток II группы после курса пелоидотерапии достичь нормального содержания АМГФ не удалось. В III группе – динамики не наблюдалось.
Отдаленные результаты (катамнез). Вторичным критерием оценки эффективности лечения в данном исследовании было количество наступивших беременностей и их исходы в течение одного года (табл. 5).
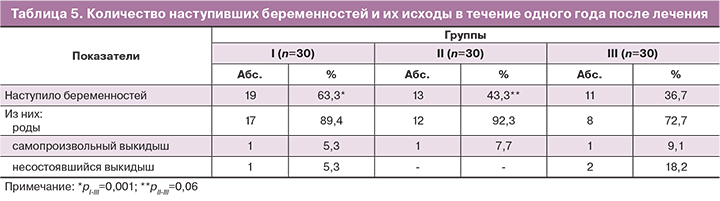
Влияние лечебного комплекса на исход (наступление беременности) в I группе составило ОШ=2,98 (95% ДИ: 1,04–8,53), во II – ОШ=1,32 (95% ДИ: 0,47–3,72). Количественная вероятность наступления беременности – ОР = 1,73 (95% ДИ: 1,0–2,97) и ОР=1,18 (95% ДИ: 0,63–2,20) соответственно. Число больных, которых необходимо лечить – 3,8 и 15,2 соответственно.
Обсуждение результатов
АМГФ – димерный гликопротеин с высокой степенью гликозилирования, молекулярная масса которого варьирует от 42 до 56 кД, был открыт советскими учеными [15, 16]. Функция АМГФ заключается в иммуносупрессивном влиянии на эндометрий и локальном подавлении иммунного ответа матери на развивающийся эмбрион, необходимый для имплантации и сохранения беременности [17].
При патологии репродукции нарушения структурной перестройки эндометрия могут проявляться в снижении образования АМГФ. Установлено, что при неразвивающейся беременности в эндометрии имеет место ретардация желез с резким падением продукции АМГФ [18]. Поэтому дефицит АМГФ рассматривают как один из патогенетических механизмов ранней потери беременности, связанный с нарушением иммунотолерантности [17]. Данное положение подтверждается настоящим исследованием, в котором установлено, что уровни АМГФ у женщин после НВ в 4,5 раз ниже по сравнению со здоровыми.
Серьезной проблемой современной гинекологии является отсутствие разработанной технологии воздействия на нерецептивный эндометрий. Описанные в литературе способы повышения рецептивности эндометрия разрозненны, имеют весьма низкую эффективность и доказательную базу. Гормонотерапия нерецептивного эндометрия недостаточно эффективна. Средства, улучшающие микроциркуляцию и реологические свойства крови, действуют на системном, но не на локальном уровне. Это связано с отсутствием точки приложения для лечебного воздействия — полноценного рецепторного аппарата эндометрия, низким уровнем синтеза рецепторных белков, молекул адгезии, структурными перестройками эндометриальных желез с преобладанием стромального фиброза [5]. Все эти аспекты требуют поиска новых способов воздействия на нерецептивный эндометрий.
В ходе настоящего исследования была выявлена положительная динамика содержания АМГФ на фоне восстановительного лечения. При этом максимальный эффект был достигнут у пациенток, получавших орошение полости матки кавитированными растворами в комбинации с пелоидотерапий, в меньшей степени – только при пелоидотерапии. Без изменений уровень АМГФ оставался при проведении антибактериальной терапии без физиотерапевтического воздействия.
Учитывая, что при хронических воспалительных процессах нарушается структурная перестройка и отсутствуют адекватные секреторные преобразования эндометриальных желез, наблюдается уменьшение их секреторной активности, снижение секреции АМГФ можно рассматривать как косвенный признак развития ХЭ. Это явление наблюдалось в настоящем исследовании в группе пациенток, получавших только антибактериальную терапию, что является обоснованным с этиологической, но не с патогенетической точки зрения.
Обсуждая механизмы действия кавитированных растворов, следует отметить, что именно кавитация обеспечивает наиболее ценные биологические эффекты ультразвука, такие как бактерицидное действие, усиление поступления в ткани лекарственных веществ, противовоспалительное, трофическое и регенераторное действие [19]. В многочисленных экспериментах показано, что низкочастотный ультразвук оказывает потенциально важное воздействие на функциональную активность эпителиальных клеток, которое может заметно влиять на восстановление тканей и процессы регенерации. Низкочастотный ультразвук вызывает расширение кровеносных сосудов и увеличение регионарного кровотока в 2–3 раза, инициирует благоприятные изменения в микроциркуляторном русле и адвентиции сосудов, развитие коллатерального кровотока [20, 21].
Доказаны эффекты низкочастотного ультразвука в отношении восстановления рецепторного поля эндометрия после НВ и при ХЭ [22]. Выявлена потенция кавитированных жидких сред в восстановлении уровня экспрессии эстрогеновых рецепторов (ERα) преимущественно в железах эндометрия и прогестероновых рецепторов (PR) в железах и строме эндометрия до уровня, сопоставимого с контрольными значениями [23].
Ценным терапевтическим действием пелоидотерапии является нормализация микроциркуляции, что благоприятно влияет на местный воспалительный процесс: происходит рассасывание патологических продуктов воспаления, улучшается снабжение тканей энергетическими и пластическими веществами, что способствует восстановлению разрушенных структур. В целом лечебные свойства пелоидов способствуют нормализации окислительно-восстановительных процессов, стабилизации мембранных структур и регенерации тканей. Вызванные грязелечением реакции организма продолжаются и после окончания курса лечения [24].
Таким образом, при проведении комплексного восстановительного лечения пациенток после НВ, включающей орошение полости матки кавитированными растворами и пелоидотерапию, удалось достичь нормализации уровня АМГФ, который является показателем функционального состояния эндометрия и дополняет данные морфологического исследования.
Заключение
Проведенное исследование показало, что восстановление эндометрия после перенесенного НВ не происходит самостоятельно, а заканчивается хронизацией воспалительного процесса и морфофункциональной недостаточностью эндометрия в 65% случаев, о чем свидетельствуют данные морфологического исследования и низкие уровни АМГФ [9,5 (2,6) мкг/мл] у пациенток, не получавших восстановительного лечения.
Комплексное применение кавитационного орошения полости матки и грязелечения у пациенток после НВ приводит к статистически значимому увеличению уровня АМГФ [44,1(8,2) мкг/мл] в менструальной крови сопоставимому с контрольной группой [40,3(2,4) мкг/мл, р=0,001] и свидетельствует о нормализации структуры и функции эндометрия, что подтверждается его морфологическим исследованием и наступлением беременности у 63,3% пациенток.



