Современные подходы в программах вспомогательных репродуктивных технологий (ВРТ) – это высокая частота циклов с витрифицированным эмбрионом, и практикующий врач сталкивается с вопросом выбора вида криопротокола [1–4]. С одной стороны, перенос эмбриона в овуляторном цикле, когда рост эндометрия происходит за счет работы доминантного фолликула, будет предпочтителен для пациентки из-за меньшей гормональной нагрузки и обеспечит приверженность лечению. С другой стороны, с увеличением доли пациенток, планирующих криоперенос, в старшем репродуктивном возрасте повышается частота гинекологических заболеваний: миома матки, наружный генитальный эндометриоз, гиперплазия эндометрия, фолликулярные кисты яичников требуют медикаментозной коррекции [5–7]. В таких случаях применение агонистов гонадотропин-рилизинг-гормона (ГнРГ) перед криопереносом снижает негативное влияние перечисленных заболеваний на имплантацию, но рост эндометрия далее может быть обеспечен только приемом препаратов эстрогена. Метаболизм эстрогена связан с работой фермента катехол-О-метилтрансферазы (СОМТ) [8]. Полиморфизм GG детерминирует синтез фермента с более высокой активностью, который обеспечивает метилирование гидроксиформ эстрогенов и переводит их в безопасные метоксиформы. Полиморфизмы GA и AA связаны с меньшей активностью этого фермента [9]. У носительниц этих вариантов может происходить накопление гидроксиформ эстрогенов, и есть вероятность повышения риска образования хинонов, имеющих негативное влияние на ДНК [10]. Оценить уровень метилирования эстрогенов можно по соотношению этих метаболитов в моче. Наше исследование впервые оценивает уровни эстрогенов в крови и уровни метаболитов в моче на их пиковой концентрации в цикле криопереноса с учетом генетического полиморфизма фермента, осуществляющего метилирование и детоксикацию метаболитов эстрогена.
Цель исследования: сравнить содержание метаболитов эстрадиола в моче женщин с различными полиморфизмами гена COMT rs4680, которым проводилось ЭКО с витрифицированным эмбрионом в овуляторном цикле и «длинном» протоколе с заместительной гормональной терапией (ЗГТ).
Материалы и методы
В исследование включены 28 протоколов ЭКО с витрифицированным эмбрионом, из них 11 – в овуляторном цикле (ОЦ) с гестагенной поддержкой, 17 – в «длинном» протоколе с ЗГТ. Протокол в ОЦ включал ультразвуковой (УЗ) мониторинг овуляторного цикла с использованием триггера овуляции (Овитрель 6500 п/к или ХГЧ 5000 в/м) при наличии фолликула 17–18 мм; старт приема препарата дидрогестерона через 37 ч в дозировке 10 мг 3 раза в сутки, перенос эмбриона проводили через 124–125 ч от действия прогестерона. «Длинный» протокол применяли у пациенток с рецидивирующей гиперплазией эндометрия в анамнезе, аденомиозом II–III степени и ранними овуляциями в естественном цикле. Циклу криопереноса предшествовало назначение агониста ГнРГ с 17–19-го дня цикла (Диферелин 3,75 мг). Старт препаратов эстрогена (Дивигель по 1 г 2 раза на кожу) проводился после УЗ-контроля через 3–6 недель действия агониста ГнРГ. Далее также проводился мониторинг роста эндометрия и назначался препарат прогестерона (Дюфастон по 10 мг 3 раза в сутки или Утрожестан по 200 мг 3 раза во влагалище) при наличии эндометрия более 8 мм, перенос эмбриона проводили через 124–125 часов действия препарата.
Все пациентки получали прегравидарную подготовку согласно рекомендациям клинического протокола МАРС 2021 и были обследованы в соответствии с Приказом №803н. Проводился гормональный мониторинг цикла ЭКО в двух точках исследования. Точка 1 в первом протоколе – в день введения триггера овуляции, в «длинном» – в день назначения препарата прогестерона, что соответствовало максимальному уровню эстрадиола в цикле при достигнутой оптимальной толщине эндометрия и под контролем над стартом прогестерона. Все лабораторные исследования проводились в лаборатории «Хеликс», они включали определение содержания в крови эстрадиола (пг/мл), прогестерона (нмоль/л). Кроме этого, проводили анализ утренней порции мочи на метаболиты эстрогенов с расчетом соотношений метилированных и гидроксилированных форм эстрона и эстрадиола с использованием метода высокоэффективной жидкостной хроматография с тандемным масс-спектрометрическим детектированием (лаборатория «Хеликс»). В день переноса (точка 2) повторно проводился анализ крови на гормоны эстрадиол (пг/мл), прогестерон (нмоль/л). Всем пациенткам проводилась оценка полиморфизмов rs 4680 гена СОМТ в лаборатории «Геномед», определяли аллели AA, AG или GG.
Перенос эмбриона осуществлялся с использованием УЗ-контроля катетером Kitazato #213325 или TDT. Пациентки сразу вставали после проведенного переноса. Диагностика наступления беременности проводилась через 14 дней посредством анализа крови на хорионический гонадотропин человека (ХГЧ) и визуализации плодного яйца в полости матки через 21 день после переноса эмбриона. Для каждой женщины производили расчет частоты имплантации, вычисляя его как отношение числа плодных яиц к числу перенесенных эмбрионов, выраженное в процентах [11].
Статистический анализ
Статистический анализ полученных результатов проводился при помощи пакета программ Statistica 6.0 (Statsoft, США). Для количественных признаков рассчитывалась среднее значение и его среднеквадратичное отклонение (М (SD)), для качественных – абсолютная величина (n) и доля (%) от общего объема группы. При межгрупповом сравнении показателей (их распределение отличалось от нормального согласно значению критерия Шапиро–Уилка) использовали критерий Манна–Уитни. Различия между качественными признаками проверялись при помощи точного теста Фишера, так как хотя бы в одной ячейке таблицы сопряженности было менее 5 объектов. Если достигнутый уровень различий не превышал 0,05, их считали статистически значимыми [12].
Результаты
Большинство пациенток, включенных в исследование, были старшего репродуктивного возраста, их средний возраст составил 39,1 (5,7) года, минимальный – 28 лет, максимальный – 53 года. Исследование полиморфизмов гена COMT показало, что 7/28 пациенток (25%) имели аллель АА, 12/28 пациенток (43%) – аллель GA и у 9/28 (32%) был выявлен аллель GG.
Частота протоколов в ОЦ и «длинного» с ЗГТ оказалась сопоставимой у женщин с различными полиморфизмами (табл. 1), поэтому мы оценили различия в метаболизме эстрогенов внутри подгрупп, сформированных в зависимости от выявленного аллея гена COMT (табл. 2).
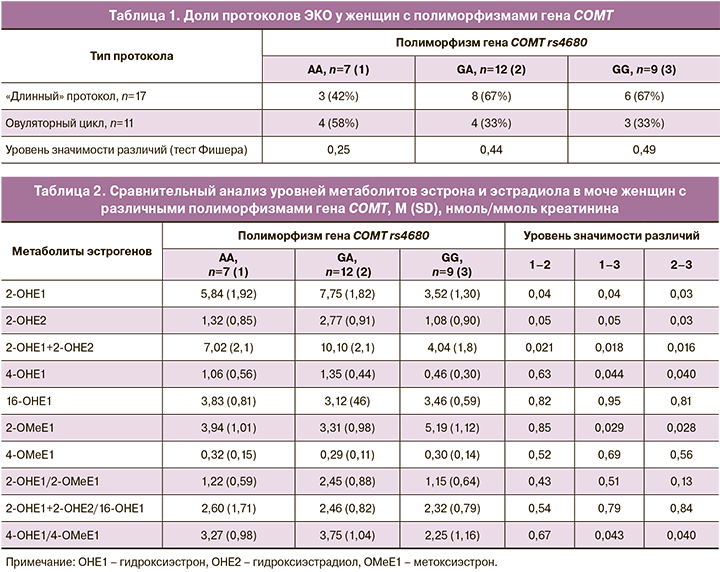
Сравнительный анализ показал, что у женщин с разными аллелями гена COMT уровни гидроксилированных и метоксилированных эстрона и эстрадиола имеют свои особенности. Носительницы полиморфизма GG показали более низкие уровни 2-ОНЕ1 и 4-ОНЕ2, но более высокое содержание в моче метоксилированного метаболита 2-ОМеЕ1, чем те пациентки, у которых выявили аллели АА и GA (табл. 2). Отношение гидроксилированных форм к метоксилированным у носительниц варианта GG было значимо меньше такового у пациенток с аллелями АА и GA. Следовательно, резонно предположить, что метоксилирование эстрогенов у обладательниц полиморфизма GG происходит более активно.
В группе женщин с полиморфизмом АА трое проходили лечение бесплодия в «длинном» протоколе и четверо – в ОЦ. Поскольку «длинный» протокол сопряжен с дополнительной эстрогеновой нагрузкой на организм, провели оценку уровня метаболитов эстрогенов в зависимости от типа протокола (табл. 3). Оказалось, уровни изучаемых метаболитов в зависимости от протокола различались, однако не в сторону преобладания гидроксилированных форм в моче женщин, проходивших лечение по «длинному» протоколу.
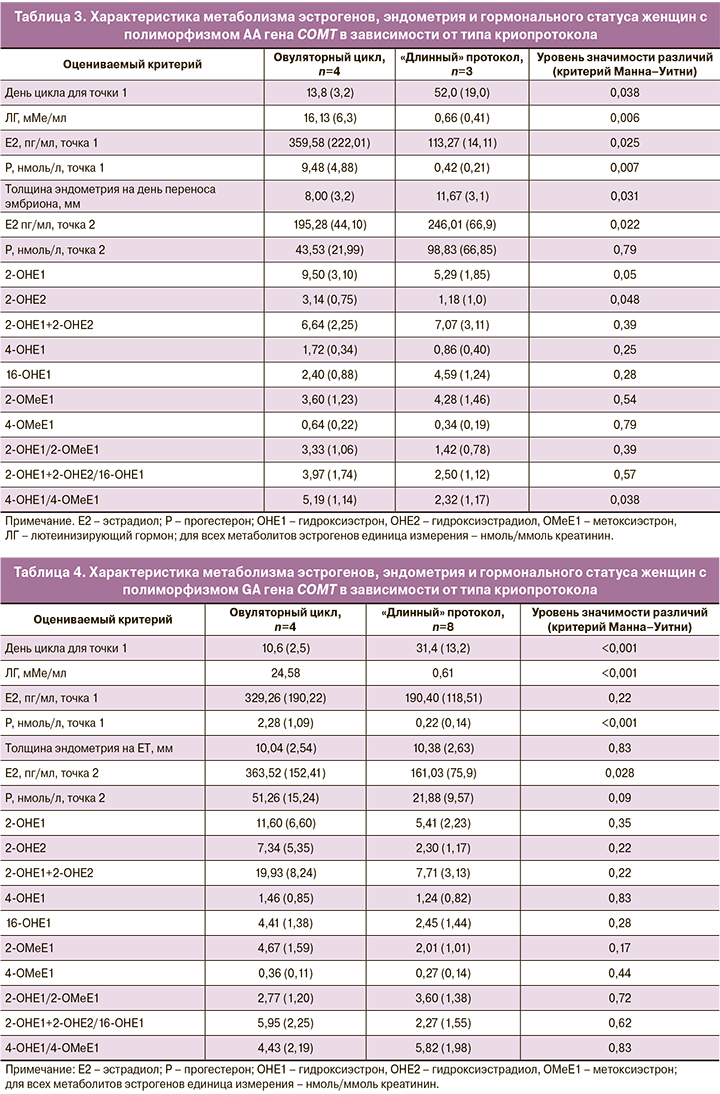
Более того, у женщин в «длинном» протоколе значимо ниже оказалось соотношение уровня гидроксилированных форм эстрона к его метоксилированным формам (4-OHE1/4-OMeE), что свидетельствует в пользу снижения риска накопления проонкогенных метаболитов эстрогенов. Это показывает, что применение 0,1% геля с эстрадиолом не приводит к увеличению токсичных метаболитов эстрогенов. Помимо этого, в «длинном» протоколе была отмечена значимо большая толщина эндометрия на день переноса эмбриона. В нем же удалось поднять уровень эстрадиола ко второй контрольной точке.
У женщин с полиморфизмом GA гена COMT использование «длинного» протокола с применением 0,1% геля с эстрадиолом аналогичным образом не привело к повышению уровня гидроксиформ метаболитов эстрогенов моче (табл. 4). В этой группе оказались сопоставимыми показатели развития эндометрия, а уровень эстрадиола был выше в группе женщин, проходивших лечение в ОЦ.
Для женщин с выявленным полиморфизмом GG гена COMT также было отмечено, что применение криопротокола с использованием эстрадиола не приводит к увеличению проонкогенных гидроксилированных метаболитов эстрона и эстрадиола (табл. 5), хотя соотношение гидроксилированных форм к метоксилированным у женщин в «длинном» протоколе было ниже такового у пациенток в ОЦ.
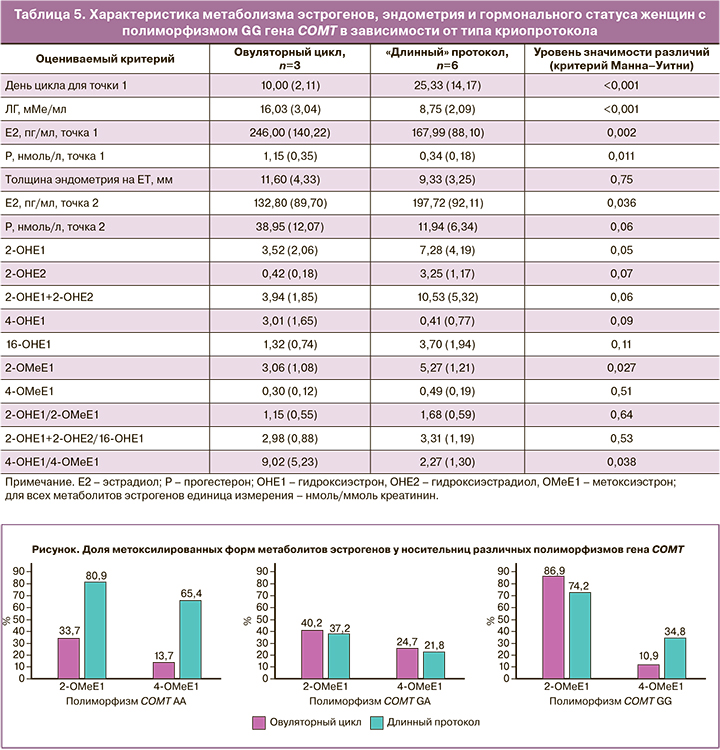
Поскольку метоксиформы метаболитов эстрогенов в моче имеют прогностическое значение для снижения риска развития онкозаболевания, произвели оценку доли метоксилированных форм эстрона в моче женщин в зависимости от типа криопротокола (рисунок).
Оказалось, что использование 0,1% геля с эстрадиолом в «длинном» криопротоколе не приводит к снижению метоксиформ эстрона даже у женщин-носительниц полиморфизмов АА и GA с низкой активностью фермента CОMT. Таким образом, можно заключить, что 0,1% гель с эстрадиолом в «длинном» протоколе не увеличивает эстрогеновую нагрузку на организм, а у носительниц с полиморфизмом АА позволяет добиться большей толщины эндометрия на день переноса. При сниженной активности СОМТ, выбирая протокол с использованием 0,1% трансдермального геля 17b-эстрадиола по 2 г с агонистами ГнРГ, возможно снизить уровень накопления «вредных» метаболитов, что является профилактикой возможных онкологических рисков на фоне дисбаланса эстрогенового обмена.
Обсуждение
Показано, что с каждым годом становится все больше женщин, откладывающих материнство с расчетом на ВРТ, но при этом вступающих в протоколы с ожидаемым снижением потенциала эффективного лечения методом ЭКО [13, 14]. Более того, с возрастом увеличивается риск развития ряда заболеваний, в том числе и онкологической природы. В этой связи особое значение приобретает аспект безопасности использования ВРТ в свете возможных побочных эффектов применяемых лекарственных препаратов. Не последнюю роль играет возрастающее внимание к персонализированной медицине, позволяющей подобрать оптимальную стратегию лечения. С доступностью генетических исследований становится возможным учитывать особенности ключевых молекул, участвующих в решении задач метаболизма, в том числе и лекарственных средств [15]. В отношении метаболизма эстрогенов такой молекулой является фермент катехол-О-метилтрансфераза (COMT) и детерминирующий его ген, ответственный за полную инактивацию эстрогенов [8]. Внимание к уровню эстрогенов не случайно – гидроксилированные формы их метаболитов ассоциированы с раком молочной железы [16].
В настоящем исследовании оценивалось, изменяется ли метаболизм эстрогенов у женщин с различными полиморфизмами гена COMT на фоне применения 0,1% геля с эстрадиолом (Дивигель, «Орион Фарма») в «длинном» протоколе с ЗГТ. Полученное нами соотношение полиморфизмов (25% АА:43% GA:32% GG) согласуется с данными отечественных исследователей, наблюдавших соотношение полиморфизма rs4680 в популяции Новосибирска в пропорции, близкой к 1:2:1 (27% АА:49% GA:24% GG) [17]. Значение полиморфизмов rs4680 гена COMT показано для прогнозирования невынашивания: носительство аллелей АА и GA сопряжено с риском неблагоприятного течения беременности [18]. Дискутабельным является вопрос о возможности прогнозирования онкопатологии с учетом полиморфных вариантов гена COMT. Есть данные, что мутантные варианты rs4680 коррелируют с повышенной частотой выявления эндометриоза (OR=1,450; 95% CI 1,012–2,076) [19], но также есть данные, что полиморфизмы этого гена не связаны с частотой рака молочной железы [20]. Нами показано, что носители различных аллелей гена, детерминирующего фермент метаболизма эстрогенов, могут неодинаково накапливать гидроксилированные и метоксилированные формы эстрона и эстрадиола. Однако у женщин с низким уровнем активности фермента COMT применение 0,1% трансдермального геля в программе ВРТ не спровоцировало накопление проонкогенных продуктов обмена эстрогенов. Таким образом, принимая во внимание рост числа сегментированных циклов и криопротоколов, а также женщин, вступающих в программы ВРТ в возрасте от 35 лет и старше, имеющих гинекологические заболевания и нуждающихся в контроле рисков, в том числе и злокачественных новообразований, можно заключить, что применение трансдермального эстрогена безопасно для группы пациенток, которым показан «длинный» протокол с ЗГТ. Этот результат согласуется с мнением специалистов, предпочитающих использование именно таких форм эстрогенов [21, 22]. Более того, показатели эндометрия на день переноса эмбриона сравнимы с таковыми у женщин в протоколе с ОЦ, и следует отметить, что достигаются приемлемые для переноса показатели за меньшее число дней и с меньшим стартовым уровнем эстрадиола в крови.
Выводы
1. Уровень образования метоксилированных форм эстрогенов сопряжен с полиморфизмом гена COMT: с вариантами АА и GA ассоциирован более низкий уровень метоксиформ.
2. Применение «длинного» прокола с ЗГТ не сопровождается увеличением уровня метаболитов в моче.
3. Криопротокол с агонистами ГнРГ в сочетании с применением 0,1% трансдермального геля с эстрадиолом не приводит к накоплению «вредных» метаболитов эстрогенов и может быть использован в целях повышения онкобезопасности в программах ВРТ.
4. Пациенткам с полиморфизмом СОМТ АА «длинный» протокол на агонистах ГнРГ с ЗГТ дает возможность получить оптимальную для переноса криоконсервированного эмбриона толщину эндометрия на фоне применения 2 г препарата Дивигель за меньшее количество дней при более низком пиковом значении уровня эстрадиола в крови и с более безопасным профилем метаболитов в моче, чем при овуляторном цикле.
5. У пациенток с полиморфизмом СОМТ AG и GG в «длинном» протоколе не получено преимуществ в профиле метаболитов мочи, но оптимальная для переноса эмбриона толщина эндометрия также достигается при меньшем уровне эстрадиола в крови, чем в овуляторном цикле.



