Внедрение в 1992 г. интрацитоплазматической инъекции сперматозоидов (ИКСИ) резко изменило лечение мужского бесплодия, что позволило пациентам с тяжелым мужским фактором (ТМФ) иметь биологическое потомство [1]. Однако, согласно всемирному отчету Международного комитета по мониторингу вспомогательных репродуктивных технологий (ВРТ), несмотря на развитие лабораторных технологий, частота наступления беременности после ИКСИ составляет около 25–30%, а частота родов – около 20% [2]. В большинстве случаев стратегия выбора эмбриона для переноса основывается на морфологических характеристиках эмбриона, в то время как эмбрион отличного или хорошего качества может оказаться генетически аномальным. На сегодняшний день хорошо известно, что анеуплоидии являются наиболее частыми генетическими аномалиями, которые приводят к неудачам имплантации и потерям беременности на ранних сроках более, чем в 50% случаев.
На бесплодие, связанное с мужским фактором, по разным данным, приходится от 20 до 50% всех случаев [3]. Из них чуть более 20% имеют диагноз тяжелого мужского бесплодия [4]. Стоит также отметить, что отсроченное родительство во всем мире становится все более распространенным явлением как для женщин, так и для мужчин [5], в связи с чем растет интерес к изучению влияния отцовского возраста на мужскую фертильность, репродуктивный потенциал и здоровье потомства. Известно, что старший репродуктивный возраст мужчин отрицательно влияет на функции яичек, гормональный баланс мужской репродуктивной системы, параметры спермы, а также целостность генома и эпигенома сперматозоидов. Однако систематический обзор 12 статей, показал, что возраст отца не был связан с результатами ВРТ [6], но данные в отношении эмбриологического этапа менее достоверны и однозначны.
Поскольку мужской фактор является одним из наиболее часто встречающихся показаний к проведению ВРТ, связь между ТМФ и частотой анеуплоидией эмбриона также находится в фокусе внимания, а вопрос о том, следует ли рассматривать ТМФ в качестве показания для проведения пренатального генетического тестирования на анеуплоидии (ПГТ-А), все еще остается спорным [7]. Ранние исследования по анализу частоты анеуплоидий показали, что ТМФ может способствовать более высокой распространенности анеуплоидных эмбрионов при ВРТ. Однако этот вывод в основном основан на исследованиях с использованием флуоресцентного анализа гибридизации in situ (FISH) для ограниченного числа хромосом на эмбрионах на стадии дробления [8].
Цель исследования заключалась в оценке влияния разных форм мужского бесплодия на репродуктивные результаты с особым вниманием к раннему эмбриональному развитию (частота оплодотворения и частота образования бластоцист высшего качества), частоте получения анеуплоидных эмбрионов и исходам программ ВРТ.
Материалы и методы
На базе отделения вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России был выполнен ретроспективный анализ 2915 циклов ВРТ (2225 циклов стимуляции, из которых 371 цикл с ПГТ-А и 690 криоциклов) с января 2018 г. по июнь 2021 г. Все пары подписали добровольное информированное согласие. Исследование было одобрено Этическим Комитетом ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
Критерием исключения являлся возраст женщин >35 лет, пары с измененным кариотипом. Мы не исключали пары, использующие замороженную сперму, донорскую сперму, а также пары с донорскими ооцитами. Возраст доноров половых гамет не превышал 35 лет.
Образцы эякулята, полученные после 3–5 дней полового воздержания путем мастурбации в день трансвагинальной пункции, оценивали на основе критериев 5-го издания Всемирной Организации Здравоохранения [9]. Для характеристики спермы использовались следующие параметры: концентрация (млн/мл), процент прогрессивно подвижных сперматозоидов и процент морфологически нормальных сперматозоидов. Группы для исследования были сформированы на основании параметров эякулята. В группу сравнения/контроля вошли пары с донорской спермой, а также с нормозооспермией (концентрация ≥15 млн/мл, прогрессивно подвижные сперматозоиды ≥32%, морфология ≥4%). Группу с олигоастенотератозооспермией (ОАТ) составили пациенты с концентрацией <15 млн/мл, прогрессивно подвижными сперматозоидами <32% и морфологией <4%, в том числе пациенты с азооспермией (концентрация <1 млн/мл в нативном образце). Пациенты с абструктивной и неабструктивной азооспермией, у которых сперматозоиды были получены путем аспирации или биопсии тканей яичка, составили группу microTESE. Дополнительно нами были выделены 2 группы с тератозооспермией в зависимости от процента морфологически аномальных сперматозоидов: мужчины с морфологией сперматозоидов в диапазоне от 0 до 2% составили группу «0–2%Т», а с морфологией 3% – группу «3%Т». Группу с ТМФ бесплодия составили пациенты с ОАТ и пациенты с microTESE. Данные группы пациентов объединили вместе ввиду малого количества наблюдений.
У всех пациентов начало овариальной стимуляции приходилось на 2–5-й день менструации по протоколу с использованием антагοнистов гонадοтропин-рилизинг-гормοна и рекомбинантного фолликулостимулирующего гормона или препаратов человеческого менопаузального гонадотропина. В качестве триггера финального созревания ооцитов использовался человеческий хорионический гонадотропин в дозе 6 000–10 000 ЕД внутримышечно по достижении диаметра фолликулов ≥ 17 мм. Через 36 часов после введения триггеρа производился забор ооцитов с помощью трансвагинальной пункции фοлликулов с последующей оценкой качества полученного материала. Сразу же после аспирации фолликулярной жидкости производили идентификацию ооцит кумулюсных комплексов (ОКК) и оценку степени зрелости ооцитов под стереомикроскопом на нагретой поверхности стерильного ламинарного бокса. Оплодотворение ооцитов проводилось методом ИКСИ, после чего оплодотворенные клетки были перенесены в культуральную среду CSCM (Irvine Sc., США) с целью дальнейшего культивирования. Оценку наступления стадии двух пронуклеусов (формирования зиготы) проводили через 14–16 ч после оплодотворения. Все этапы культивирования выполняли в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., США). Среду CSCM не меняли в течение 5 суток культивирования. На 4-е или 5-е сутки в цикле стимуляции выполняли перенос 1 эмбриона хорошего/отличного качества.
На 5-е или 6-е сутки после оплодотворения в ряде циклов была проведена процедура биопсии клеток трофэктодермы с последующей криоконсервацией биопсированных эмбрионов. Бластоцисты, подходящие для генетического анализа, были оценены по классификации, принятой Стамбульским консенсусом по оценке качества эмбрионов, и соответствовали степени 3BB и выше [10]. Полученные клетки трофэктодермы были перенесены в пробирки типа Эппендорф, содержащие лизирующий буфер, для проведения ПГТ-А с помощью методики высокопроизводительного секвенирования (NGS). Процедура ПГТ-А состояла из нескольких этапов: на первом этапе была проведена полногеномная амплификация и подготовка библиотеки для нанесения на чип. Для создания библиотеки к фрагментам ДНК присоединялись специальные молекулярные метки-баркоды, уникальные для каждого образца в постановке. Далее было выполнено ионное полупроводниковое секвенирование с последующим биоинформатическим анализом результатов и подготовкой заключения на основании полученных данных согласно стандартной методике ПГТ-А.
При переносе криоконсервированных эмбрионов пациенткам назначалась циклическая гормональная терапия (с 4–5-го дня менструального цикла – эстрадиола валерат в дозе 6 мг/сутки, с 15–16-го дня менструального цикла – микронизированный прогестерон 400–600 мг/сутки вагинально) и осуществлялся ультразвуковой контроль динамики роста эндометрия на 9–10-й день менструального цикла и на 15–16-й день цикла для назначения гестагенов. Перенос эмбрионов в полость матки осуществлялся на 20–21-й день менструального цикла с помощью мягкого катетера Wallace (Германия) или Cook (Австралия). Предварительное размораживание эмбрионов и ведение посттрансферного периода осуществлялось согласно принятым в клинической практике протоколам.
В качестве основных эмбриологических показателей циклов стимуляции оценивали количество ОКК, зрелых ооцитов, частоту оплодотворения и частоту бластуляции. Под частотой бластуляции понимали отношение числа бластоцист хорошего и отличного качества (количество замороженных бластоцист + число перенесенных эмбрионов) к числу зигот c двумя пронуклеусами. В качестве основных клинических показателей исходов программ ВРТ оценивали частоту наступления клинической беременности (ЧНБ), частоту потерь на сроках до 12 недель гестации, а также частоту родов. На 14-й день после переноса эмбриона пациентки сдавали кровь на содержание бета-субъединицы хорионического гонадотропина человека (β-ΧГЧ) для диагностики беременности. Положительный результат соответствовал уровню β-ХГЧ более 35 ΜЕ/л. При положительном результате β-ХГЧ для диагностики клинической беременности на 21-й день после переноса эмбриона выполняли трансвагинальное ультразвуковое исследование с целью визуализации гестационного мешка/плодного яйца. Случаи внематочной беременности, анэмбрионии, а также прерывание беременности на сроках до 12 недели гестации вошли в группу с ранними потерями. Частота родов рассчитывалась на число переносов.
Статистический анализ
Анализ результатов проводился с помощью пакета программ IBM SPSS Statistics версии 23.0 (США), а также с помощью таблиц Microsoft Excel. Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова). Для описания категориальных бинарных данных использовали абсолютные числа N и процентные доли от общего числа пациенток в группе P в формате N (P%). Непрерывные переменные были представлены в виде медианы (Ме) и межквартильных значений (Q1; Q3) на основе распределения выборки. Статистический анализ проводили с использованием критерия Краскела–Уоллиса для нескольких независимых выборок, теста Манна–Уитни для парного сравнения. Статистическую значимость различий двух или нескольких относительных показателей (частот, долей) оценивали с помощью критерия χ2. При множественных сравнениях использовали поправку Бонферрони. Для оценки связи между определенным исходом и фактором риска рассчитывали отношение шансов (ОШ) с доверительным интервалом (ДИ) 95%, если ДИ не включал 1, делали вывод о статистической значимости выявленной связи между фактором и исходом при уровне значимости p<0,05. Величину порогового уровня значимости p принимали равной 0,05.
Результаты
Для оценки влияния параметров эякулята на эмбриологический этап было проанализировано 2225 циклов ВРТ, из них 161 цикл был с использованием донорских ооцитов, а 87 циклов – с донорской спермой. Для всех анализируемым параметров (возраст, число ОКК, число зрелых ооцитов, частота оплодотворения и частота бластуляции) проверка критерием Колмогорова–Смирнова на нормальное распределение показала отсутствие такового (р<0,001). Для сравнения групп использовали непараметрические критерии. Средний возраст мужчин (n=2138) составил Ме 34 (31; 38) лет, исключая программы с донорской спермой. Средний возраст женщин (n=2064) составил Ме 31 (29; 34) лет, исключая программы с донорскими ооцитами.
Чтобы оценить влияние старшего репродуктивного возраста мужчин (>40 лет) на эмбриологический этап были сформированы две группы: 1918 программ с возрастом мужчин ≤40 лет и 307 программ с возрастом мужчин >40 лет. В результате сравнения характеристик эмбриологического этапа не были выявлены значимые различия в группах мужчин разного возраста: частота оплодотворения (100,0 (80,0; 100,0) в группе мужчин ≤40 лет против 92,3 (75,0; 100,0) в группе мужчин >40 лет) и частота бластуляции (50,0 (33,3; 75,0) в группе мужчин ≤40 лет против 50,0 (33,3; 75,0) в группе мужчин >40 лет) были сравнимы в анализируемых группах и не имели статистически значимых различий (табл. 1).
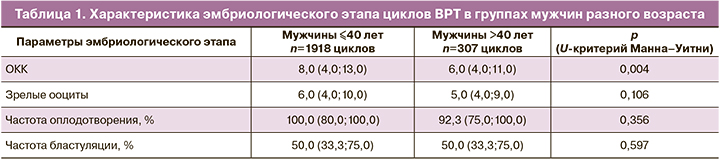
На основании показателей спермограммы было сформировано 5 групп: группу сравнения составили 257 пар с нормозооспермией (в т.ч. пары с донорской спермой), 214 пар с ОАТ, 105 пар с биопсией яичка (microTESE), 1061 пара с морфологией сперматозоидов 0–2% и 588 пар с морфологией сперматозоидов 3%. Стоит отметить, что в группу сравнения вошли пары с трубно-перитонеальным фактором, пары с мужским фактором или одинокие женщины без партнера, которые воспользовались донорской спермой (87 пар), а также пары с бесплодием с нормальными показателями спермограммы. Средний возраст мужчин значимо не отличался в анализируемых группах (р=0,057). Анализ числа ОКК и зрелых ооцитов между группами не выявил значимых различий в стимуляции пациенток (табл. 2). При сравнении показателей эмбриологического этапа в группах с разной мужской патологией при помощи критерия Краскела–Уоллиса было показано наличие значимых различий между группами в отношении частоты оплодотворения и частоты бластуляции. Для уточнения между какими именно группами имеются различия был выполнен апостериорный анализ и попарное сравнение анализируемых групп с контрольной группой с помощью критерия Манна–Уитни с поправкой Бонферрони. В результате чего был определен новый критический уровень значимости р=0,0125, который использовали при интерпретации результатов сравнения групп. Были выявлены статистически значимые различия по частоте бластуляции между группой ОАТ и группой сравнения (р=0,007), а также группой с морфологией 0–2% и группой сравнения (р=0,005). Таким образом, в группах мужчин с ОАТ и в группе с показателями морфологии сперматозоидов 0–2% выявлено статистически значимое снижение частоты бластуляции по сравнению с группой контроля. При попарном сравнении показателей частоты оплодотворения групп с разными показателями спермограммы с группой контроля не была преодолена величина нового критического уровня значимости р=0,0125. Однако стоит отметить, что частота оплодотворения в группах ОАТ и microTESE в среднем была ниже, чем в группах с морфологией сперматозоидов 0–2% и 3%. Возможно, ввиду недостаточного количества наблюдай в группах эти различия не достигли уровня статистической значимости, но тенденция была отмечена, что проявилось при сравнении всех анализируемых групп с помощью критерия Краскала–Уоллиса (р=0,03) (табл.2).
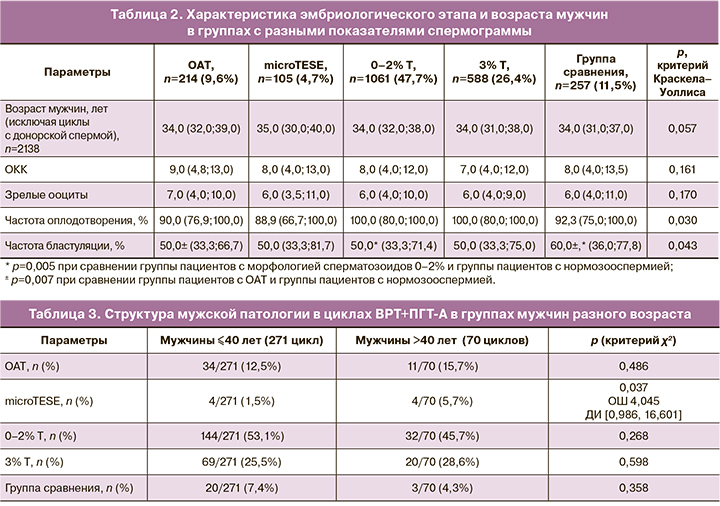
Для оценки влияния возраста мужчин на частоту анеуплоидий была проанализирована 341 программа ВРТ с ПГТ-А (1022 эмбриона). Когорта пациентов была разделена на 2 группы: мужчины ≤40 лет и >40 лет. В группе мужчин ≤40 (n=271) средний возраст мужчин составил Ме 34 (32; 36) лет, средний возраст женщин – Ме 32 (29,75; 34) лет. В когорте мужчин >40 (n=70) средний возраст мужчин составил Ме 44 (42; 48) лет, средний возраст женщин – Ме 33 (31; 34) лет. Структура мужской патологии на основании показателей спермограммы не отличалась в группах мужчин ≤40 и >40 лет: группа ОАТ – 34/271 (12,5%) против 11/70 (15,7%); группа с морфологией 0–2% – 144/271 (53,1%) против 32/70 (45,7%); группа с морфологией 3% – 69/271 (25,5%) против 20/70 (28,6%); группа сравнения – 20/271 (7,4%) против 3/70 (4,3%) соответственно (табл. 3). Однако пациенты с биопсией яичка (microTESE) чаще встречались в группе мужчин >40 лет по сравнению с группой мужчин ≤40 лет: 4/70 (5,7%) против 4/271 (1,5%) соответственно (р=0,037).
Сравнение характеристик эмбриологического этапа не выявило значимых различий в группах мужчин разного возраста: частота оплодотворения (88,9 (77,8; 100,0) в группе мужчин ≤40 лет против 87,5 (75,0; 100,0) в группе мужчин >40 лет) и частота бластуляции (50,0 (33,3; 66,7) в группе мужчин ≤40 лет против 42,9 (26,7; 66,7) в группе мужчин >40 лет) были сравнимы в анализируемых группах и не имели статистически значимых различий (табл. 4).
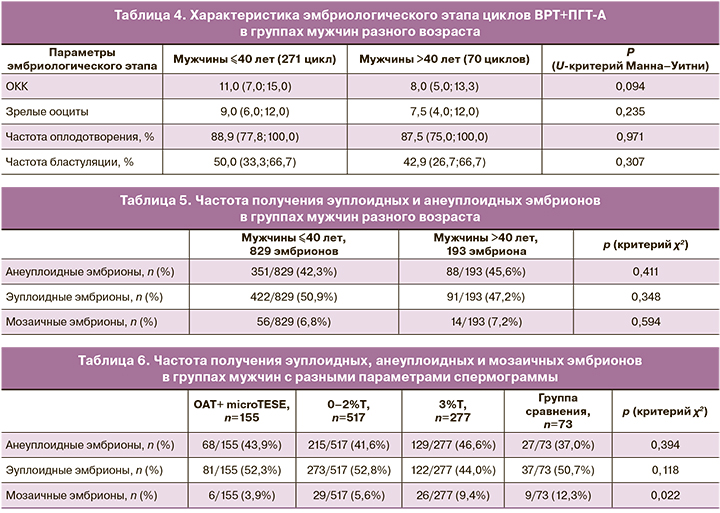
Анализ частоты эуплоидных, анеуплоидных и мозаичных эмбрионов в группах мужчин ≤40 лет и >40 лет показал отсутствие влияния возрастного фактора на генетический статус эмбриона: частота получения эуплоидных эмбрионов в группе мужчин ≤40 лет составила 422/829 (50,9%), а в группе мужчин >40 лет – 91/193 (47,2%) (табл. 5). Частота получения мозаичных эмбрионов также значимо не отличалась между группами мужчин ≤40 лет и >40 лет: 56/829 (6,8%) против 14/193 (7,2%) соответственно.
Принимая во внимание отсутствие влияния возраста мужчины на частоту анеуплоидий в когорте получаемых эмбрионов, мы решили оценить влияние ТМФ (группа с ОАТ и microTESE) и других характеристик эякулята (морфология сперматозоидов 0–2% и 3%) на частоту анеуплоидий в циклах ВРТ+ПГТ-А, для чего были проанализированы результаты генетического анализа эмбрионов в группах пациентов с разными параметрами спермограммы. В результате анализа было показано, что частота получения анеуплоидных и эуплоидных эмбрионов не зависит от структуры мужской патологии (табл. 6). Стоит отметить, что частота получения мозаичных эмбрионов значимо отличалась в сравниваемых группах от 6/155 (3,9%) в группе с ТМФ до 9/73 (12,3%) в группе сравнения с нормальными параметрами спермограммы (р=0,022). При введении поправки на множественные сравнения был определен новый критический уровень значимости р=0,0125, однако в результате попарного сравнения анализируемых групп с группой контроля не была преодолена данная величина: р=0,017, 0,029 и 0,456 при сравнении ОАТ, 0-2%Т и 3%Т против группы контроля соответственно.
Для оценки влияния параметров эякулята на исходы программ ВРТ в исследование вошли все пары, которым был осуществлен перенос 1 эмбриона в полость матки на 4-е или 5-е сутки в цикле стимуляции, или перенос 1 эмбриона 5-х или 6-х суток культивирования как после проведения ПГТ-А, так и без ПГТ-А в криопротоколе, за исключением пар с донорскими ооцитами.
В качестве ключевых параметров исходов программ ВРТ на основании характеристик спермограммы рассматривали частоту наступления клинической беременности (ЧНБ) на число переносов, частоту ранних потерь беременности до 12 недель гестации на ЧНБ и частоту родов на число переносов. Стоит отметить, что информация для контрольных точек доступна не для всех пациенток, т.к. у ряда из них в настоящее время беременность продолжается.
Сравнение исходов программ ВРТ в контрольных временных точках между группами мужчин с разными показателями спермограммы показало, что структура мужской патологии не влияла на исходы лечения бесплодия ни в цикле стимуляции при переносе свежего эмбриона, ни в криопротоколе при переносе замороженного/размороженного эмбриона как в программах с ПГТ-А, так и в программах без генетического тестирования (табл. 7–9).

Сравнение исходов программ ВРТ в циклах стимуляции при переносе свежего эмбриона с исходами в криопротоколах без ПГТ-А показало снижение ЧНБ и частоты родов в криоциклах для всех групп пациентов с разными показателями спермограммы. Однако статистически значимое снижение ЧНБ и частоты родов было выявлено для групп пациентов с морфологией сперматозоидов 0–2%Т и 3%Т. ЧНБ при переносе свежего эмбриона в группе с морфологией 0–2% составила 216/554 (39%) против 61/211 (28,9%) в криопротоколе (р=0,01, χ2),
ОШ 0,636; ДИ [0,452; 0,897], частота родов – 153/527 (29,0%) против 35/202 (17,3%) соответственно (р=0,002, χ2); ОШ 0,512; ДИ [0,340; 0,772]. В группе с морфологией 3% ЧНБ при переносе свежего эмбриона составила 115/299 (38,5%) против 34/132 (25,8%) в криопротоколе (р=0,01, χ2),
ОШ 0,555; ДИ [032; 0,874]; частота родов – 72/285 (25,3%) против 16/122 (13,1%) соответственно (р=0,007, χ2); ОШ 0,447; ДИ [0,248; 0,805].
При сравнении исходов программ ВРТ в криопротоколах с ПГТ-А и без проведения генетического тестирования на анеуплоидии было отмечено увеличение ЧНБ при переносе эуплоидного эмбриона, снижение числа ранних потерь, а также увеличение частоты родов, что обусловлено переносом генетически нормального эмбриона по результатам скрининга. Однако статистически значимые отличия были также описаны для групп пациентов с морфологией сперматозоидов 0–2% и 3%. ЧНБ при переносе эуплоидного эмбриона в группе с морфологией 0–2% составила 49/116 (42,2%) против 61/211 (28,9%) в криопротоколе без ПГТ-А (р=0,015, χ2); ОШ 1,798; ДИ [1,120; 2,888]; частота родов – 33/107 (30,8%) против 35/202 (17,3%) соответственно (р=0,007, χ2),
ОШ 2,128; ДИ [1,229; 3,683]. В группе с морфологией 3% ЧНБ в криоцикле при переносе эуплоидного эмбриона составила 23/55 (41,8%) против 34/132 (25,8%) в криопротоколе без ПГТ-А (р=0,03, χ2); ОШ 2,072; ДИ [1,068; 4,019]; частота родов – 19/53 (35,8%) против 16/122 (13,1%) соответственно (р<0,001, χ2); ОШ 3,702; ДИ [1,716; 7,989]. Таким образом, ЧНБ и частота родов в группах с морфологией 0–2 и 3% почти в 2 раза ниже в криопротоколах по сравнению с переносом свежего эмбриона в цикле стимуляции и по сравнению с переносом эуплоидного эмбриона в криоцикле, при отсутствии разницы в частоте получения эуплоидных эмбрионов в группах с измененными параметрами спермограммы и в группах мужчин старше и младше 40 лет.
Обсуждение
На сегодняшний день данные о влиянии мужского фактора (возраст, ТМФ) на результаты программ ВРТ, такие как жизнеспособность эмбриона/раннее эмбриональное развитие, частота анеуплоидии, а также частота наступления беременности и частота родов являются достаточно неоднозначными и дискутабельными. Настоящее исследование было посвящено изучению влияния старшего репродуктивного возраста отцов (>40 лет) и наличия ТМФ на частоту эмбриональных анеуплоидий в программах ЭКО/ИКСИ, а также изучению влияния данных факторов на эмбриологический этап лечения бесплодия. Принимая во внимание, что большинство анеуплоидий эмбриона являются результатом наследования материнских аберраций, распространенность которых увеличивается с 30% у женщин в возрасте от 30 лет до почти 90% у женщин в возрасте 44 лет [11], мы исключили все циклы ВРТ, в которых возраст женщин превышал 35 лет, чтобы нивелировать влияние материнского фактора на частоту анеуплоидий и исходы программ ВРТ.
Считается, что возраст мужчины отрицательно влияет на результаты ВРТ, возможно вследствие повреждения ДНК в сперматозоидах в результате оксидативного стресса [11]. В результате проведенного анализа не было выявлено значимых различий в характеристиках эмбриологического этапа в группах мужчин старше и младше 40 лет: частота оплодотворения и частота бластуляции были сопоставимы в обеих группах, что согласуется с данными Kasman A.M. et al. [13], которые показали, что возраст отца (≥40 лет) не связан ни с эмбриологическим этапом, ни исходами программ ВРТ. Хотя в исследовании Dviri M. et al. [14] было отмечено статистически значимое снижение частоты оплодотворения с 80% до 76% в группе мужчин ≥50 по сравнению с более молодыми мужчинами, что конечно не является столь клинически значимым фактом, в то время как Hanson B.M. et al. в своей работе при анализе 4058 циклов показали снижение процента бластуляции в группе мужчин ≥40 лет [15], а Morris G. et al. в исследовании 2021г показали, что независимо от причины бесплодия, увеличение мужского возраста (≥50 лет) связано с уменьшением количества живорождений и ЧНБ, но не влияет на частоту ранних потерь [16]. Требуются дальнейшие исследования по изучению возможных механизмов этого эффекта, а также необходимо совершенствовать существующие методы отбора сперматозоидов, которые могут смягчить данные эффекты.
При сравнении показателей эмбриологического этапа в группах мужчин с разными параметрами эякулята нами было отмечено снижение процента получения бластоцист высокого качества в анализируемых группах по сравнению с группой с нормозооспермией. Статистически значимая разница была определена для группы мужчин с ОАТ и группы с морфологией сперматозоидов 0–2%, что может свидетельствовать о влиянии мужского фактора на раннее эмбриональное развитие. В работе Mazzilli R. et al. в результате анализа 1219 циклов было отмечено снижение частоты оплодотворения для групп с ТМФ по сравнению с группой с нормозооспермией, в то время как частота получения бластоцист топового уровня была значимо ниже только в группе с неабструктивной азооспермией [17]. Анализ 1266 циклов ИКСИ показал, что снижение концентрации (<5 млн/мл) связано со снижением частоты оплодотворения, но не влияет на частоту получения бластоцист отличного качества и на частоту продолжающейся беременности [18].
Сперматозоиды играют важную роль на этапах эмбриогенеза, таких как оплодотворение, эпигенетический контроль и деление клеток, что может повлиять на результаты ИКСИ. Существует мнение, что негативное влияние тяжелой ОАТ на скорость бластуляции может быть связано с повышенной фрагментацией ДНК сперматозоидов [19]. В недавнем исследовании, в котором за эмбрионами наблюдали с помощью метода покадровой съемки, продемонстрировали, что ТМФ связан с более низким процентом бластоцист, доступных для переноса, по сравнению с другими причинами бесплодия. Однако ранние и поздние морфокинетические параметры эмбрионов оставались схожими независимо от степени тяжести мужского бесплодия [20], но этот факт не дает полной уверенности в высоком репродуктивном потенциале переносимых бластоцист. Таким образом, присутствие ТМФ, по-видимому, в первую очередь влияет на способность оплодотворенных ооцитов достигать стадии бластоцисты, что приводит к уменьшению количества бластоцист топового качества. Однако это не полностью доказывает, сохраняется ли репродуктивный потенциал переносимых бластоцист.
Как показали ранние исследования с использованием FISH, количество анеуплоидных эмбрионов на стадии дробления может зависеть от тяжести мужского бесплодия. Однако вероятность того, что анеуплоидные на стадии дробления эмбрионы достигнут стадии бластоцисты, может отрицательно коррелировать с ТМФ. Таким образом, частота эуплоидных эмбрионов на стадии бластоцисты может быть одинаковой для группа мужчин со сниженными показателями спермограммы, как показали недавние исследования [17, 21]. Это можно объяснить преимуществом выживания эуплоидных на стадии дробления эмбрионов до стадии бластоцист. Другое возможное объяснение заключается в том, что время биопсии эмбриона влияет на частоту анеуплоидии, поскольку статус плоидности эмбрионов более точно определяется на стадии бластоцисты, чем на стадии дробления [22].
Установлен факт, что повышение частоты эмбриональных анеуплоидий связано с возрастом матери [11]. В отношении возраста отца и показателей эякулята и их связи с частотой анеуплоидий однозначных объективных данных нет. Известно, что по мере увеличения возраста у мужчин в сперматозоидах накапливаются точечные мутации, отвечающие за наследование определенных заболеваний (шизофрения, аутизм): удвоение отцовских наследуемых мутаций происходит каждые 16,5 года [23], в то время как доказательства генеза именно отцовских анеуплоидий остаются противоречивыми. В результате нашего исследования было показано, что ни аномальные параметры спермограммы (ОАТ, microTESE, морфология сперматозоидов), ни возраст отца старше 40 лет не связаны с повышением частоты анеуплоидии эмбрионов, что соответствовало более ранним исследованиям [17, 21]. В исследовании Carrasquillo R.J. et al. при анализе 1202 циклов с донорскими ооцитами и ПГТ-А было показано отсутствие влияния старшего репродуктивного возраста отца на генетический статус эмбриона [24]. Аналогичные результаты были получены при анализе 3118 эмбрионов на анеуплоидии в группах мужчин разного возраста (≤39, 40–49, ≥50 лет) в программах с донорскими ооцитами: не было найдено связи между возрастом отца и уровнем анеуплоидий [14]. Однако Coates A. et al. сообщили о повышенной частоте аномалий половых хромосом у эмбрионов в группе мужчин с олигозооспермией по сравнению с мужчинами с нормальной спермой [25]. Более низкая частота эуплоидии, более высокая частота мозаицизма и более высокая частота аномального морфокинетического развития были описаны при ИКСИ с тестикулярной спермой с женщинами ≤35 лет по сравнению с нормальными сперматозоидами [26].
Анализ исходов программ ВРТ показал, что при переносе как свежего эмбриона в цикле стимуляции, так и размороженного эмбриона в криопротоколе значения контрольных временных точек измерения (ЧНБ, потери на ранних сроках, частота родов) статистически значимо не различались в группах с разными показателями спермограммы. Таким образом, можно сделать вывод, что наличие фактора мужского бесплодия, связанного с изменениями в показателях эякулята не влияет на исходы программ ВРТ. Стоит отметить, что наилучшие показатели по суммарной ЧНБ (42,0%), случаям ранних потерь (10%) и частоте родов (33,3%) отмечены в программах ВРТ с ПГТ-А, что обусловлено переносом эуплоидного эмбриона, в отличие от программ без ПГТ-А. Минимальная суммарная ЧНБ 29,3%, максимальное количество ранних потерь 22,8% и минимальная частота родов 17,6% были выявлены при переносе замороженного/размороженного эмбриона в криопротоколе без ПГТ-А.
Сравнение исходов программ ВРТ для пар с нормозооспермией при переносе как свежего, так и размороженного эмбриона в циклах с ПГТ-А и без генетического скрининга показало отсутствие значимых различий по каждой из контрольных временных точек: частота родов составила 29,3%, 22,2% и 23,1% соответственно. Таким образом, для пар с нормозооспермией и возрастом женщин ≤35 лет проведение ПГТ-А не улучшает исходы программ ВРТ. В группе пациентов с ТМФ (объединенная группа ОАТ и microTESE) было отмечено повышение ЧНБ, снижение ранних потерь и увеличение частоты родов по сравнению с переносом размороженного эмбриона без ПГТ-А: 45,7% против 31,7%; 6,3% против 16,7% и 41,2% против 22,8% соответственно. Однако данные различия не достигли уровня статистической значимости, но была отмечена тенденция в отношении частоты родов (р=0,064). Похожие выводы были сделаны Xu R. et al. [27], которые показали, что ПГТ-А на основе NGS может улучшить исходы беременности для пар с ТМФ за счет значительного снижения частоты выкидышей на ранних сроках (6,7% против 21,6%, p=0,02), но без влияния на кумулятивную частоту продолжающейся беременности (54,9% против 55,8%, р=0,90) по сравнению с ИКСИ без ПГТ-А.
Сравнение исходов программ ВРТ в группах мужчин с морфологией 0–2% и 3% показало статистически значимое снижение ЧНБ и частоты родов при переносе замороженного/размороженного эмбриона с неизвестным генетическим статусом как по сравнению с переносом свежего эмбриона в цикле стимуляции в аналогичной группе, так и по сравнению с переносом эмбриона в криопротоколе с ПГТ-А. Это согласуется с работой, в которой было показано, что наличие тератозооспермии у мужчин способствует повышенному риску неудачных исходов программ ВРТ [28]. Надо сказать, что тератозооспермия является одним из самых распространенных вариантов отклонений он нормы в спермограмме в общей популяции пациентов, а морфологическая оценка сперматозоидов сама по себе является крайне субъективной и во многом зависит от эмбриолога. Известно, что неудачи имплантации на 1/3 связаны с эмбрионом, а на 2/3 – с эндометрием [29]. Основная причина бесплодия в таких парах отводится женскому фактору бесплодия. Снижение ЧНБ и частоты родов в криопротоколе в таких парах, вероятно, связано с недостаточным обследованием женщины. В парах с ТМФ (ОАТ, microTESE), как правило, женщины не имеют отягощенного анамнеза, что подтверждается отсутствием статистически значимых различий в ЧНБ и частоте родов как при переносе эмбриона в цикле стимуляции, так и при переносе размороженного эмбриона в криопротоколе.
Заключение
Настоящее исследование продемонстрировало, что в парах с ТМФ ПГТ-А на основе NGS может повысить частоту родов с меньшим количеством перенесенных эмбрионов за счет снижения именно числа потерь на ранних сроках беременности, т.к., по нашим данным, частота получения эуплоидных и анеуплоидных эмбрионов в группах мужчин с разными параметрами спермограммы, в том числе и с ОАТ, и с microTESE, не отличалась от таковой в группе сравнения и составила около 50%. Данный подход можно рекомендовать для пар с ТМФ. Также стоит отметить, что наличие тяжелых форм мужского бесплодия и преклонный возраст отца (≥50 лет) могут отрицательно повлиять на скорость оплодотворения и бластуляции, но не на ЧНБ в циклах ИКСИ. Однако для подтверждения этих результатов по-прежнему необходимы хорошо спланированные и достаточно мощные рандомизированные контролируемые исследования.



