Одним из наиболее эффективных методов лечения бесплодия являются вспомогательные репродуктивные технологии (ВРТ) [1]. Разработка новых модифицированных схем стимуляции и усовершенствование эмбриологического этапа позволили повысить результативность программ ВРТ; тем не менее, эффективность одной попытки не превышает 40%, а частота родов живым плодом составляет около 33,3% у пациенток до 37 лет [2]. Во многих исследованиях было показано, что для успешной имплантации необходим координированный «диалог» между рецептивным и восприимчивым эндометрием и качественным эмбрионом с максимальным имплантационным потенциалом. На сегодняшний день для оценки качества эмбриона и его имплантационной способности используются морфологические критерии, предложенные Gardner et al. [3], однако данный способ оценки остается субъективным, и не все эмбрионы «хорошего» или «отличного» морфологического качества успешно имплантируются [4]. Учитывая, что на сегодняшний день становится очевидным преимущество переноса одного эмбриона в полость матки, разработаны и предложены различные технологии, дополняющие выбор наиболее перспективного эмбриона [5]. Одной из широко применяемых методик, позволяющей оптимизировать селекцию эмбриона с высоким имплантационным потенциалом, является преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А) [6]. Тем не менее, несмотря на неоспоримые преимущества ПГТ-А в отношении повышения эффективности программ ВРТ, частота наступления беременности в циклах ВРТ при переносе эуплоидной бластоцисты составляет около 45–50% [7]. Кроме этого, наступление клинической беременности в цикле переноса эуплоидного эмбриона не гарантирует рождение здорового ребенка и не исключает наличие сбалансированных хромосомных аберраций и точечных мутаций, которые, в известной мере, влияют на развитие врожденных пороков развития.
Отсутствие имплантации эмбриона в программах ВРТ может быть связано не только с качественными характеристиками эмбриона, но и также с различными «материнскими» факторами [8].
Научные исследования последних лет сделали серьезный прорыв в изучении и понимании процессов раннего эмбриогенеза и имплантации эмбриона на молекулярном уровне, а также в поиске дополнительных способов оценки качества эмбриона и его имплантационного потенциала. Один из перспективных методов селекции эмбрионов заключается в определении копийности митохондриальной ДНК (мтДНК) в трофэктодерме (ТЭ) бластоцист при проведении ПГТ-А. Результаты нескольких работ показали, что эуплоидные эмбрионы с меньшим количеством копий мтДНК с большей вероятностью приведут к наступлению беременности [9, 10].
Основная функция митохондрий заключается в регуляции таких важных клеточных процессов как производство основного источника химической энергии аденозинтрифосфата (АТФ), регуляции процессов апоптоза, передачи сигналов кальция, управление активными формами кислорода, циклом образования пирувата и лимонной кислоты, синтезом гема и стероидов, а также передачей гормональных сигналов [11]. Митохондрии наследуются от матери [12], так как при оплодотворении митохондрии сперматозоидов разрушаются, и все митохондрии зиготы обеспечивает оплодотворенный ооцит. Отдельные органеллы могут содержать более одной копии митохондриального генома, а каждая клетка – множество митохондрий. Содержание мтДНК в различных клетках значительно варьирует: сперматозоиды содержат нескольких копий, а зрелые ооциты – около 100 000 митохондрий и от 50 000 до 550 000 копий мтДНК [13].
Учитывая, что биогенез митохондрий начинается во время имплантации эмбриона, а репликация мтДНК инициируется на стадии бластоцисты, достаточный уровень мтДНК в клетках кумулюса и в ооцитах как определяет повышенный потенциал женских половых клеток к оплодотворению, так и является одним из важных факторов, способствующих доимплантационному развитию эмбриона [14, 15]. Результаты нескольких исследований показали, что снижение содержания мтДНК в ооцитах связано с нарушением оплодотворения и дальнейшего развития эмбриона [16]. Cecchino G. et al. и Hashimoto S. et al. показали, что во время начальных митотических делений содержание мтДНК остается стабильным, так как митохондрии и мтДНК ооцита равномерно распределяются по полученным бластомерам в зависимости от их объема [17, 18]. У эмбриона на стадии бластоцисты содержание мтДНК в клетках ТЭ постепенно снижается в связи с более крупным размером клеток и большим числом клеточных делений.
Две независимые группы авторов в 2015 г. впервые предложили использовать количественное определение мтДНК в качестве биомаркера качества и имплантационного потенциала эмбриона [9, 10]. Ученые показали, что эуплоидные бластоцисты, которые не привели к наступлению беременности в программе ВРТ, имели более высокое содержание мтДНК в клетках ТЭ по сравнению с эмбрионами, которые успешно имплантировались. В исследованиях было получено пороговое значение копий мтДНК, и эмбрионы, имеющие повышенный уровень мтДНК, не приводили к наступлению беременности, в отличие от эмбрионов с более низким содержанием мтДНК. После публикации результатов количественное определение мтДНК у эмбрионов привлекло пристальное внимание ученых и послужило началом дополнительных исследований, результаты которых подтвердили исходные данные [19–21]. Тем не менее другие авторы получили противоречивые результаты, ставящие под сомнение возможность применения мтДНК в качестве маркера качества и имплантационного потенциала эмбриона [22–26].
Учитывая неоднозначные данные предыдущих результатов, цель нашего исследования заключалась в изучении количественной оценки мтДНК в клетках ТЭ в качестве маркера имплантационного потенциала эмбриона и анализе исходов программ ВРТ при переносе одной эуплоидной бластоцисты после проведения ПГТ-А.
Материалы и методы
На базе отделения ВРТ в лечении бесплодия им проф. Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России был выполнен ретроспективный анализ исходов программ ВРТ 187 супружеских пар. Было проанализировано 244 эуплоидных немозаичных бластоцисты, полученных в результате проведения программы ВРТ с ПГТ-А. Все пары подписали добровольное информированное согласие. Были проанализированы исходы 218 селективных переносов эмбриона в криопротоколе; из них 21 пациентке выполнено 2 криопротокола, 2 пациенткам – 3 криопротокола, 1 пациентке – 4 криопротокола и у 166 пациенток был проведен 1 криопротокол.
У всех пациентов начало овариальной стимуляции приходилось на 2–5-й день менструации по протоколу с использованием антагοнистов гонадοтропин-рилизинг гормοна и рекомбинантного фолликулостимулирующего гормона или человеческого менопаузального гонадотропина. В качестве триггера финального созревания ооцитов использовался человеческий хорионический гонадотропин (ΧГЧ) в дозе 6000–10 000 ЕД внутримышечно по достижении диаметра фолликулов ≥17 мм. Через 36 ч после введения триггеρа производился забор ооцитов с помощью трансвагинальной пункции фοлликулов с последующей оценкой качества полученного материала. Сразу же после аспирации фолликулярной жидкости производили идентификацию ооцит-кумулюсных комплексов и оценку степени зрелости ооцитов под стереомикроскопом на нагретой поверхности стерильного ламинарного бокса. Оплодотворение ооцитов проводилось методом ИКСИ, после чего оплодотворенные клетки были перенесены в культуральную среду CSCM (Irvine Sc., США) с целью дальнейшего культивирования. Оценку наступления стадии двух пронуклеусов (формирования зиготы) проводили через 14–16 ч после оплодотворения. Все этапы культивирования выполняли в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., США). Среду CSCM (Irvine Sc., США) не меняли в течение 5 суток культивирования. На 5-е или 6-е сутки после оплодотворения была проведена процедура биопсии ТЭ с последующей криоконсервацией биопсированных эмбрионов. Полученные клетки ТЭ были перенесены в пробирки типа Эппендорф, содержащие лизирующий буфер, для проведения ПГТ-А с помощью методики высокопроизводительного секвенирования. Процедура ПГТ-А состояла из нескольких этапов: на первом этапе была проведена полногеномная амплификация и подготовка библиотеки для нанесения на чип. Для создания библиотеки к фрагментам ДНК присоединялись специальные молекулярные метки-баркоды, уникальные для каждого образца в постановке. Далее было выполнено ионное полупроводниковое секвенирование с последующим биоинформатическим анализом результатов и подготовкой заключения на основании полученных данных согласно стандартной методике ПГТ-А. Нормировка числа копий мтДНК осуществлялась на аутосомы согласно интерфейсу программного обеспечения производителя.
Через 1–2 менструальных цикла по результатам ПГТ-А производился перенос криоконсервированных/размороженных эуплоидных эмбрионов. Пациенткам назначалась циклическая гормональная терапия (с 4–5-го дня менструального цикла – эстрадиола валерат в дозе 6 мг/сут, с 15–16-го дня менструального цикла –микронизированный прогестерон 400–600 мг/сут вагинально) и осуществлялся ультразвуковой контроль динамики роста эндометрия на 9–10-й день менструального цикла и на 15–16-й день цикла для назначения гестагенов. Перенос эмбрионов в полость матки осуществлялся на 20–21-й день менструального цикла с помощью мягкого катетера Wallace (Германия) или Cook (Австралия). Предварительное размораживание эмбрионов и ведение посттрансферного периода осуществлялись согласно принятым в клинической практике протоколам.
В качестве основных клинических показателей исходов программ ВРТ оценивали частоту биохимической, внематочной и клинической беременности, выкидыша, имплантации, а также частоту живорождения. На 14-й день после переноса эмбриона пациентки сдавали кровь на содержание бета-субъединицы ХГЧ (β-ΧГЧ) для диагностики беременности. Положительный результат соответствовал уровню β-ХГЧ более 35 ΜЕ/л. При положительном результате β-ХГЧ для диагностики клинической внутриматочной беременности на 21-й день после переноса эмбриона выполняли трансвагинальное ультразвуковое исследование. Полученные результаты были представлены в виде модели, в которой частота выкидыша, внематочной беременности и клинической беременности были объединены в одну группу «положительный результат имплантации», а отсутствие наступления беременности при переносе эуплоидного эмбриона, а также биохимическая беременность соответствовали группе «отрицательный результат имплантации».
Статистический анализ
Анализ результатов проводился с помощью пакета программ IBM SPSS Statistics версии 23.0 (США), а также с помощью таблиц Microsoft Excel. Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). Статистический анализ проводили с помощью теста Манна–Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. Для описания категориальных бинарных данных использовали абсолютные числа N и процентные доли от общего числа пациенток в группе P в формате N (P%). Непрерывные переменные были представлены в виде среднего и стандартного отклонения или в виде медианы (Ме) и межквартильных значений (Q1;Q3) на основе распределения выборки. Качество бластоцисты, тип анеуплоидии или условия культивирования соответствовали категориальным переменным. Оценка различий между днями проведения биопсии, полами эмбриона, исходами программ ВРТ (частотой имплантации и частой наступления клинической беременности) по уровню мтДНК была определена с помощью U-критерия Манна–Уитни из-за асимметричного распределения ответа. Для оценки корреляции между возрастом женщины и количеством мтДНК использовали корреляцию Пирсона. Зависимость степени экспансии бластоцисты (от 2 до 6) и количества копий мтДНК оценивали с помощью критерия Краскела–Уоллиса для нескольких независимых выборок. Величину порогового уровня значимости p принимали равной 0,05. Для более наглядного восприятия информации все значения мтДНК были умножены на 10,000.
Результаты
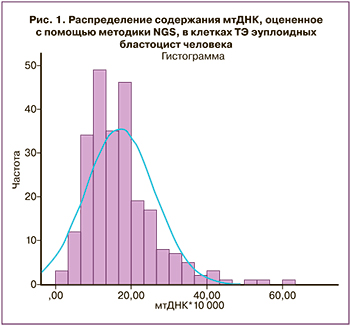
Количественная оценка мтДНК была выполнена на всех анализируемых 244 образцах. Распределение количества копий мтДНК в клетках ТЭ эуплоидных эмбрионов показало положительную асимметрию (1,508) и длительный эксцесс (3,568) (рис. 1). Согласно результату теста Колмогорова–Смирнова (р<0,001), распределение значений мтДНК значимо отличается от нормального. Медиана количества копий мтДНК и межквартильные интервалы составляли 15,40 (10,67;20,78), при этом стоит отметить большой разброс значений количества копий мтДНК: минимальное значение составило 2,06, максимальное – 60,70.
Количественная оценка мтДНК в зависимости от возраста матери
Материнский возраст выступал в качестве непрерывной переменной. Средний возраст женщин на момент трансвагинальной пункции составил 34,07 (4,08) года (диапазон: 26,0–43,0 года). Мы проанализировали корреляцию между количественным определением мтДНК и возрастом матери с помощью параметрической ранговой корреляции Пирсона. Количественный уровень мтДНК в общем количестве клеток ТЭ эуплоидных эмбрионов показал статистически незначимую и очень слабую корреляцию с возрастом матери (коэффициент корреляции Пирсона r=-0,098; p=0,102).
Количественная оценка мтДНК и эмбриональные факторы
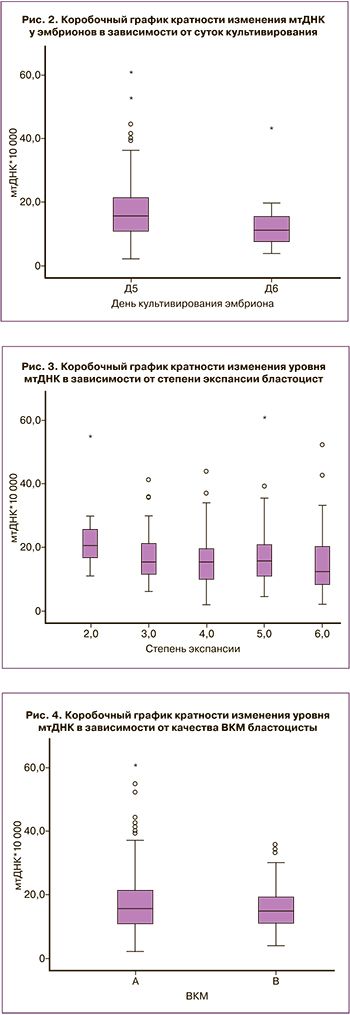
В настоящем исследовании были проанализированы ряд эмбриологических факторов, которые потенциально могут повлиять на содержание мтДНК в клетках эмбриона. При оценке эмбриологических факторов была изучена связь между количеством мтДНК и днем проведения биопсии. В данном исследовании у 215 эмбрионов (88%) биопсию проводили на 5-й день (Д5) культивирования, 29 (12%) эмбрионам биопсию выполнили на 6-й день (Д6) после оплодотворения. При проведении статистической обработки данных было показано, что эмбрионы Д5 культивирования имели более высокое количество мтДНК по сравнению с эмбрионами Д6: 15,70 (11,10; 21,80) VS 11,50 (7,53; 16,55) соответственно, p=0,001 (критерий Манна–Уитни) (рис. 2).
Для ПГТ-А проводили биопсию бластоцист хорошего и отличного качества, определяемого с помощью оценки степени экспансии бластоцисты (2–6 баллов), качества внутриклеточной массы (ВКМ) (А или В) и клеток ТЭ (А или В). Была обнаружена статистически незначимая связь степени экспансии бластоцисты и количества копий мтДНК (р=0,178). Стоит отметить, что была отмечена взаимосвязь между степенью экспансии ранних бластоцист (1–2 балла) и повышенным количественным уровнем копий мтДНК, а бластоцист, у которых экспансия соответствовала 6 баллам – с пониженным содержанием мтДНК. Уровень значимости составил 0,041 при попарном сравнении двух групп, используя критерий Манна–Уитни. Однако при введении поправки Бонферрони различия между двумя группами не были статистически значимыми (рис. 3). При этом качество ВКМ бластоцисты не было связано с количеством копий мтДНК. Количество бластоцист с качеством ВКМ, соответствующей степени A, составляло 179 (73,4%), Ме 15,60 (10,60;22,10), степени B – 65 (26,6%), Ме 14,70 (10,55;19,35), р=0,253 (рис. 4). Сравнение количества копий мтДНК в клетках ТЭ показало, что бластоцисты с ТЭ, соответствующей категории отличного качества А (100 бластоцист, 41%), имели более высокие значения мтДНК (Ме 16,85 (12,12;22,25) по сравнению с эмбрионами, имеющие ТЭ хорошего качества В (144 бластоцист, 59%, Ме 14,50 (9,72;19,60), р=0,007). Значение корреляции по Спирмену между качеством клеток ТЭ и количеством копий мтДНК составило -0,174 с уровнем значимости р=0,006 (рис. 5).

В исследовании было также оценено влияние пола эмбриона на количество мтДНК. Статистически значимых различий в отношении пола эмбриона и уровня мтДНК обнаружено не было. В исследование было включено 110 эмбрионов ХY (45,1%) и 134 эмбриона ХХ (54,9%): Ме 15,55 (10,60; 20,43) против 15,30 (10,83, 21,23) соответственно, p=0,917 (рис. 6).

Оценка количественного уровня мтДНК в зависимости от исходов программы ВРТ
В данном исследовании средний возраст пациенток в группе с положительным результатом имплантации соответствовал 34,35 (4,31), а в группе с отрицательным результатом – 33,47 (3,91), р=0,144 (рис. 7). Группу с положительным результатом имплантации составили 102 пациентки (46,8%), из них у 1 женщины была диагностирована внематочная беременность, у 9 пациенток – выкидыш на 4–8-й неделе беременности, у 92 женщин – подтвержденная клиническая беременность. В группе с отрицательным результатом имплантации было 116 пациентов (53,2%), из них биохимическая беременность наступила у 5 женщин, отрицательный результат β-ХГЧ получен у 111 пациенток.
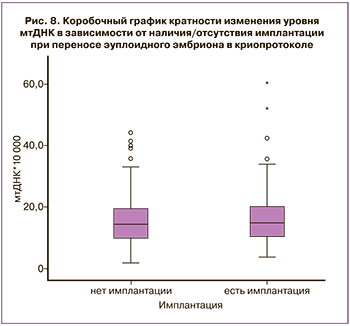
Значимой разницы в уровне мтДНК у пациенток в группе с положительным и отрицательным результатом имплантации получено не было: Ме 15,15 (10,60;20,63) против 14,47 (10,23;19,68) соответственно, p=0,56 (рис. 8). В обеих группах были зафиксированы выбросы, соответствующие высокому уровню мтДНК. Информация по исходам беременности и живорождению была собрана от 72 пациенток из 92 женщин с подтвержденной клинической беременностью.
На момент написания публикации у 16 женщин беременность развивается соответственно сроку гестации. Исходя из полученных данных, частота живорождения составила 35,6%. У 72 пациенток, родивших детей, 3 эмбриона имели уровень мтДНК выше 40 единиц, а в когорте пациенток с неудачной имплантацией был всего 1 эмбрион с количественным уровнем мтДНК, превышающий 40 копий на клетку.
Обсуждение
Несмотря на то, что в настоящий момент предложено большое количество различных маркеров имплантационного потенциала и качества эмбриона, объяснить причину отсутствия имплантации перспективного эмбриона по данным морфологической оценки не всегда представляется возможным. В данном исследовании был проведен анализ уровня мтДНК у эмбрионов отличного/хорошего качества в зависимости от результата имплантации, качественных характеристик эмбриона, возраста матери, пола эмбриона и суток культивирования. Анализ результатов 218 программ ВРТ показал, что содержание мтДНК у эуплоидных бластоцист человека не зависит от репродуктивных исходов. Результаты предыдущих исследований, посвященных использованию мтДНК в качестве маркера имплантации, также показали противоречивые результаты [9, 10, 23, 24].
Результаты двух работ, опубликованных в 2015 г. [9, 10], продемонстрировали, что меньшее количество мтДНК в клетках ТЭ у эуплоидных эмбрионов служит маркером потенциально успешной имплантации бластоцисты в программе ВРТ. Diez-Juan A. et al. определили пороговое значение уровня мтДНК у эмбрионов, превышение которого никогда не приводило к наступлению беременности при переносе такого эмбриона [10]. Другой коллектив авторов разработал шкалу оценки потенциала эмбриона к имплантации в зависимости от количественного уровня мтДНК. В 2017 г. коллективы авторов в соавторстве с Fragouli E. опубликовали еще 2 работы [19, 20], в которых определили пороговый уровень отсечки мтДНК, превышение которого не приведет к беременности при переносе эуплоидного эмбриона.
Раннее развитие эмбриона зависит от серии координированных клеточных делений, регулируемых с помощью АТФ. Во время стадии бластоцисты производство АТФ повышается, чтобы обеспечить потребность клеток в энергии, необходимой для дальнейшей дифференциации и развития эмбриона, а также для поддержания процессов, необходимых для имплантации [9]. Повышение уровня мтДНК у нежизнеспособных эмбрионов наиболее вероятно связано с тем, что таким эмбрионам необходим дополнительный источник энергии в условиях клеточного стресса. В пользу гипотезы о повышении уровня мтДНК у эмбрионов, находящихся в условиях стресса, свидетельствует то, что у анеуплоидных эмбрионов содержание мтДНК гораздо выше по сравнению с эуплоидными [26, 27]. Существует теория «тихого эмбриона», согласно которой, жизнеспособный эмбрион имеет более низкий и «спокойный» метаболизм, в отличие от эмбрионов, находящихся в условиях клеточного стресса и обладающих сниженным потенциалом развития [9, 10, 26]. В качестве альтернативной гипотезы авторы предположили, что некоторые эмбрионы увеличивают уровень мтДНК для компенсации митохондриального дефицита, связанного с мутациями в митохондриальном геноме [20]. В своей работе Lledo B. et al. описали взаимосвязь мутаций митохондриального генома и повышенного уровня мтДНК, что приводило к снижению частоты имплантации эмбрионов, имеющих гетероплазмичные варианты мтДНК [21].
Результаты данного исследования не полностью согласуются с вышеописанными выводами зарубежных коллег. Согласно полученным данным, количественный уровень мтДНК не был связан с частотой имплантации в программе ВРТ. Кроме этого, в данном исследовании не было обнаружено порогового значения уровня мтДНК, выше или ниже которого не наступает беременность. Таким образом, результаты данного исследования согласуются с данными Victor A. et al. о том, что перенос эуплоидных эмбрионов с высоким количественным уровнем копий мтДНК может приводить к рождению здоровых детей [24, 25]. Согласно данным исследования Treff N.R. et al. [23], при переносе двух эуплоидных эмбрионов разного пола 69 пациенткам и успешной имплантации одного из эмбрионов не было обнаружено разницы в относительном количестве мтДНК у эмбрионов, которые привели к наступлению беременности и в группе эмбрионов с отрицательным результатом имплантации. Чтобы определить, является ли содержание мтДНК предиктором имплантационного потенциала эмбриона, был проанализирован уровень мтДНК у эмбрионов, полученных от одной супружеской пары. В исследование были включены пациентки, у которых в одном цикле при переносе эмбриона беременность не наступила, а в последующем цикле перенос размороженного эмбриона привел к наступлению беременности (39 женщин, 78 перенесенных эмбрионов). Изменений относительного уровня мтДНК у эмбрионов, полученных от одних родителей и обладающих разным имплантационным потенциалом, получено не было.
Результаты исследований не показали различий по количеству мтДНК у эмбрионов, полученных в группах женщин старшего репродуктивного возраста и более молодых пациенток [9, 25]. Статистически значимые изменения были обнаружены только при сравнении групп пациенток 21–22 лет и 42–48 лет, что можно объяснить выраженными дисфункциональными изменениями у эмбрионов, полученных от пациенток старшего репродуктивного возраста [19].
Результаты данного исследования показали, что количество копий мтДНК было значительно ниже у эмбрионов, подвергнутых биопсии на Д6, по сравнению с биопсированными эмбрионами на Д5, что согласуется с результатами других коллег [21, 23]. Таким образом, содержание митохондрий в клетке преимплантационного эмбриона зависит от числа клеточных делений, предшествовавших биопсии, и может отражать снижение относительного содержания мтДНК на клетку в результате деления клеток в растущей бластоцисте. Важно отметить, что по достижении стадии бластоцисты факторы репликации мтДНК (POLGA, POLGB и TFAM) активируются, что ведет к увеличению общего числа копий мтДНК [14]. Согласно Wu F.S.-Y. et al. [28], основная причина культивирования эмбрионов до Д6 заключается в том, чтобы дать отстающим в развитии эмбрионам дополнительное время для развития. Следовательно, общая клеточная масса между бластоцистами Д5 и Д6 должна быть примерно аналогичной. Авторы предположили, что ооциты, из которых получены бластоцисты Д6, изначально содержали субоптимальное количество мтДНК, что привело к энергетическому дефициту и потребовало дополнительного времени для завершения процесса бластуляции. Для формирования полости бластоцисты необходимы высокие уровни АТФ, а морула, имеющая сниженную функцию митохондрий, не способна образовать бластоцель, что приводит к задержке ее развития [10, 28]. Таким образом, бластоцисты Д6 имеют замедленную метаболическую активность и развитие в результате внутреннего или внешнего стресса, заставляющего клетки увеличивать содержание мтДНК для компенсации энергетического дефицита.
В данном исследовании было обнаружено, что эмбрионы с отличным морфологическим качеством клеток ТЭ (А) и экспансирующиеся бластоцисты содержали большее количество копий мтДНК на клетку по сравнению с эмбрионами, обладающими ТЭ хорошего качества (В). В ряде исследований было показано, что эмбрионы с отличными морфологическими характеристиками содержат меньшее количество мтДНК [10, 22, 23]. Полученные данные подтверждают, что степень экспансии и митогенная активность бластоцисты влияют на содержание мтДНК.
Несовпадение результатов подобных исследований у разных авторов, возможно, связано с методическими особенностями определения содержания мтДНК в эмбрионах. Не исключено, что измерение с помощью высокопроизводительного секвенирования продуктов полногеномной амплификации, полученной с помощью полимеразной цепной реакции, может быть недостаточно точным для получения исчерпывающих результатов. Данные, полученные с помощью измерения содержания мтДНК с помощью полимеразной цепной реакции в режиме реального времени с использованием специфических флуоресцентных зондов ранее показали, что копийность мтДНК в ТЭ анеуплоидных бластоцист статистически выше, чем эуплоидных [29].
Заключение
Согласно результатам данного исследования, уровень мтДНК в клетках ТЭ не позволяет прогнозировать имплантационный потенциал эмбриона и эффективность программы ВРТ. Стоит подчеркнуть, что бластоцисты со значительно повышенным уровнем мтДНК в клетках ТЭ приводили к рождению здоровых детей в программе ВРТ. Более того, не рекомендовано использовать произвольное пороговое значение уровня мтДНК, так как в разных клиниках были получены разные точки отсечки количественного содержания мтДНК в клетках, превышение которого не приводило к наступлению беременности при переносе эуплоидного эмбриона в программе ВРТ. Описанные в данной работе результаты подтверждают, что в клетках бластоцисты на 5-е сутки после оплодотворения содержится значительно большее количество мтДНК, чем у бластоцист на 6-е сутки культивирования, а количественный уровень мтДНК является одним из ключевых в отношении скорости развития бластоцисты.
Для лучшего понимания роли мтДНК в процессах раннего эмбриогенеза и клинической ценности данного маркера необходимы дополнительные исследования, включающие оценку взаимосвязи морфологических характеристик эуплоидного эмбриона и количественного уровня мтДНК как в общей группе пациентов, так и в группе эмбрионов, полученных от одной супружеской пары. Кроме того, требуется оптимизация существующих или разработка новых, более точных методов исследования содержания мтДНК в эмбрионах.



