Селекция сперматозоидов в женских половых путях крайне сложна и чрезвычайно важна для процессов оплодотворения и развития эмбриона. В настоящее время у человека до конца не изучен молекулярно-биологический механизм дистантного и контактного взаимодействия гамет в силу недоступности материала по этическим причинам. Однако развитие вспомогательных репродуктивных технологий (ВРТ) позволяет многие процессы in vivo имитировать в чашке Петри, соблюдая морально-этические принципы, и тем самым способствует пониманию причин бесплодия, особенно на клеточном уровне.
Разработка технологии интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) позволила многим супружеским парам с нарушениями сперматогенеза у мужчин иметь генетически родного, здорового ребенка. При выполнении данной процедуры клинический эмбриолог проводит обработку эякулята в градиенте плотностей и для инъекции использует подвижный, морфологически нормальный сперматозоид. При таком методе оплодотворения выбранная мужская гамета не является физиологически отобранной, ИКСИ обходит множественные барьеры, предусмотренные в женских половых путях. В частности, не используется ни хемотаксис, ни реотаксис – отбор по молекулярным особенностям мембраны и паттернам движения. Более того, при тератозооспермии (отсутствие в эякуляте морфологически нормальных сперматозоидов) повышается риск использования для ИКСИ «плохого» мужского материала, что приводит к отсутствию оплодотворения, аресту раннего эмбриогенеза и множественным неудачным попыткам ВРТ. Литературные данные подтверждают, что при выраженном факторе мужского бесплодия (повышенная фрагментация ДНК сперматозоидов, тератозооспермия) и проведении ИКСИ клинический и эмбриологический этапы программы лечения имеют низкие показатели — снижение частоты оплодотворения, дробления, бластуляции, эуплоидности и имплантации эмбриона в полости матки [1–3]. Именно поэтому в настоящее время ведутся активные поиски возможности имитировать отбор мужских гамет для ИКСИ, максимально приближенный к условиям в женском репродуктивном тракте. Это позволит улучшить развитие эмбриона in vitro и тем самым повысить эффективность лечения.
Показано, что мужские половые клетки отличного качества при дистантном взаимодействии гамет должны реагировать на хемоаттрактанты, выделяемые клетками кумулюса, которые окружают ооцит. Во время естественного оплодотворения только те сперматозоиды, которые пересекают ооцит-кумулюсный комплекс (ОКК), получают возможность достичь и проникнуть через блестящую оболочку и оплодотворить яйцеклетку. Если овулировавший ооцит полностью лишен клеток кумулюса, он остается неоплодотворенным. ОКК представляет собой сложную структуру, основным компонентом которой является гиалуроновая кислота (ГК), которая синтезируется клетками кумулюса после повышения уровня лютеинизирующего гормона (ЛГ) и, как считается, играет ключевую роль в отборе здоровых сперматозоидов. Именно на взаимодействии ГК и сперматозоидов основан метод ПИКСИ (отбор мужских половых клеток по связыванию с ГК в чашке Петри). Научные исследования показали, что сперматозоиды, которые проходят через ОКК, имеют лучшую морфологию и в большей степени осуществляют акросомную реакцию [4]. Кроме того, сперматозоиды имеют более высокую способность к связыванию с блестящей оболочкой и с большей вероятностью – целостную ДНК. Именно поэтому несколькими группами ученых недавно было предложено использовать ОКК для селекции сперматозоидов для ИКСИ [5–7]. Авторами показано улучшение эмбриологических показателей программ лечения бесплодия при нарушениях сперматогенеза, однако в работах используются разные дизайны чашек Петри и разные модификации использования ОКК для селекции мужских гамет, поэтому результаты трудно сопоставить между собой.
Целью настоящего исследования была оценка клинической эффективности использования ОКК для селекции сперматозоидов во время ИКСИ при нарушениях сперматогенеза на популяции российских супружеских пар, проходящих лечение методами ВРТ.
Материалы и методы
В исследование были включены супружеские пары, проходившие лечение в отделении вспомогательных технологий в лечении бесплодия имени профессора Б.В. Леонова ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России с января 2020 г. по декабрь 2022 г. Критериями включения служили следующие параметры: возраст женщины от 18 лет до 38 лет, подписанное информированное добровольное согласие на участие в исследовании, уровень антимюллерова гормона в крови женщины ≥1 нг/мл на 2–3-й день менструального цикла, присутствие живых сперматозоидов в эякуляте у партнера не менее 50%, прогрессивная подвижность сперматозоидов в нативном эякуляте не менее 12%, концентрация сперматозоидов не менее 1 млн/мл. Всего было включено 267 супружеских пар. Анализируемую группу составили 130 пациентов (группа ОКК), которым был произведен отбор сперматозоидов на ОКК с последующим проведением процедуры ИКСИ. Группу сравнения составили 137 пациентов, которым была выполнена стандартная процедура ИКСИ с отбором сперматозоидов по морфологическим характеристикам (группа ИКСИ).
Все супружеские пары перед вступлением в программу лечения бесплодия методами ВРТ прошли комплексное обследование согласно действующим регламентирующим документам: ст. 32, 37, 55 Федерального закона Российской Федерации от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»; Приказ Минздрава России № 107н от 30 августа 2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению»; Приказ Минздрава РФ № 556н от 30.10.2012 г. «Об утверждении стандарта медицинской помощи при бесплодии с использованием ВРТ». Программу ВРТ проводили по общепринятой методике. Стимуляцию функции яичников выполняли со 2–3-го дня менструального цикла препаратами рекомбинантного фолликулостимулирующего гормона или менопаузального гонадотропина человека. Для предотвращения преждевременного пика ЛГ при достижении фолликулом диаметра 14 мм назначали препарат антагониста гонадотропин-рилизинг-гормона в дозе 0,25 мг/сут подкοжно. Для финального созревания ооцитов по достижении диаметра фолликулов ≥17 мм использовали человеческий хорионический гонадотропин (ΧГЧ) в дозе 10 000 ΜЕ в качестве триггера овуляции. В условиях операционной под внутривенной анестезией через 36–37 ч после введения триггера овуляции была выполнена трансвагинальная пункция фолликулов с забором фолликулярной жидкости и последующей оценкой качества ооцитов.
При сборе ОКК клетки кумулюса частично механически отсекали с помощью стерильной иглы инсулинового шприца под оптическим микроскопом, предварительно отмыв ОКК от клеток крови и фолликулярной жидкости в буфере с HEPES (Gamet Buffer, COOK, Ирландия). Затем полученные ОКК и отдельные клетки кумулюса помещали в культуральную среду (G-IVF, Vitrolife, Швеция) и инкубировали при 37°С, 6,2% CO2, 5% О2 в отдельных лунках 4-луночного планшета в ожидании дальнейшего использования. В группе сравнения отрезания клеток кумулюса не проводили.
Образцы спермы собирали путем мастурбации после 3–5 дней воздержания от эякуляции. Сперматозоиды выделяли методом центрифугирования в градиенте плотностей с последующей отмывкой в среде для сперматозоидов согласно инструкциям производителя (Spermwash, IrvineSc., США). После инкубации в течение 2–3 ч кумулюсные клетки отделяли от ооцитов раствором гиалуронидазы с помощью пастеровской пипетки перед ИКСИ стандартными методами (IrvineSc., США). После окончательной денудации отбирали ооциты на стадии MII, пригодные для ИКСИ. Оплодотворение в группе сравнения проводили обычным методом, принятым в лаборатории.
Селекция сперматозоидов с помощью ОКК
Во всех случаях оплодотворения использовали собственные ОКК пациентки. За 1 ч до процедуры ИКСИ готовили чашку Петри, показанную на рисунке. Использовали среду, содержащую HEPES (Gamet Buffer, COOK, Ирландия). Собранные ОКК помещали в область центральной капли, обработанные сперматозоиды – в крайнюю левую каплю (рисунок).
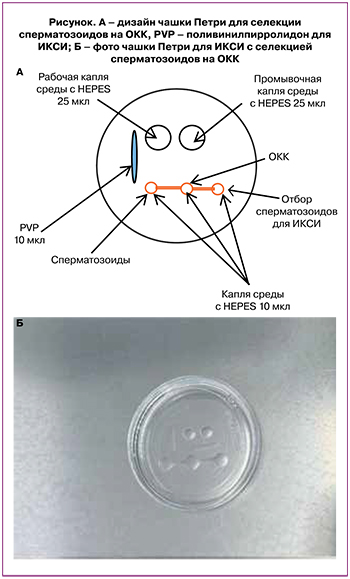
Ожидали, что сперматозоиды будут плыть из крайней левой капли через центральную, содержащую клетки кумулюса, собираясь в крайней правой капле. Оттуда микроинструментами для ИКСИ мужские половые клетки отбирали и проводили оплодотворение. Подготовленную рабочую чашку с ОКК и спермой выдерживали в инкубаторе в течение 1 ч, чтобы сперматозоиды могли пересечь клетки кумулюса.
Все процедуры ИКСИ проводились через 39–40 ч после введения ХГЧ обученным эмбриологом с опытом работы более 5 лет. Сперматозоиды с наилучшей морфологией отбирали для инъекции с помощью инвертированного микроскопа, оснащенного микроманипуляторами. После инъекции ооциты переносили в отдельные чашки для культивирования со средой для оплодотворения (G-IVF, Vitrolife, Швеция) до момента наблюдения за пронуклеусами. Дальнейшее культивирование осуществляли до 5-х суток в одноступенчатых средах (G-TL, Vitrolife, Швеция) до момента переноса эмбриона в полость матки. На 5-й день была выбрана бластоциста с лучшими показателями для переноса в матку пациентки. Оставшиеся пригодные для использования бластоцисты были витрифицированы. Эмбрионы оценивали согласно рекомендациям РАРЧ.
Поддержку лютеиновой фазы осуществляли препаратами прогестерона. Для подтверждения беременности все пациентки на 12–14-й день после переноса эмбриона сдавали венозную кровь на β-ХГЧ. Результаты протекания беременности и факт живорождения узнавали путем телефонного звонка пациентке в предполагаемую дату 12 недель развития плода и дату родов.
Статистический анализ
Анализ результатов проводился с помощью пакета программ IBM SPSS Statistics версии 23.0 (США), а также с помощью таблиц Microsoft Excel. Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова). Непрерывные переменные были представлены в виде медианы (Ме) и межквартильных значений (Q1; Q3) на основе распределения выборки. Статистический анализ проводили с помощью теста Манна–Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. Для описания категориальных бинарных данных (клинико-анамнестические данные и исходы программ ВРТ (имплантация и роды)) использовали процентные доли от общего числа пациенток в группе P и абсолютные числа N в формате P% (N). Анализ номинальных данных проводили с помощью критерия Хи-квадрат (χ2) и точного критерия Фишера. Для сравнения групп по номинальным признакам в проспективном исследовании рассчитывали относительный риск (ОР) с 95% доверительным интервалом (ДИ) для сравнения вероятности исхода (имплантация, роды) в зависимости от наличия фактора (селекция сперматозоидов на клетках кумулюса). Для оценки величины клинического эффекта для главных критериев эффективности первичных исходов (частота оплодотворения и частота бластуляции) для непрерывных данных использовали разность медиан с 95% ДИ (оценка Ходжеса–Лемана). Величину порогового уровня значимости p принимали равной 0,05. Силу связи или зависимости между бинарными величинами рассчитывали с помощью отношения шансов (ОШ). Дополнительно оценивали статистическую значимость ОШ, исходя из значений 95% ДИ.
К количественным переменным относили возраст женщины, количество ОКК, количество MII ооцитов, количество оплодотворенных клеток (2PN), количество бластоцист хорошего и отличного качества, процент зрелых клеток, процент оплодотворения, процент бластуляции, количество попыток ЭКО/ИКСИ в анамнезе. В качестве клинико-анамнестических данных, закодированных в бинарном виде, рассматривали наличие трубно-перитонеального фактора, наличие эндометриоза I и II стадий распространения или эндометриоидных кист, первичное или вторичное бесплодие, наличие маточного фактора (миомы, разделение синехий, аденомиоз, рубец на матке), а также принадлежность к изучаемым группам (селекция сперматозоидов на ОКК или стандартная процедура проведения ИКСИ). Под бластуляцией понимали процент бластоцист хорошего и отличного качества, пригодных для переноса.
Результаты
Статистический анализ клинических характеристик и эмбриологического этапа исследуемых групп представлен в таблице 1. Согласно результатам теста Колмогорова–Смирнова, распределение значений количественных характеристик значимо отличается от нормального (р<0,05).
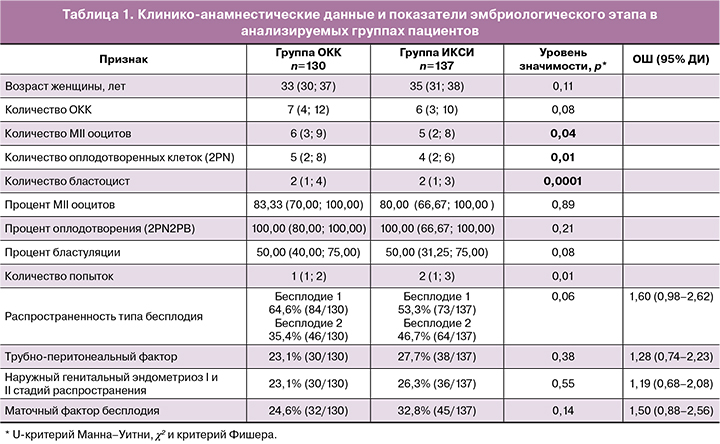
Согласно данным, описанным в таблице 1, анализируемые группы не отличались друг от друга ни по возрасту пациенток, ни по клинико-анамнестическим признакам: преобладанию типа бесплодия (первичное или вторичное), наличию трубно-перитонеального фактора, эндометриоза и/или эндометриоидных кист, а также каких-либо маточных факторов (миома, аденомиоз, рубец, разделение синехий) в анамнезе. В группе пациентов, которым была проведена стандартная процедура ИКСИ, преобладали пары с большим количество попыток ЭКО/ИКСИ.
Абсолютные количественные показатели эмбриологического этапа (количество зрелых ооцитов, количество оплодотворенных клеток, количество бластоцист хорошего и отличного качества) были статистически значимо выше в группе селекции сперматозоидов на ОКК. Однако при оценке в относительных единицах данных характеристик эти различия не подтвердились/сохранились. Отмечалась тенденция к повышению процента бластуляции в группе селекции сперматозоидов на ОКК (р=0,08).
Учитывая, что результаты эмбриологического этапа и, как следствие, исходы программ ВРТ зависят от многих фактором, одним из которых является качество эякулята (количество морфологически нормальных сперматозоидов), было принято решение отдельно оценить данные показатели в группе селекции сперматозоидов на ОКК с морфологией сперматозоидов 0–1% и 2–3% и сравнить их с аналогичными подгруппами в группе пациентов, которым была выполнена стандартная процедура ИКСИ. Количество пациентов в подгруппах сравниваемых групп и результаты оценки эмбриологического этапа представлены в таблице 2.

В результате селекции сперматозоидов с помощью ОКК с последующим проведением стандартной процедуры ИКСИ в когорте пациентов с морфологией сперматозоидов 0–1% было описано статистически значимое повышение процента оплодотворения и процента бластуляции, по сравнению с соответствующей подгруппой пациентов, у которых отбор сперматозоидов проводился только на основании морфологических признаков. В когорте пациентов с морфологией 2–3% подобных различий выявлено не было. Таким образом, селекция сперматозоидов с помощью ОКК представляется перспективной методикой для повышения значимых характеристик эмбриологического этапа.
Исходы программ ВРТ в анализируемых группах и подгруппах представлены в таблицах 3 и 4. На основании полученных данных отмечено, что ни частота наступления беременности, ни частота родов не зависят от проведения селекции сперматозоидов на ОКК как среди пациентов с морфологией 0–1%, так и среди пациентов с морфологией 2–3% при переносе нативного эмбриона в цикле стимуляции функции яичников.
Обсуждение
При каждом половом акте миллионы сперматозоидов попадают во влагалище, но только около 1000 мужских гамет достигают фаллопиевой трубы для потенциального оплодотворения яйцеклетки. Огромное сокращение количества сперматозоидов, достигающих фаллопиевой трубы, является результатом отбора при оплодотворении in vivo. Чтобы пройти отбор, сперматозоиды должны быть способны взаимодействовать с женскими половыми путями и проникать через клетки кумулюса и блестящую оболочку [8]. По оценкам, бесплодие затрагивает 15% пар репродуктивного возраста (15–49 лет) во всем мире, а мужское бесплодие составляет 20–70% общего бесплодия. Методы ВРТ позволяют эффективно преодолевать бесплодие, однако около 10% супружеских пар сталкиваются с неудачами оплодотворения, арестом эмбрионов и отсутствием пригодных эмбрионов для переноса в полость матки. Метод ИКСИ частично позволил преодолевать мужской фактор бесплодия, однако до настоящего момента эффективность зачатия при нарушениях сперматогенеза остается ниже по сравнению с трубно-перитонеальным фактором бесплодия.
Исследователи пытаются улучшить селекцию сперматозоидов в эпоху ИКСИ, применяя различные методы [9, 10]. Одним из них является использование клеток кумулюса, эффективность которого была оценена в настоящей работе. Как показали клинические результаты проведенного исследования, частота имплантации (38,5% в группе ОКК против 35,9% в группе ИКСИ) в общей когорте пациентов достоверно не увеличивается при селекции сперматозоидов на клетках кумулюса. Частота успешных родов также осталась прежней (77,8% в группе ОКК против 73,8% в группе ИКСИ). Эмбриологический этап в общей когорте пациентов достоверно не улучшается. Была показана лишь тенденция к увеличению числа бластоцист отличного и хорошего качества при оплодотворении сперматозоидами, прошедшими клетки кумулюса, и как следствие, – увеличению числа эмбрионов, пригодных для переноса в полость матки и криоконсервации.
Однако при выделении групп пациентов с показателями морфологии сперматозоидов 0–1% и 2–3%, то есть при стратификации тератозооспермии на легкую и выраженную, было обнаружено достоверное увеличение процента оплодотворения (100% в группе ОКК и 77,78% в группе ИКСИ, p=0,001). Процент дорастания бластоцист отличного и хорошего качества также был достоверно выше в группе селекции сперматозоидов на ОКК (60% в группе ОКК против 50% в группе ИКСИ, p=0,004). Данные результаты указывают на целесообразность использования данного метода селекции сперматозоидов при тератозооспермии с показателями морфологически нормальных сперматозоидов 0–1%. Особенно важно использовать дополнительные критерии отбора сперматозоидов при 100% тератозооспермии (0% морфологически нормальных сперматозоидов). Действительно, при стратификации в группы по морфологии сперматозоидов нам не удалось показать значимое повышение эффективности программ лечения бесплодия методами ВРТ. В группе 0–1% частота имплантации при отборе сперматозоидов на клетках кумулюса составила 31,8%, при стандартном ИКСИ – 25,7% (р=0,62), однако прослеживалась положительная тенденция. Вероятно, при увеличении выборки можно будет получить достоверную разницу. Частота родов при тератозооспермии 0–1% также достоверно не увеличилась после селекции сперматозоидов на клетках кумулюса: 71,4% против 77,8% в группе ИКСИ, однако не были учтены женские факторы при вынашивании беременности.
При этом важным результатом настоящей работы является увеличение числа эмбрионов хорошего и отличного качества при тератозооспермии 0–1% при оплодотворении сперматозоидами, отобранными на клетках кумулюса. Это дает шанс супружеской паре без повторной стимуляции функции яичников, прохождения трансвагинальной пункции фолликулов вступить в программу переноса размороженного эмбриона и достичь долгожданной беременности. Также использование селекции на клетках кумулюса в этой когорте пациентов позволяет снизить государственные затраты на рождение 1 ребенка, поскольку стоимость полной программы ЭКО, по сравнению с криопротоколом, отличается в 3 раза.
Опубликованные результаты зарубежных авторов согласуются c полученными в данной работе результатами [5–7]. По данным исследований, эффективный подход, основанный на отборе сперматозоидов с помощью ОКК, обеспечивает безопасную селекцию сперматозоидов в чашке ИКСИ [7]. Naknam W. et al. было проанализировано 857 сиблинговых ооцитов на стадии MII, которые произвольно и поровну были поделены для оплодотворения с использованием ОКК-ИКСИ (n=429) и обычным ИКСИ (n=428) [7]. У яйцеклеток, оплодотворенных сперматозоидами, отобранными с помощью клеток кумулюса, коэффициент оплодотворения был выше, чем в группе обычного ИКСИ (85,31% против 74,77%; p<0,05). Статистически достоверных различий в коэффициенте дробления (98,09% против 98,13%; р>0,05) и частоте получения эмбрионов без фрагментаций на 3-й день (63,23% против 58,92%; р>0,05) между ОКК-ИКСИ и обычным ИКСИ не выявлено. Однако при рассмотрении дальнейшего развития, по сравнению с группой обычного ИКСИ, группа ОКК-ИКСИ показала большую частоту формирования бластоцист на 5-й день (46,52% против 38,85%; р<0,05) и бластоцист отличного качества, пригодных для переноса в полость матки и криоконсервации (38,72% против 24,20%; р<0,05). Кумулятивные показатели имплантации эмбрионов при ОКК-ИКСИ и при обычном ИКСИ составили 64,29 и 53,85% соответственно.
Заключение
Результаты настоящего исследования показывают, что использование ОКК для селекции сперматозоидов в программах лечения бесплодия методами ВРТ можно рекомендовать пациентам с нарушениями сперматогенеза в виде снижения доли морфологически нормальных сперматозоидов в эякуляте. У таких супружеских пар можно добиться увеличения частоты оплодотворения и развития эмбрионов до стадии бластоцисты. Это позволяет снизить затраты на стимуляцию функции яичников и добиться желанной беременности при переносе размороженного эмбриона в криоцикле. Также существенным преимуществом селекции сперматозоидов на клетках кумулюса является использование аутологичного биологического материала, в отличие от метода ПИКСИ, где на чашки Петри нанесена синтезированная ГК.
Основываясь на наших данных и результатах, опубликованных в литературе, целесообразно рекомендовать физиологическую селекцию сперматозоидов с помощью клеток кумулюса пациентам, в эякуляте которых доля сперматозоидов с нормальной морфологией составляет менее 1%, для повышения эффективности лечения бесплодия.



