Ключевым этапом каждого цикла экстракорпорального оплодотворения (ЭКО) является отбор эмбриона с наивысшим потенциалом имплантации [1]. Тем не менее перенос в полость матки эмбриона с хорошей морфологией не всегда приводит к его имплантации [2], поскольку одним из факторов имплантационных и ранних репродуктивных потерь являются хромосомные анеуплоидии (ХА) эмбрионов [3]. Кроме того, описаны анеуплоидии, приводящие к остановке развития эмбриона и нарушению клеточного деления [3]. В настоящее время морфологические методы оценки качества эмбриона не позволяют с достаточно высокой точностью выявить анеуплоидии [4]. Установлено, что с увеличением возраста матери растет вероятность обнаружения хромосомных аномалий эмбрионов [5], однако даже при оплодотворении донорских яйцеклеток, полученных у молодых здоровых женщин, в 18–61% случаев обнаруживаются ХА эмбрионов [6].
Большинство анеуплоидий имеют материнское происхождение, т.е. возникают вследствие мейотических ошибок [7]. Ранее было показано, что в бластомерах хромосомные трисомии материнского происхождения выявлялись почти в 10 раз чаще, чем трисомии отцовского происхождения. Предимплантационное генетическое тестирование на анеуплоидии (ПГТ-А) с помощью анализа полярных телец показало, что ошибки в мейозе II (MII) встречаются чаще, чем в мейозе I (МI). Ошибки материнского мейоза являются основными причинами формирования ХА эмбрионов человека; из них в 45% случаев ХА формируется за счет MII, а 34% ХА эмбрионов – за счет MI [8].
В течение последних лет значительно повысилась доля пациенток старшего репродуктивного возраста, обращающихся по поводу лечения бесплодия при помощи вспомогательных репродуктивных технологий (ВРТ) [9], при этом обнаружение ХА у них может достигать 90% случаев. В связи с этим прилагается много усилий для внедрения новых подходов с целью диагностики ХА. К технологиям, позволяющим оценивать все 24 хромосомы, относят сравнительную геномную гибридизацию [10], количественную полимеразную цепную реакцию (ПЦР) [11, 12] и высокопроизводительное секвенирование [13–15]. Недостатком вышеуказанных методов является невозможность различить материнское или отцовское происхождение анеуплоидий. Происхождение анеуплоидии можно определить с помощью детекции и сравнительного анализа однонуклеотидных полиморфизмов (SNP) в образцах ДНК эмбрионов и их родителей [7]. Генотипирование обоих родителей и эмбриона в то же время позволяет нам различать родительское происхождение каждой хромосомы, а также идентифицировать позиции, в которых произошел кроссинговер. Более того, с помощью SNP-гаплотипирования возможно измерение числа хромосом. Все это дает возможность получать исчерпывающую информацию о механизмах появления и происхождении ХА у эмбрионов. Однако данный метод является очень дорогим и требует специального оборудования.
Цель исследования: разработать метод определения материнского или отцовского происхождения ХА эмбриона с помощью STR-анализа у пациентов программ ВРТ.
Материалы и методы
Для разработки данного метода использовали материал биопсии трофэктодермы эмбрионов 58 пар пациентов (116 человек), обратившихся для проведения программы ВРТ с ПГТ-А по следующим показаниям: возраст матери старше 35 лет, неоднократные неудачные попытки ЭКО в анамнезе (2 и более), привычное невынашивание, выраженные нарушения сперматогенеза, желание пациентки. Пациентки прошли амбулаторное обследование перед программой ЭКО, которое включало обязательные методы исследования, специальные методы исследования, а также исследования по медицинским показаниям. У всех пациентов было получено информированное согласие на проведение данного исследования. От каждой пары были получены образцы крови, собранные в пробирки с EDTA для дальнейшего выделения ДНК.
Для стимуляции функции яичников использовали протокол с антагонистом гонадотропин-рилизинг-гормона. Стимуляцию проводили препаратами рекомбинантного фолликулостимулирующего гормона (ФСГ), комбинированного препарата рекомбинантного ФСГ и лютеинизирующего гормона (ЛГ) или человеческого менопаузального гонадотропина со 2–3-го дня менструального цикла. Доза препарата зависела от возраста пациентки и овариального резерва (уровня антимюллерова гормона (АМГ) и числа антральных фолликулов по данным ультразвукового исследования). Полученные в ходе трансвагинальной пункции зрелые ооциты были оплодотворены методом интрацитоплазматической инъекции сперматозоида (ИКСИ). После оплодотворения ооциты переносили в культуральную среду Cook (Австралия).
Морфологическая оценка эмбрионов проводилась через 120–122 ч (на 5-е сутки) культивирования. Учитывали морфологические характеристики эмбрионов по классификации Гарднера (степень зрелости бластоцист, качество внутриклеточной массы и качество трофоэктодермы (ТФЭ)). Биопсию ТФЭ проводили на 5-й день культивирования эмбрионов in vitro (через 120 ч после трансвагинальной пункции) с помощью микроманипулятора Narishiga (Япония). Для рассечения zona pellucida использовали лазерную пушку Fertilase (Германия). Для аспирации клеток ТФЭ использовали микропипетки Cook (Австралия). С использованием микропипеток TPC для биопсии эмбрионов (The Pepette Company, Австралия) и активного лазера Octax (MTG, Германия) забирали в среднем 5–10 клеток ТФЭ каждого эмбриона. Клетки ТФЭ промывали в стерильной среде, содержащей буфер HEPES (FertiPro), и помещали их в каплях объемом 3 мкл в 0,2 мл пробирки Eppendorf для ПЦР.
Полногеномную амплификацию проводили с помощью WGA-PCR (Rubicon, США) и MDA (Qiagen, США). ПГТ-А с помощью высокопроизводительного секвенирования проводили на наборах ReproSeq (Thermo Fisher Scientific, США). В дальнейшем полногеномный амплификат использовали для проведения фрагментного анализа. Для этого осуществляли дополнительный этап амплификации с использованием оригинальных, разработанных в рамках данного исследования, меченных флюорофором праймеров для STR-анализа. Фрагментный анализ ДНК родителей проводили без предварительного этапа полногеномной амплификации. Полученные меченные флюорофором ампликоны анализировали с использованием прибора для проведения капиллярного электрофореза Genetic Analyzer 3130 (AppliedBiosystems). Анализ и сравнение полученных STR-профилей проводили при помощи программного обеспечения GeneMapper ID v3.2.1 (Applied Biosystems).
Результаты
Всего для разработки данного методического подхода использовали ТФЭ 167 эмбрионов. Среднее количество проанализированных эмбрионов на одну пациентку составило 2,8.
После проведения ПГТ-А анеуплоидии были выявлены у 67 эмбрионов (41%), эуплоидными были 65 (40%), мозаичные формы были обнаружены у 28 (17%) эмбрионов. 3 эмбриона были полиплоидными. Не прошла полногеномная амплификация у 4 эмбрионов (2%). Наиболее часто анеуплоидии в эмбрионах были связаны с 22-й и 16-й хромосомами (рис. 1).

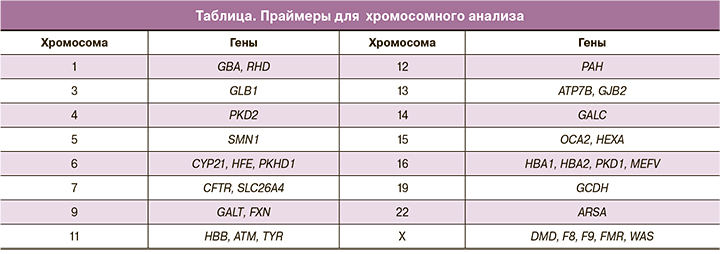
В рамках данного исследования были подобраны и синтезированы праймеры для анализа хромосом 1, 3, 4, 5, 6, 7, 9, 11, 12, 13, 14, 15, 16, 19, 22 и X (таблица). Выбор данных генов и регионов был обусловлен тем, что полученные STR-маркеры были информативны для проведения ПГТ-М соответствующих заболеваний. Например, праймеры для исследования 5-й хромосомы человека разработаны так, чтобы можно было использовать их для изучения наследования заболеваний, связанных с нарушениями в гене SMN1 (спинальная мышечная атрофия). Праймеры для исследования 16-й хромосомы расположены в области гена PKD1 и предназначены для изучения наследования синдрома поликистозных яичников (СПКЯ).
С целью определения возможности проведения данного исследования на различном биологическом материале мы отрабатывали фрагментный анализ на образцах, полученных разными способами: 1) полногеномная амплификация с помощью WGA-PCR, полученная с помощью наборов Rubicon (USA); 2) полногеномная амплификация, полученная с помощью WGA-PCR с бар-кодами для высокопроизводительного секвенирования (ThermoFisher, USA); 3) полногеномная амплификация, полученная с помощью MDA (Qiagen, USA); 4) нативная ДНК, выделенная из крови (отец и мать).
Было показано, что для успешного проведения STR-анализа и определения родительского вклада в развитие анеуплоидий эмбрионов можно использовать как продукт, полученный с помощью WGA-PCR (как с бар-кодами для высокопроизводительного секвенирования, так и без них), так и продукты, полученные с помощью MDA. Вместе с тем надежные результаты можно получить только в том случае, если STR-маркеры родителей не совпадают, так как на величину пика и площадь под кривой может влиять неравновесная полногеномная амплификация разных участков разных хромосом. Также при использовании полногеномной амплификации возможно выпадение аллеля, что затрудняет или вовсе делает невозможной правильную интерпретацию результатов, однако в нашей работе данный феномен не был выявлен.
Фрагментарный анализ эмбрионов по отдельным хромосомам (16-я хромосома (n=7 эмбрионов), 19-я хромосома (n=5 эмбрионов) и 22-я хромосома (n=8 эмбрионов)) показал, что с помощью данного подхода можно идентифицировать анеуплоидии как материнского, так и отцовского происхождения (рис. 2.1, 2.2). Так на рисунке 2.1 видно, что эмбрион получил две 19-х хромосомы от отца и одну от матери. Из рисунка 2.2 следует, что эмбрион получил одну 22-ю хромосому от отца и две от матери.

Несмотря на то что были разработаны методики выявления родительского происхождения практически для всех анеуплоидий, в ряде случаев интерпретация результатов была неоднозначной, что требует проведения дополнительных исследований в данной области.
Обсуждение
В ходе анализа 167 образцов биопсии ТФЭ от 58 пациенток, обратившихся для проведения программы ЭКО с ПГТ-А, в 41,0% случаев были диагностированы анеуплоидные эмбрионы, что согласуется с полученными ранее данными [16, 17]. Безусловно, возраст матери играет важную роль в возникновении анеуплоидии; но анеуплоидии в эмбрионах определяются также и в программах ЭКО с донорскими ооцитами, где, как известно, возраст донора не превышает 35 лет [6].
В нашем исследовании в 17% случаев были выявлены эмбрионы с мозаичным генотипом, при переносе в полость матки которых частота наступления беременности более низкая; при этом повышается риск невынашивания беременности [18]. Решение о переносе эмбрионов с мозаичным генотипом в полость матки является спорным вопросом без четких рекомендаций на сегодняшний день, поэтому в настоящем исследовании мы углубленно такие эмбрионы не анализировали.
Преимуществами применения фрагментного STR-анализа являются его относительная простота и дешевизна. Для его проведения требуется комплект оборудования, который, как правило, имеется в распоряжении большинства генетических лабораторий. Это амплификатор для проведения ПЦР и прибор для капиллярного электрофореза. Кроме того, отсутствует необходимость в дорогостоящих приборах для сравнительной геномной гибридизации или высокопроизводительного секвенирования.
Проведенный анализ эмбрионов с помощью фрагментного анализа по 16 (n=7 эмбрионов), 19 (n=5 эмбрионов) и 22 (n=8 эмбрионов) хромосомам показал принципиальную возможность определения родительской принадлежности хромосом у анеуплоидных эмбрионов.
Если в результате ПГТ-А с определением родительского происхождения анеуплоидий отсутствуют эмбрионы, рекомендованные к переносу, целесообразно повторное проведение программы. При повторном отсутствии эмбрионов для переноса по результатам ПГТ-А с определением родительского происхождения анеуплоидий рекомендуется проведение программы ЭКО с донорскими клетками. Выбор донорского материала (ооциты или сперма) рекомендуется проводить на основании результатов ПГТ: если анеуплоидии имеют материнское происхождение – программа ЭКО с донорскими ооцитами, если отцовское – программа ЭКО с использованием донорской спермы.
При невозможности получить эмбрионы для последующей программы с ПГТ-А с определением родительского происхождения анеуплоидий рекомендуется ориентировать пациентов на программу с использованием донорских клеток.
Заключение
Показана принципиальная технологическая возможность проведения фрагментного STR-анализа с целью генотипирования эмбрионов с использованием различных продуктов полногеномной амплификации. Данный подход позволяет проводить ПГТ-А и ПГТ-М совместно с генотипированием эмбрионов без необходимости повторных биопсий, которые могут негативно влиять на их жизнеспособность. Изучение влияния родительского вклада в развитие анеуплоидий эмбрионов в будущем, возможно, позволит выбрать оптимальную тактику ведения пациентов с неоднократными неудачными попытками ВРТ и невынашиванием беременности в анамнезе.



