Поиск генетических маркеров, которые в перспективе можно было бы использовать в качестве предикторов особенностей течения различных заболеваний, занимает важное место в современной медицине. Респираторный дистресс-синдром (РДС) и врожденная пневмония, наиболее часто встречающиеся респираторные заболевания у новорожденных, относятся к многофакторным заболеваниям, генетическая предрасположенность к которым доказана рядом исследований [1–3]. Хамидуллина Л.И., сравнивая полиморфизм вариабельных участков генома у новорожденных с дыхательными нарушениями и без таковых, выявила, что предрасположенность к развитию дыхательных нарушений у новорожденных маркирует генотип Ala/Ala (OR=2,10) и аллель Ala (OR=l ,89) полиморфного локуса Ala114Val гена GSTP1. У мальчиков предрасположенность к дыхательным нарушениям ассоциирована с гаплотипом *2А (и, по-видимому, с гаплотипом *2B, т.к. анализировали локус Т3801С (rs4646903)) гена CYP1A1 (OR=1,96) [4].
Также было установлено, что маркером предрасположенности к развитию РДС является гаплотип 11Thr+160Thr гена SFTPD (OR=3,18), а предрасположенность к формированию РДС, осложненного пневмонией, маркируют аллель А полиморфного варианта С-163А (rs762551) гена CYP1A2 (OR=1,24) и генотип Thr/Met полиморфного локуса Thr11Met гена SFTPD (OR=2,67) [4]. В другом исследовании было установлено, что маркерами устойчивости к развитию дыхательных расстройств периода новорожденности является генотип Ins/Ins инсерционно-делеционного полиморфизма гена ACE (р=0,011) и количество тандемных повторов в 4-м интроне гена сурфактантного белка В (SFTPB). При этом аллель Del полиморфного локуса гена ACE является маркером предрасположенности новорожденных к дыхательным расстройствам (р=0,014). Кроме того, было выявлено, что генотип С/С полиморфного локуса 32C>Т гена сурфактантного белка D (SFTPD) является маркером устойчивости к развитию инфекционных осложнений РДС (р=0,0090), в то время как аллель А полиморфного локуса –627C > А гена интерлейкина 10 ассоциируется с развитием инфекционных осложнений РДС [1].
Нами был поставлен вопрос, почему дети с таким нередким заболеванием, как врожденная пневмония, демонстрируют разную степень тяжести дыхательных нарушений. Некоторые пациенты с врожденной пневмонией обходятся проведением неинвазивной респираторной терапии, другие развивают тяжелые дыхательные нарушения и нуждаются в переводе на традиционную искусственную вентиляцию легких (ИВЛ), третьи развивают настолько тяжелые дыхательные нарушения, что требуют жестких параметров ИВЛ, высокой концентрации кислорода и нуждаются в переводе на высокочастотную осцилляторную вентиляцию легких (ВЧОВ). Гипотезой явилось носительство аллельных вариантов генов, ассоциированных с тяжелым течением дыхательных нарушений при врожденной пневмонии. В имеющейся литературе мы не нашли сведений о генетических маркерах степени тяжести дыхательных нарушений при врожденной пневмонии у новорожденных детей. Ответу на этот вопрос посвящено наше исследование.
Цель исследования: выявить генетические маркеры, ассоциированные с тяжестью течения врожденной пневмонии у новорожденных детей.
Материал и методы
Для оценки полиморфизма вариабельных участков генома нами были исследованы образцы периферической крови, собранные в первые сутки жизни у 101 новорожденного c подтвержденным диагнозом «врожденная пневмония», которые проходили лечение в отделении реанимации и интенсивной терапии им. проф. Антонова А.Г. института неонатологии и педиатрии ФГБУ НМИЦ АГП им. В.И. Кулакова Министерства Здравоохранения Российской Федерации (директор института неонатологии и педиатрии Зубков В.В., заведующий отделением реанимации и интенсивной терапии новорожденных Ионов О.В.) в период с 01.10.2013 по 31.12.2014. Все дети требовали проведения респираторной терапии. Диагноз «врожденная пневмония» устанавливался в соответствии с протоколом диагностики инфекционных заболеваний, принятым в отделении [5].
Исследуемые пациенты были разделены на 3 группы. I группа включала 63 новорожденных, у которых респираторная терапия ограничилась назальной неинвазивной поддержкой: неинвазивной ИВЛ постоянным положительным давлением (СРАР) или неинвазивной ИВЛ в режиме двухуровневого СРАР (Biphasic). II группу составили 25 пациентов, потребовавших интубации и проведения инвазивной традиционной ИВЛ. В III группу вошло 13 детей, нуждавшихся в жестких параметрах традиционной ИВЛ и, как следствие, в переводе на следующий уровень респираторной терапии – ВЧОВ.
Показанием для неинвазивной респираторной терапии с рождения являлись: для детей, родившихся на 32 неделе гестации и ранее – профилактически, для детей, родившихся на 33 неделе гестации и более – наличие дыхательных нарушений при оценке по шкале Сильвермана более 3 баллов.
Критериями для перевода детей с неинвазивной респираторной терапии на традиционную ИВЛ явились: оценка дыхательных нарушений по шкале Сильвермана более 3 баллов и/или потребность в дополнительной оксигенации более 30% для новорожденных, родившихся на 28 неделе гестации и ранее, и более 40% – для новорожденных, родившихся на сроке беременности более 28 недель для поддержания уровня сатурации 90–95%.
Показанием для перевода на высокочастотную ВЧОВ явились «жесткие» режимы традиционной ИВЛ: среднее давление в дыхательных путях (МАР) более 12 см Н2О и потребность в дополнительной оксигенации более 50% для поддержания уровня сатурации 90–95%.
ДНК для генотипирования выделяли из образцов периферической крови, взятой в пробирки с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Объем образцов после выделения составил 100 мкл. Концентрация ДНК определенная на ДНК-минифлуориметре (Ноеfer, США), составляла, в среднем, 50–100 мкг/мл.
Полимеразную цепную реакцию (ПЦР) и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-964 (ООО «НПО ДНК-Технология», Россия).
Генотипирование проводили методом ПЦР с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) в лаборатории молекулярно-генетических методов ФГБУ «НМИЦ АГП им. В.И. Кулакова» (заведующий лабораторией Донников А.Е.) с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия.
Из исследования были исключены дети, матери которых получали антенатальную профилактику стероидами. Характеристика групп представлена в таблице 1.
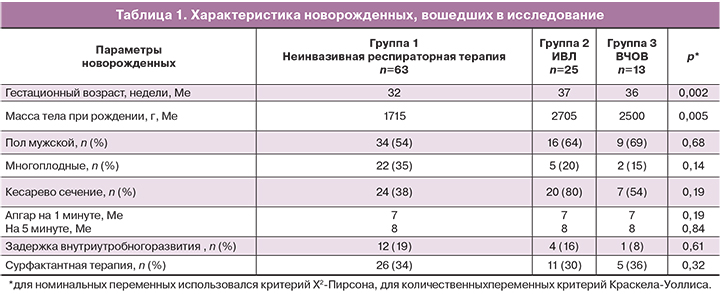
Отмечались достоверные различия в гестационном возрасте, массе тела при рождении у детей между группами, однако с тяжелыми респираторными нарушениями были ассоциированы прогностически более благоприятные массо-ростовые показатели и больший гестационный возраст.
Результаты исследования
Результаты генотипической частоты встречаемости аллелей в группах представлены в таблице 2.
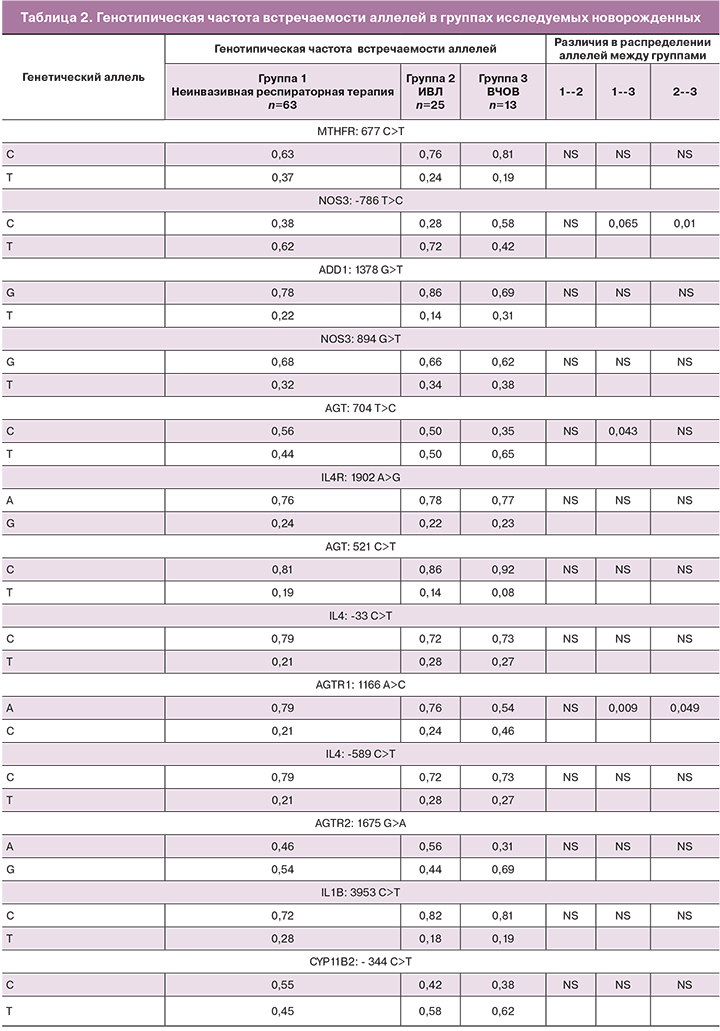
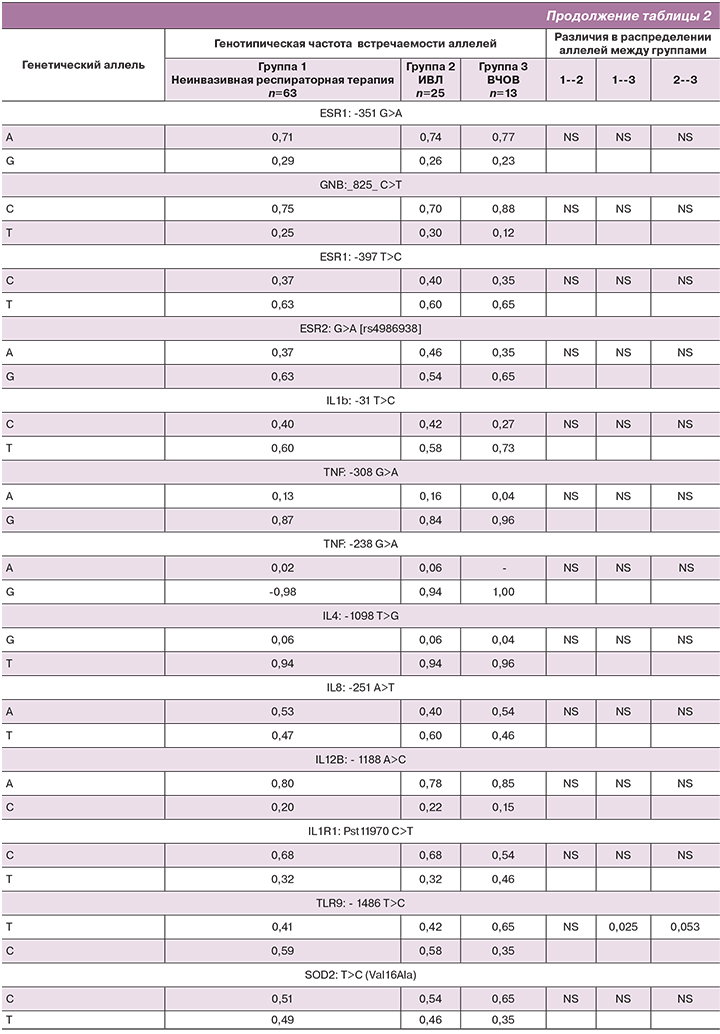
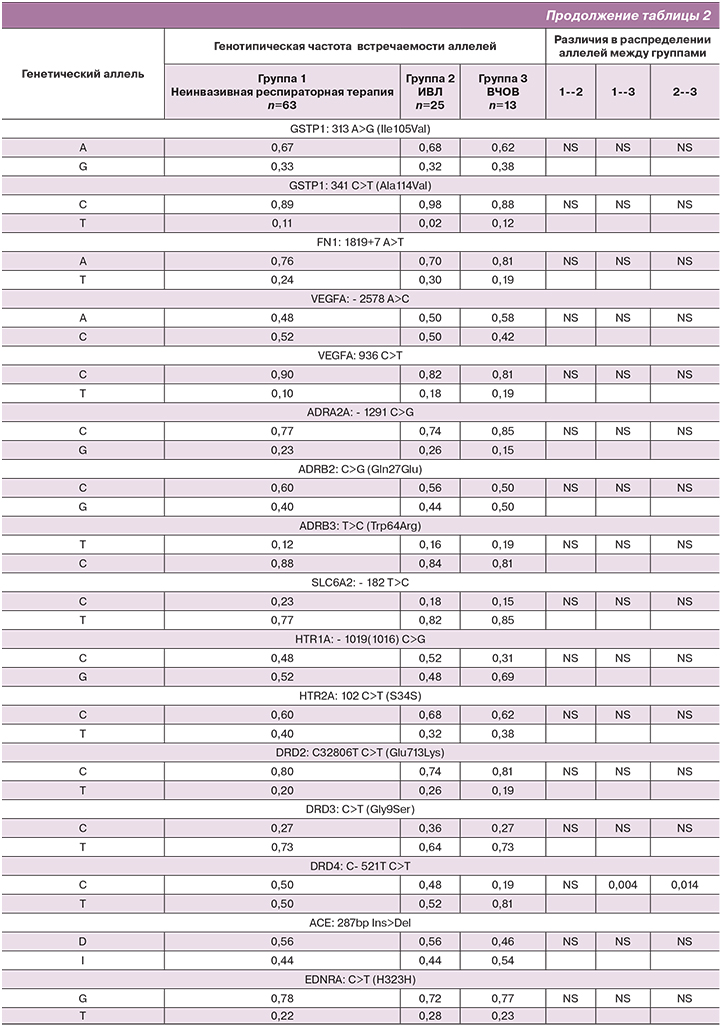
Распределение аллелей исследуемых полиморфных локусов в I и II группах не различались. Поэтому мы сочли возможным объединить группы I и II. Таким образом, изучение влияния полиморфизма генов проводилось между двумя группами пациентов: I группа – объединенная, включала в себя 88 детей на неинвазивной респираторной терапии и на традиционной ИВЛ, II группа включала 13 детей на ВЧОВ. Характеристика групп сравнения представлена в таблице 3.
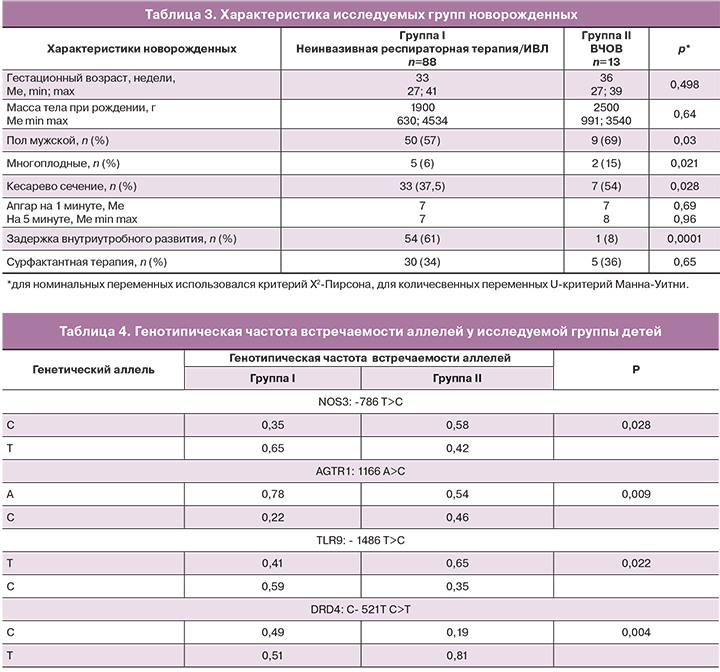
В результате проведенного исследования удалось выявить статистически достоверные ассоциации между полиморфизмом генов NOS3 (синтез эндогенного оксида азота), AGTR1 (рецептор ангиотензинпревращающего фермента), TLR9 (толл-подобный рецептор 9 – мембранный белок, входящий в группу толл-подобных рецепторов, обеспечивающих функционирование врожденного иммунитета) и DRD4 (кодирует подтип D4 рецептора допамина) и тяжелым течением заболевания, выражавшимся в потребности в «жестких» режимах ИВЛ и переводе на ВЧОВ у детей с врожденной пневмонией, что отражено в таблице 4.
 При сравнении частоты распределения аллелей полиморфного локуса гена NOS3: -786 T>C получена статистически значимая ассоциация аллеля С с тяжелой степенью дыхательных нарушений и потребностью в «жестких» режимах ИВЛ у пациентов с врожденной пневмонией (р=0,028) (рис. 1).
При сравнении частоты распределения аллелей полиморфного локуса гена NOS3: -786 T>C получена статистически значимая ассоциация аллеля С с тяжелой степенью дыхательных нарушений и потребностью в «жестких» режимах ИВЛ у пациентов с врожденной пневмонией (р=0,028) (рис. 1).
Распределение аллелей полиморфного локуса AGTR1: 1166 A>C статистически значимо различалось между группами (р=0,009). Согласно аутосомно-рецессивной модели, генотип С/С ассоциирован с потребностью в в «жестких» режимах ИВЛ у детей с врожденной пневмонией. (ОШ=19,1 (3,1-119,3), р=5×10-5) (рис. 2).
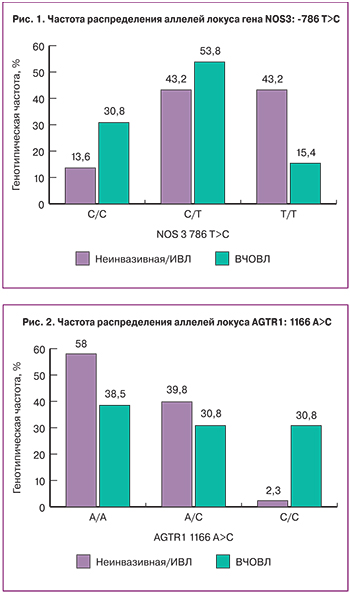
При сравнении распределения аллелей полиморфного локуса TLR9: 1486T>C получена статистически значимая ассоциация аллеля С с тяжелым течением врожденной пневмонии и потребностью в проведении ВЧОВ (р=0,022), однако при анализе распределения генотипов получены погранично значимые результаты (рис. 3), что не позволило однозначно определить модель наследования данного признака.
Полиморфизм гена DRD4: 521C>T также продемонстрировал значимую ассоциацию с тяжелым течением врожденной пневмонии (р=0,04 для распределения аллелей и р=0,01 для генотипов C/T и Т/Т), что косвенно может подтверждать роль системы дофамина в патогенезе тяжести заболевания (рис. 4).
Обсуждение
Тяжесть течения врожденной пневмонии и ее основных клинических проявлений – дыхательных нарушений, требющих проведения соответствующей респираторной терапии, обусловлена множеством факторов. Современная теория этиопатогенеза дыхательных нарушений при врожденной пневмонии включает в себя положения о многофакторности и полигенности этой патологии, а также сложные взаимодействия, как генетически обусловленных, так и экзогенных факторов в процессе развития заболевания.
Оксид азота (NO) является модулятором апоптоза и воспалительного каскада, влияющего на эндотелиальную проницаемость; он синтезируется с помощью синтазы оксида азота (NOS) из L-аргинина. У человека они представлены тремя изоформами белка: нейрональная NOS (nNOS), кодируемая геном NOS1, индуцируемая NOS (iNOS), кодируемая геном NOS2 и эндотелиальная NOS (eNOS), кодируемая геном NOS3, экспрессируемая, преимущественно, в эпителии дыхательных путей. NO медиирует множество физиологических функций, включая нейротрансмиссию, иммунорегуляцию, ангиогенез, антиагрегантную активность и созревание поверхностно-активных веществ. Многочисленность вариантов физиологических функций, строгий контроль выработки NO имеют решающее значение для его избирательных действий. В проведенном нами исследовании удалось выявить ассоциацию аллеля С полиморфного локуса гена NOS3: -786 с тяжелым проявлением дыхательных нарушений и потребностью в проведении ВЧОВ у новорожденных с врожденной пневмонией (р=0,028). NOS3, участвуя в реакциях окислительного стресса и в синтезе NO, оказывающего релаксирующее действие на эндотелий, по-видимому, влияет на эндотелиальную проницаемость, вызывая изменение вентиляционно-перфузионных соотношений, что приводит к потребности в жестких параметрах респираторной терапии. Также нам удалось выявить, что согласно аутосомно-рецессивной модели генотип NOS3: -786 T/T является протективным: соотношение шансов (OR) потребности в проведении ВЧОВ для таких пациентов составляет 0,24 (0,05–1,14), р=0,056.
Активность ангиотензина II определяется его взаимодействием с рецептором AT1. Лиганд-рецепторный комплекс активирует НАДФH-оксидазу, образующую супероксид, который, в свою очередь, взаимодействует с вазорелаксирующим фактором NO. В исследовании Chao Y. et al. было показано, что низкое напряжение кислорода в крови индуцирует образование реактивных форм кислорода через активацию каскада AGTR1/eNOS/NO [6]. Известно, что реактивные формы кислорода образуются в клетке постоянно, однако реализация оксидативного стресса и, как следствие, повреждение липидного слоя клеточных мембран, также может зависеть и от плотности рецепторов AGTR1. В свою очередь, массивное клеточное повреждение при врожденной пневмонии усугубляет тяжесть течения заболевания и обуславливает потребность в более жестких параметрах респираторной терапии.
Toll-подобные рецепторы являются основными рецепторами распознавания чужеродных агентов, связанными с реализацией врожденного иммунитета. Генетические полиморфизмы в генах, кодирующих TLR, были вовлечены в развитие инфекций, злокачественных новообразований и аутоиммунных заболеваний [7]. При исследовании полиморфизма гена TLR9, его ассоциации с хорионамнионитом и вероятностью врожденных инфекций было выявлено, что наличие аллеля варианта T в полиморфном участке rs352140 гена TLR9, продукт которого распознает бактериальную ДНК, связано с увеличением вероятности плацентарного воспаления [8]. При сравнении распределения аллелей полиморфного локуса TLR9: 1486T>C (rs187084) нами была получена статистически значимая ассоциация аллеля С с тяжестью течения пневмонии и потребностью в «жестких» параметрах ИВЛ (р=0,022). TLR9, по-видимому, принимая участие в реализации воспалительного ответа, коррелирует с тяжестью течения врожденной пневмонии.
Ген DRD4 кодирует подтип D4 рецептора допамина. Подтип D4 представляет собой рецептор, связанный с G-белком, который ингибирует аденилатциклазу. Это мишень для лекарств, которые лечат шизофрению и болезнь Паркинсона. Мутации в этом гене связаны с различными поведенческими фенотипами, включая дисфункцию вегетативной нервной системы, расстройство дефицита внимания/гиперактивность и аутизм. В проведенном нами исследовании полиморфизм гена DRD4: 521C>T также продемонстрировал значимую ассоциацию с тяжелым течением врожденной пневмонии (р=0,04 для распределения аллелей и р=0,01 для генотипов C/T и Т/Т), что косвенно может подтверждать роль системы дофамина в формировании тяжести заболевания.
Ограничениями проведенного исследования являются его ретроспективный, обсервационный характер и отсутствие контрольной группы сравнения, что может затруднить экстраполяцию полученных результатов. Также мы исследовали ограниченную популяцию детей (исследовались дети среднеевропейской полосы России и юга Кавказа) и ограниченную панель генов.
Для подтверждения биологического механизма влияния выявленного полиморфизма, необходимо проведение модельных экспериментов с выявлением таргетных белков и анализом путей взаимодействия продуктов измененного гена. Принимая во внимание, что при обработке данных были получены статистически значимые данные, эта тема требует дальнейшего изучения для определения клинической значимости полученных результатов.
Заключение
Таким образом, тяжелое течение врожденной пневмонии у новорожденных, выражающееся в потребности в «жестких» режимах ИВЛ, необходимости проведения ВЧОВ, ассоциировано с полиморфизмом генов NOS3, AGTR1, TLR9 и DRD4. Для подтверждения предиктивности выявленных полиморфизмов и определения их клинической значимости, необходимо проведение модельных экспериментов с выявлением таргетных белков и путей взаимодействия продуктов измененного гена.



