Парвовирус В19 представляет собой одноцепочечный ДНК-вирус, который был открыт в 1975 г. во время рутинного скрининга крови на гепатит В [1]. Клинические проявления парвовирусной инфекции (ПВИ) идентифицированы позже; так, например, как возбудитель инфекционной эритемы определен только в 1983 г. [2]. Основной путь передачи ПВИ – аэрогенный, реже – гемоконтактный (при переливании крови), трансплантации органов, и вертикальный – от матери плоду [3]. Вспышки ПВИ происходят обычно ежегодно, чаще весной (но могут иметь место в любое время года), с более крупными эпидемиями каждые 4–5 лет, и в основном поражают детей в возрасте от 4 до 11 лет [4, 5]. После инфицирования виремия определяется через 4–14 дней и может сохраняться до 20 дней [6]. После перенесенной инфекции сохраняется пожизненный иммунитет, однако в литературе встречаются сообщения о повторных случаях инфицирования [7]. Примерно 50–75% женщин репродуктивного возраста имеют иммунитет к парвовирусу В19 [5, 8], и только около 1–3% беременных женщин инфицируются во время беременности [9], а во время эпидемии эта цифра может достигать 10% [4]. Во время пика виремии (предположительно, 7-й день после инфицирования), риск вертикальной передачи максимальный и может достигать 25% [10].
Ниже представлены основные клинические формы ПВИ:
- бессимптомное течение: до 50% небеременных женщин и до 70% инфицированных беременных женщин не имеют клинических проявлений ПВИ [8];
- инфекционная эритема («пятая болезнь»). Наиболее часто данный клинический вариант ПВИ наблюдается у детей 4–10 лет. Появлению экзантемы на щеках предшествуют гриппоподобные симптомы – лихорадка, головная боль, насморк, тошнота. Примерно через 1 неделю сыпь может распространиться на конечности и туловище. Взрослые чаще всего не имеют обширной сыпи на туловище. Появление сыпи обычно совпадает с появлением в крови антител IgM к парвовирусу В19 [11];
- артропатии. Наиболее распространенный клинический вариант ПВИ среди взрослых. Клинически проявляется симметричными полиартритами мелких суставов кистей рук, реже поражаются более крупные суставы [12];
- анемия и транзиторный апластический криз. Парвовирус B19 имеет сродство к клеткам кроветворной системы (миелопоэз), в большей степени к клеткам предшественникам эритроидного ряда, которые имеют на своей поверхности Р-антиген, благодаря которому парвовирус В19 проникает внутрь клетки. Р-антиген также обнаружен на поверхности клеток эндотелия, трофобласта, печени и миокарда плода [13, 14]. Поражение клеток предшественников эритроидного ряда проявляется снижением уровня гемоглобина; однако у детей и взрослых уровень гемоглобина обычно падает незначительно, так как эритроциты имеют длительный период полураспада – от 2 до 3 месяцев [4]. Поражение клеток – предшественников тромбоцитов приводит к тромбоцитопении;
- миокардит является редким осложнением, приводящим к развитию сердечной недостаточности [15].
Влияние парвовируса В19 на плод
Антенатальное инфицирование парвовирусом В19 может привести к самопроизвольному прерыванию беременности и антенатальной гибели плода; при этом частота самопроизвольного прерывания беременности до 20-й недели составляет 13,0%, а после 20-й недели беременности – 0,5% [4, 16–20]. Неиммунная водянка плода (НИВП) развивается вследствие поражения парвовирусом В19 эритроидного ростка костного мозга, печени (особенно во время печеночной стадии кроветворения), что приводит к развитию тяжелой анемии, гипоксии и сердечной недостаточности [13, 14, 21, 22]. К другой возможной причине развития НИВП относится парвовирусный миокардит, также приводящий к развитию сердечной недостаточности [15, 21]. По данным зарубежных авторов, от 8 до 27% случаев НИВП обусловлены парвовирусом В19 [7].
При ультразвуковом исследовании (УЗИ) определяются типичные симптомы НИВП – асцит, отек мягких тканей плода, плевральный и перикардиальный выпот, а также такие симптомы, как гепатомегалия, многоводие, отек плаценты; по данным допплерометрии диагностируется анемия у плода (максимальная скорость кровотока (МСК) в средней мозговой артерии (СМА) более 1,505 МоМ) [21].
Диагностика парвовирусной инфекции
Рутинный скрининг на ПВИ не проводится (уровень доказательности II-2E), но в случае подозрения на острую ПВИ обследование необходимо начинать с серологического исследования крови беременной [21, 23]. Так, антитела IgM к парвовирусу В19 обычно определяются в сыворотке женщины через 10–12 дней после инфицирования и могут сохраняться до 6 месяцев, а антитела IgG определяются через несколько дней после появления IgM и в дальнейшем определяются в крови в течение всей жизни [3]. Однако, возможно и отсутствие IgM в крови беременной женщины после инфицирования уже через 6–12 недель (за счет быстрого клиренса антител), что может привести к ложноотрицательным результатам [4]. Учитывая все сказанное выше, при выявлении НИВП обязательным является обследование плода на инфекционные агенты путем определения ДНК вируса в амниотической жидкости или пуповинной крови методом полимеразной цепной реакции (ПЦР) с определением количества ДНК копий/мл [24]. Вследствие незрелости иммунной системы у плода, исследование специфических антител к парвовирусу В19 не является диагностически значимым тестом [21].
Тактика ведения беременности при инфицировании парвовирусом В19
Для ранней диагностики возможных осложнений Общество медицины матери и плода (Society for Maternal Fetal Medicine) (2014) рекомендует проводить динамический ультразвуковой контроль за состоянием плода 1 раз в 1–2 недели в течение 12 недель при выявлении в сыворотке беременной женщины антител IgM к парвовирусу В19 [25].
К сожалению, нет рандомизированных исследований по тактике ведения беременности при НИВП и анемии у плода вследствие ПВИ. По данным Fairley C.K. и соавт. [26], при проведении внутриутробной гемотрансфузии частота антенатальной гибели плода в 7 раз ниже по сравнению с выжидательной тактикой. Данная тенденция прослеживается и у других исследователей. Так, анализ 1436 случаев анемии у плода вследствие ПВИ показал, что выживаемость на фоне проведенной внутриутробной гемотрансфузии составляет 82% против 55% без проведения данной процедуры [27].
Дискутабельным является вопрос о необходимости применения противовирусных препаратов и иммуноглобулинов при внутриутробном инфицировании. Некоторые авторы сообщают о снижении количества ДНК вируса (копий/мл) у плода после парентерального введения иммуноглобулина и отмечают более низкий уровень клинических проявлений инфекции после рождения. Так, по данным авторов, только 1 из 31 новорожденного имел клинические проявления инфекции после введения иммуноглобулина, тогда как без его применения клинические проявления инфекции имели 7 новорожденных из 14 [28]. Японские исследователи Matsuda H. и соавт. [28] делятся своим клиническим наблюдением, в ходе которого вводили иммуноглобулин в абдоминальную полость инфицированного парвовирусом В19 плода из расчета 2,0 г на кг предположительной массы тела плода. Иммуноглобулин вводился дважды – на 21-й и 22-й неделях беременности, после чего отмечено снижение количества ДНК вируса – с 106 копий/мл до 104 копий/мл. Исход данной беременности был благоприятным – на 38-й неделе беременности родился живой доношенный мальчик массой 2308 г с оценкой по шкале Апгар 8/9 баллов без клинических проявлений инфекции. В данном клиническом наблюдении авторы вводили специфический иммуноглобулин (B19 IgG-rich high titer gammaglobulin), однако на территории Российской Федерации данный иммуноглобулин не зарегистрирован. По данным Смирнова А.В. и соавт. [29], иммуноглобулин Октагам активен в отношении ряда вирусов, одним из которых является парвовирус В19.
Клиническое наблюдение
Пациентка Д., 31 год, в октябре 2018 г. обратилась на перинатальный консилиум ФГБУ НМИЦ АГП им. В.И. Кулакова в связи с диагностированными по месту жительства в 27 недель беременности врожденным пороком сердца (дефект межжелудочковой перегородки, гипертрофия миокарда) и НИВП (подкожный отек, гидроперикард, выраженный асцит). При проведении УЗИ плода в ФГБУ НМИЦ АГП им. В.И. Кулакова установлено: один живой плод, размеры которого соответствовали сроку беременности 28 недель 1 день; НИВП: выраженный асцит, отек туловища, кожи головы и конечностей, гидроперикард; укорочение трубчатых костей плода (размеры соответствовали 24 неделям беременности) и значительное увеличение окружности живота (соответствовала 41-й неделе беременности). Проведена эхокардиография (ЭХО-КГ) плода, обнаружена кардиомегалия (размеры соответствовали 36-й неделе 5 дням), симметричная гипертрофия миокарда обоих желудочков, трикуспидальная регургитация (4+), диффузный гидроперикард. Кардиоторакальный индекс (КТИ) составлял 63%.
Акушерский анамнез:
- 1-я беременность в 2014 г. закончилась путем операции кесарева сечения (КС) в 42 недели в связи с безуспешностью индукции родов при переношенной беременности; родилась девочка массой 3930 г, длиной 54 см. Оценка по шкале Апгар 8/9 баллов, девочка здорова (Рязань);
- 2-я беременность в 2016 г. – неразвивающаяся беременность в 8–9 недель; произведена вакуум-аспирация полости матки, осложнившаяся гипотоническим кровотечением (трансфузия свежезамороженной плазмы, гемоглобин 70–80 г/л), Рязань;
- 3-я беременность в 2018 г. – данная, наступила самопроизвольно.
Течение данной беременности:
- I триместр: с ранних сроков протекала на фоне угрозы выкидыша. Дважды стационарное лечение по месту жительства в связи с угрожающим выкидышем. Пренатальный скрининг I триместра в пределах нормы;
- II триместр: в 20 недель по УЗИ выявлена киста плаценты. В 26–27 недель беременная перенесла ОРВИ с подъемом температуры, по назначению терапевта принимала амоксициллина клавуланат 625 мг 3 раза в день 5 дней.
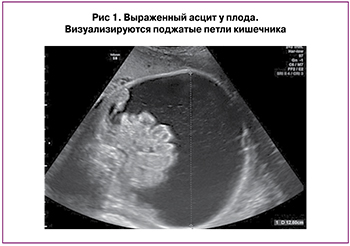 Была госпитализирована в ФГБУ НМИЦ АГП им. В.И. Кулакова, где проведено полное клинико-лабораторное обследование женщины согласно приказу Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)». При серологическом исследовании сыворотки женщины антител IgM к возбудителям TORCH-инфекций не обнаружено. Учитывая выраженный асцит (окружность живота соответствовала 41 неделе – более 100 процентиля), показатели КТИ (63%), данные о компрессии сердца у плода, было решено провести диагностический и лечебный лапароцентез. Проведен диагностический амниоцентез, получено 80 мл светлых околоплодных вод, направленных на микробиологическое, вирусологическое исследование и на исследование кариотипа плода. Затем под ультразвуковой навигацией проведена декомпрессия брюшной полости – медленно эвакуировано 160 мл насыщенно желтой асцитической жидкости (рис. 1). По результатам пренатального молекулярного кариотипирования на ДНК-микроматрицах – у плода нормальный мужской кариотип (arr(1-22)x2,(XY)x1). Вирусологическое исследование околоплодных вод и асцитической жидкости методом ПЦР выявило ДНК парвовируса В19 и ДНК цитомегаловируса (табл. 1), в связи с чем женщине назначена противовирусная терапия Ацикловиром по 500 мг 3 раза в день и неспецифическая иммуноглобулинотерапия (Октагам). В связи с явлениями декомпенсации сердечной деятельности у плода назначена трансплацентарная кардиотоническая терапия дигоксином под контролем его концентрации в крови. Проведена профилактика респираторного дистресс-синдрома плода дексаметазоном в курсовой дозе 24 мг.
Была госпитализирована в ФГБУ НМИЦ АГП им. В.И. Кулакова, где проведено полное клинико-лабораторное обследование женщины согласно приказу Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)». При серологическом исследовании сыворотки женщины антител IgM к возбудителям TORCH-инфекций не обнаружено. Учитывая выраженный асцит (окружность живота соответствовала 41 неделе – более 100 процентиля), показатели КТИ (63%), данные о компрессии сердца у плода, было решено провести диагностический и лечебный лапароцентез. Проведен диагностический амниоцентез, получено 80 мл светлых околоплодных вод, направленных на микробиологическое, вирусологическое исследование и на исследование кариотипа плода. Затем под ультразвуковой навигацией проведена декомпрессия брюшной полости – медленно эвакуировано 160 мл насыщенно желтой асцитической жидкости (рис. 1). По результатам пренатального молекулярного кариотипирования на ДНК-микроматрицах – у плода нормальный мужской кариотип (arr(1-22)x2,(XY)x1). Вирусологическое исследование околоплодных вод и асцитической жидкости методом ПЦР выявило ДНК парвовируса В19 и ДНК цитомегаловируса (табл. 1), в связи с чем женщине назначена противовирусная терапия Ацикловиром по 500 мг 3 раза в день и неспецифическая иммуноглобулинотерапия (Октагам). В связи с явлениями декомпенсации сердечной деятельности у плода назначена трансплацентарная кардиотоническая терапия дигоксином под контролем его концентрации в крови. Проведена профилактика респираторного дистресс-синдрома плода дексаметазоном в курсовой дозе 24 мг.
В сроке беременности 29 недель по данным допплерометрии у плода диагностирована анемия тяжелой степени – МСК в СМА 64,5 см/с, что соответствовало 1,808 МоМ. Проведен трансабдоминальный амниоцентез, кордоцентез, для анализа получено 2,0 мл пуповинной крови. Определена группа крови – А (II), резус-фактор – положительный, проба Кумбса (отрицательная проба), гемоглобин – 90 г/л, гематокрит – 30% (нормальное значение гематокрита для данного срока беременности 40%). Материал также отправлен на микробиологическое и вирусологическое исследования. С целью коррекции у плода тяжелой анемии инфекционного генеза проведено внутриутробное переливание донорских эритроцитов плоду (0(I) отр.) в объеме 40 мл. Для оценки эффективности коррекции анемии, после процедуры внутриутробного переливания, проведена допплерометрия – МСК в СМА составила 45 см/с, что соответствует анемии легкой степени. В связи с тем, что причиной НИВП и анемии плода являлся парвовирус В19, коллегиально было решено в вену пуповины ввести иммуноглобулин (Октагам). Расчет объема донорских эритроцитов производился по формуле [30]:
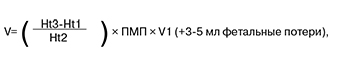
где V – необходимый объем трансфузии; Ht1 –предоперационный гематокрит плода; Ht2 –гематокрит донорской крови; Ht3 – нормальный уровень гематокрита для данного гестационного возраста; ПМП – предполагаемая масса плода; V1 – объем циркулирующей крови плода для данного срока.
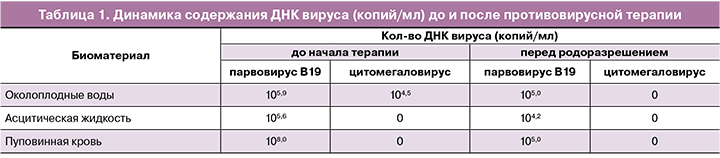
Дозу иммуноглобулина рассчитывали, исходя из массы тела – 1,0 мл на кг массы тела плода. В пуповинной крови обнаружена ДНК парвовируса В19 108 копий/мл, ДНК цитомегаловируса не обнаружена (табл. 1).
В сроке беременности 32 недели 1 день по УЗИ обнаружено: макроцефалия (окружность головы соответствует 35 неделе). Подозрение на врожденный порок центральной нервной системы (ЦНС) – нарушение формирования коры головного мозга, в связи с чем проведена магнитно-резонансная томография (МРТ) плода для уточнения диагноза. По данным МРТ обнаружено расширение наружных ликворных пространств головного мозга, краниомегалия, однако убедительных данных за порок головного мозга на момент исследования не получено. Для уточнения формирования структур головного мозга была рекомендована МРТ в постнатальном периоде.
В дальнейшем, в течение 8 недель 2 дней проводилось динамическое наблюдение за беременной под контролем клинико-лабораторных данных. Еженедельно проводили экспертное УЗИ и ЭХО-КГ плода, отмечен регресс клинических проявлений НИВП (по УЗИ сохранился только выраженный асцит у плода), а также улучшение морфофункциональных характеристик сердца. Так, при последнем антенатальном ЭХО-КГ плода при сроке беременности 36 недель 1 день диагностирована умеренная кардиомегалия, симметричная гипертрофия миокарда обоих желудочков, недостаточность трикуспидального клапана с регургитацией 1+, кардиоторакальный индекс 54%.
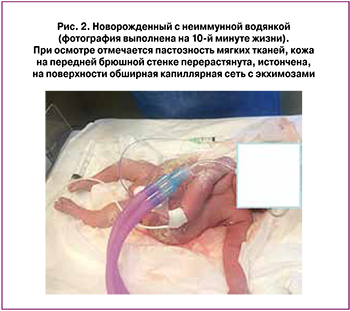 Учитывая доношенный срок беременности (37 недель 2 дня), значительный внутриутробный регресс клинических проявлений НИВП, от дальнейшего пролонгирования беременности было решено отказаться. Ввиду наличия рубца на матке после предыдущего КС, большой окружности живота плода за счет выраженного асцита (по данным УЗИ объем асцитической жидкости около 1000 мл) оптимальным методом родоразрешения являлось КС. Для бережного извлечения плода на первом этапе в операционной проведен трансабдоминальный амниоцентез, лапароцентез, эвакуация асцитической жидкости у плода – медленно эвакуировано 1200,0 мл насыщенно желтой асцитической жидкости. Околоплодные воды, асцитическая жидкость, пуповинная кровь отправлены на вирусологическое исследование методом ПЦР. На втором этапе проведено плановое КС без технических особенностей. Родился живой доношенный мальчик массой 3186 г, длиной 51 см. Оценка по шкале Апгар 5/7 баллов. При осмотре отмечается пастозность мягких тканей, кожа на передней брюшной стенке перерастянута, истончена, на поверхности обширная капиллярная сеть с экхимозами (рис. 2). УЗИ в раннем неонатальном периоде выявило незначительное количество жидкости в перикардиальной полости (5 мм) и свободную жидкость во всех отделах брюшной полости. При вирусологическом исследовании методом ПЦР на 2-е сутки жизни в крови ребенка обнаружена ДНК парвовируса В19 105,1 копий/мл, ДНК цитомегаловируса не выявлена ни в одном биологическом материале (кровь, моча, буккальный соскоб). Перед выпиской на 32-е сутки жизни в крови ребенка уровень ДНК парвовируса В19 составил 103,2 копий/мл (в динамике со снижением). По данным нейросонографии, структуры головного мозга расположены правильно, дифференцированы, зрелость соответствует возрасту.
Учитывая доношенный срок беременности (37 недель 2 дня), значительный внутриутробный регресс клинических проявлений НИВП, от дальнейшего пролонгирования беременности было решено отказаться. Ввиду наличия рубца на матке после предыдущего КС, большой окружности живота плода за счет выраженного асцита (по данным УЗИ объем асцитической жидкости около 1000 мл) оптимальным методом родоразрешения являлось КС. Для бережного извлечения плода на первом этапе в операционной проведен трансабдоминальный амниоцентез, лапароцентез, эвакуация асцитической жидкости у плода – медленно эвакуировано 1200,0 мл насыщенно желтой асцитической жидкости. Околоплодные воды, асцитическая жидкость, пуповинная кровь отправлены на вирусологическое исследование методом ПЦР. На втором этапе проведено плановое КС без технических особенностей. Родился живой доношенный мальчик массой 3186 г, длиной 51 см. Оценка по шкале Апгар 5/7 баллов. При осмотре отмечается пастозность мягких тканей, кожа на передней брюшной стенке перерастянута, истончена, на поверхности обширная капиллярная сеть с экхимозами (рис. 2). УЗИ в раннем неонатальном периоде выявило незначительное количество жидкости в перикардиальной полости (5 мм) и свободную жидкость во всех отделах брюшной полости. При вирусологическом исследовании методом ПЦР на 2-е сутки жизни в крови ребенка обнаружена ДНК парвовируса В19 105,1 копий/мл, ДНК цитомегаловируса не выявлена ни в одном биологическом материале (кровь, моча, буккальный соскоб). Перед выпиской на 32-е сутки жизни в крови ребенка уровень ДНК парвовируса В19 составил 103,2 копий/мл (в динамике со снижением). По данным нейросонографии, структуры головного мозга расположены правильно, дифференцированы, зрелость соответствует возрасту.
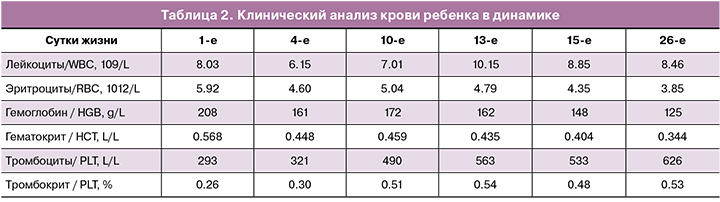
Клинический анализ крови ребенка в динамике представлен в табл. 2.
Ребенок выписан на 33-и сутки жизни с незначительным количеством свободной жидкости в брюшной полости.
Обсуждение
Данное клиническое наблюдение демонстрирует возможности фетальной терапии и хирургии. Своевременное выявление причины и возможность ее патогенетической коррекции являются определяющими в дальнейшей тактике ведения беременности.
Применение комплексного этиопатогенетического и симптоматического подходо привело к регрессу клинических проявлений НИВП, купированию внутриутробной тяжелой анемии, уменьшению явлений недостаточности кровообращения плода и снижению количества ДНК вирусов, что позволило пролонгировать беременность до доношенного срока. Этиопатогенетический подход к терапии (иммуноглобулинотерапия, внутриутробное переливание донорских эритроцитов плоду (0(I) отр.) позволил прервать патогенетический механизм формирования НИВП (парвовирус В19 → тяжелая анемия → увеличение проницаемости капилляров → вторичная сердечная недостаточность). А применение симптоматического подхода (кардиотоническая терапия, лапароцентез и эвакуация содержимого брюшной полости) позволило улучшить функциональные возможности сердца.
Выраженное снижение количества ДНК парвовируса В19 на фоне введения иммуноглобулина плоду отмечено в пуповинной крови – с 108 копий/мл до 105 копий/мл (табл. 1). По данным литературы, эффект от внутриутробного переливания донорских эритроцитов плоду (0(I) отр.) может сохраняться до 1–5 недель после процедуры [31]. В нашем клиническом наблюдении потребности в повторных внутриутробных переливаниях донорских эритроцитов плоду не было, в неонатальном периоде показатели крови были в пределах референсных значений. Данное явление, возможно, было связано с тем, что этиотропная терапия была начата своевременно: в острую фазу инфицирования иммуноглобулин вводился непосредственно плоду. Постнатально наблюдались лишь остаточные проявления заболевания, клинико-лабораторных данных за острую инфекцию не получено.
Важным признаком, характеризующим тяжесть внутриутробной сердечной недостаточности, является недостаточность трикуспидального клапана [32]. В данном клиническом наблюдении, на фоне комплексного внутриутробного лечения, отмечено улучшение морфофункциональных характеристик сердца – по данным ЭХО-КГ уменьшились КТИ (с 63 до 54%) и выраженность трикуспидальной регургитации (с 4+ до 1+).
Таким образом, данное клиническое наблюдение показывает, что НИВП – не всегда фатальный диагноз, и возможен регресс клинических проявлений уже внутриутробно на фоне комплексного антенатального лечения.
Заключение
Проблема НИВП сложна и многогранна. Данное клиническое наблюдение наглядно демонстрирует целесообразность комплексного подхода к обследованию женщин с НИВП с целью выяснения ее причины. Как показывает опыт ФГБУ НМИЦ АГП им. В.И. Кулакова, не всегда диагноз НИВП является фатальным для плода и новорожденного. Проведение подобных исследований позволит разработать тактику ведения пациенток с данной патологией плода и определить когорту пациенток, перспективных для фетальной терапии и хирургических вмешательств.



