Неиммунная водянка плода (НИВП) является сложной полиэтиологической патологией, в основе которой лежат более 150 различных причин развития данного состояния [1]. Клинически НИВП проявляется избыточным скоплением жидкости в двух и более серозных полостях (брюшная полость, плевральная полость, перикардиальная полость) и тканях плода, при отсутствии циркулирующих антител к антигенам мембраны эритроцитов [2]. Многоводие (максимальный вертикальный карман более 80 мм) и плацентомегалия (толщина плаценты 4 см и более во II триместре или 6 см и более в III триместре) часто сопутствует НИВП [3]. Основные патогенетические механизмы данного состояния описаны S.S. Im и соавт. еще в 1984 г. [4].
Пренатальная ультразвуковая диагностика (УЗИ) водянки плода не вызывает трудностей, но при этом выявление этиологии НИВП является сложной диагностической задачей.
Некоторые исследователи показали влияние этиологии на срок манифестации НИВП и ее исходы. Так, согласно данным крупномасштабных зарубежных исследователей, наиболее часто НИВП вызывают анеуплоидии, которые имеют тенденцию к раннему клиническому проявлению – в среднем на 18-й неделе (диапазон 11–31 неделя) и ассоциированы с неблагоприятными исходами [5]. Отечественными исследователями хорошо изучена НИВП вследствие фетальных нарушений ритма. Так, наиболее часто к НИВП приводит наджелудочковая тахикардия. При этом выявлено, что чем раньше манифестирует наджелудочковая тахикардия, тем более тяжелой формой водянки она сопровождается. Так, на 22–29 неделе чаще (в 8 из 11 случаев) встречались тяжелые формы водянки плода, свидетельствующие о развитии клинически значимой сердечной недостаточности (гидроторакс, асцит, анасарка), тогда как в 30–39 недель подобные формы отека плода были зафиксированы только в 2 из 6 случаев [6, 7].
При выборе тактики ведения беременности с НИВП именно этиология определяет возможность и перспективность проведения внутриутробного лечения. Так, согласно данным Канадского общества акушеров-гинекологов (SOGC), в случае нормального кариотипа плода, срока беременности более 18 недель возможно и перспективно проведение фетальной терапии и/или хирургических вмешательств [8]. Вид внутриутробных вмешательств определяется этиологией и клиническими проявлениями неиммунной водянки плода:
- этиопатогенетическая терапия: антиаритмическая терапия, внутриутробное переливание отмытых донорских эритроцитов, альбумина, противовирусная терапия, иммуноглобулинотерапия, антибиотикотерапия, лазерная интерстициальная коагуляция сосудов;
- симптоматическая терапия: амниоредукция, торакоцентез, лапароцентез, торако-амниотическое шунтирование, введение сердечных гликозидов, кортикостероидов.
Материалы и методы
В исследование включены 80 беременных женщин с НИВП, обратившихся в НМИЦ АГиП им. В.И. Кулакова с января 2015 по март 2019 г. Критерием включения в исследование являлось наличие жидкости в двух и более серозных полостях плода или в одной полости в сочетании с отеком мягких тканей.
Всем пациенткам было проведено экспертное УЗИ плода на аппарате VOLUSON E8 GE. При проведении УЗИ плода оценивались следующие параметры: наличие и вид структурной патологии плода, количество серозных полостей с выпотом, объем выпота, наличие и степень гипоплазии легких, компрессии сердца, наличие, толщина и распространенность отека мягких тканей плода, а также количество околоплодных вод и толщина плаценты. Допплерометрически измерялась максимальная скорость кровотока (МСК) в средней мозговой артерии (СМА) плода, усиление которого больше 1,505 МоМ являлось признаком внутриутробной анемии. После 20–22 недели проводилась эхокардиография (ЭхоКГ) плода на аппарате VOLUSON S8 с целью определения структурной или функциональной патологии сердца, клапанов и магистральных сосудов, наличия выпота в полости перикарда и его объем, а также ряд параметров, оценивающих функциональное состояние сердца плода.
В части случаев было проведено кариотипирование, обследование на внутриутробные инфекции, клинический и биохимический анализ выпотной жидкости. Постнатально, по показаниям, проводили обследование на наследственные болезни обмена веществ у новорожденного.
Молекулярно-генетическое кариотипирование проводили на ДНК-микроматрицах высокого разрешения (Cytoscan 750К, Affymetrix). ДНК выделяли из свежей цельной крови или амниотической жидкости с помощью набора PureLink Genomic DNA Kit (Invitrogen, США). Количество и качество полученной ДНК оценивали с помощью спектрофотометра Implen (Германия). Пробоподготовку образцов ДНК (рестрикция, лигирование с адапторами, амплификация, очистка продуктов полимеразной цепной реакции, фрагментирование, мечение флуорофором) производили в соответствии с протоколом производителя микрочипов компании Аффиметрикс (Affymerix Inc., США). После прохождения образцами всех контролей качества, требуемых производителем, полученные образцы наносили на микрочипы Cytoscan 750К, после чего проводили ДНК-гибридизацию в течение 18 ч при температуре 50°. После гибридизации проводили промывку, окрашивание микрочипов на приборе Fluidic Station 450 (Affymerix Inc., США) и сканирование их с помощью Scanner 3000 7G (Affymerix Inc., США). Результаты проанализировали в программе ChromosomeAnalysisSuite (ChAS) и оценивали с учетом рекомендаций Американского колледжа медицинской генетики [9]. Согласно рекомендациям, обнаруженные вариации числа копий ДНК (copy number variation – CNV) интерпретировали как патогенные, с неопределенной клинической значимостью или доброкачественные.
Взятие биологического материала (амниотическая жидкость, выпот, пуповинная кровь) для обследования на внутриутробные инфекции (парвовирус В19, цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса 1, 2, 6, 8 типов, токсоплазма и Listeria monocytogenes) осуществляли в ходе инвазивной процедуры. Осаждение клеток из 1 мл амниотической жидкости или выпота из серозных полостей проводили путем центрифугирования при 13 000G в течение 10 минут. Полученные клетки ресуспендировали в 100 мкл физиологического раствора. Пуповинную кровь для исследования брали в количестве 100 мкл. Выделение ДНК из образцов клинического материала проводили при помощи набора ПРОБА-ЦИТО (ООО НПО «ДНК-Технология», Россия) согласно инструкции. Сущность метода заключалась в щелочном высокотемпературном лизисе клеток, что обеспечивало максимальную чувствительность диагностики, так как эффективность выделения ДНК из клинического материала приближается к максимально возможной, а потери минимизированы. Амплификацию специфических фрагментов ДНК инфекционных агентов проводили с помощью коммерческих комплектов реагентов ООО НПО «ДНК-Технология», Россия в режиме «реального времени» на приборе «ДТ-964» (ООО НПО «ДНК-Технология», Россия). Измерение уровня флуоресценции проводили на каждом цикле амплификации по каналам FAM, HEX, ROX и Cy5. Обработку результатов осуществляли автоматически, с помощью программного обеспечения к прибору.
При проведении хирургических вмешательств (лапароцентез, торакоцентез) производили забор выпотной жидкости с последующим ее клиническим и биохимическим анализом. Оценивали уровни общего белка, альбумина, лимфоцитов и триглицеридов для определения характера и источника выпотной жидкости. Выпот считается хилезным при выявлении уровня лимфоцитов более 80% и триглицеридов более 1,1 ммоль/л.
Постнатальное обследование на наследственные болезни обмена веществ проводили методом тандемной масс-спектрометрии. Показаниями для его проведения являлись случаи идиопатической НИВП или клинико-лабораторные проявления, характерные для заболеваний этой группы.
В зависимости от полученных результатов все случаи были распределены в одну из 14 категорий заболевания, предложенных C.Bellini и соавт. [10]. Полученные нами данные были сопоставлены с данными зарубежных крупномасштабных исследований [10–12]. Основные выявленные нами нозологии, распределенные по категориям, представлены в табл. 1.

Результаты и обсуждение
Проведен ретроспективный анализ всех случаев НИВП с января 2015 по март 2019 г.
Этиология была выявлена в 82,5% (66/80) случаях. Анализ структуры причин показал, что наиболее часто к развитию НИВП приводили: хромосомные аномалии – 20,0% (16/80), сердечно-сосудистая патология – 18,75% (15/80), инфекции – 8,75% (7/80). Синдромальная патология, торакальные аномалии и опухоли экстраторакальной локализации встречались с одинаковой частотой – 7,5% (6/80). В нашем исследовании не проводили пренатальный поиск заболеваний обмена веществ у плода, в связи с этим в данной категории нет ни одного случая. При обследовании новорожденных в раннем неонатальном периоде наследственных болезней обмена также не выявлено. Как идиопатические были расценены 17,5% (14/80) случаев НИВП.
Все случаи, отнесенные к категории хромосомных аномалий, были подтверждены определением кариотипа плода или новорожденного. Изначально показаниями для кариотипирования были только ультразвуковые маркеры хромосомных аномалий у плода, в последующем, с 2018 г., данное исследование проводили во всех случаях НИВП.
Известно, что анеуплоидии могут приводить к формированию структурной патологии плода, которые являются причиной развития НИВП. В таком случае дискутабельным является вопрос распределения по категориям. Например, трисомия 21 хромосомы может приводить к формированию структурной патологии сердца, с которой и связан патогенез развития НИВП. В нашем исследовании все случаи с подтвержденной анеуплоидией, вне зависимости от наличия порока развития, отнесены к категории хромосомных аномалий, так как именно она является первопричиной.
Из категории сердечно-сосудистой патологии наиболее часто к развитию НИВП приводили тахиаритмии – 33,3% (5/15), в остальных случаях – 66,7% (10/15) в основе лежала структурная патология сердца, выявленная по данным ЭхоКГ.
К категории синдромальной патологии были отнесены случаи множественных пороков развития плода, а также случаи с характерной фенотипической картиной по заключению врача генетика.
Случаи НИВП инфекционного генеза были подтверждены лабораторными методами – обнаружением возбудителя в биологическом материале плода (околоплодные воды, пуповинная кровь, выпотная жидкость), крови новорожденного или абортивном материале. При этом 57% (4/7) случаев НИВП инфекционного генеза осложнились развитием внутриутробной анемии (МСК в СМА выше 1,5 МоМ). Внутриутробные анемии (из категории гематологических заболеваний), не ассоциированные с инфекционными агентами, выявлены только у 2,5% (2/80).
Все остальные случаи НИВП были распределены по категориям в зависимости от выявленного порока развития, среди которых наиболее часто встречались крестцово-копчиковая тератома – 66,7% (4/6), лимфангиомы – 33,3% (2/6), диафрагмальная грыжа – 33,3% (2/6), кистозно-аденоматозный порок развития легкого – 50% (3/6).
На следующем этапе данные нашего исследования были сопоставлены с данными крупномасштабных зарубежных исследований (табл. 2), При этом было установлено, что структура причин НИВП, выявленная в нашем исследовании, сопоставима с данными зарубежных авторов и имеет аналогичную тенденцию – наиболее часто в основе НИВП лежат анеуплоидии и патология сердечно-сосудистой системы. В исследовании Bellini C. и соавт. [10] ведущей причиной является сердечно-сосудистая патология – 20,1% (269/1338), тогда как у Laterre M. и соавт. [12] –анеуплоидии – 32,4% (33/102). Это связано с тем, что Bellini C. и соавт. распределяли случаи по выявленному пороку, вне зависимости от кариотипа, тогда как Laterre M. и соавт. ориентировались на кариотип (как на первопричину).
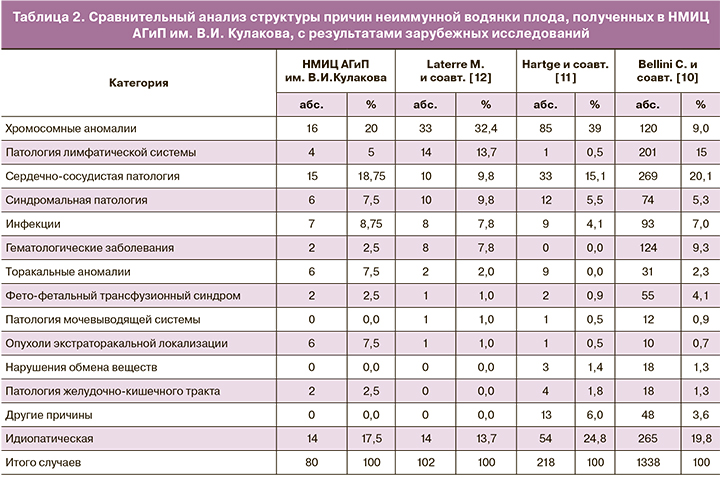
Слабой стороной нашего исследования являлось отсутствие проведения пренатальной инвазивной диагностики всем беременным с НИВП с целью определения кариотипа и обнаружения инфекционно-воспалительных факторов и заболеваний обмена веществ у плода, что вошло в алгоритм обследования в последний год исследования. Проведение данных исследований показало бы более точную структуру причин и, возможно, снизило бы количество случаев из идиопатической категории.
Данное исследование показывает, что проблема НИВП остается открытой и нерешенной и требует более тщательного и разностороннего подхода. Отсутствие алгоритмов диагностики и тактики ведения беременности с НИВП в нашей стране существенным образом влияет на перинатальные исходы при данной патологии.
Заключение
Проведенное исследование подтверждает, что НИВП является полиэтиологической патологией. Полученная нами структура причин согласуется с мировыми данными – наиболее часто к развитию неиммунной водянки плода приводят хромосомные аномалии и патология сердечно-сосудистой системы.
Детальное исследование причин НИВП на пренатальном этапе позволит выделить категорию пациентов, перспективных для проведения антенатальной терапии и фетальных хирургических вмешательств.
Пристальное внимание к проблеме этиологии НИВП связано с тем, что именно она является определяющей при выборе тактики ведения беременности, возможности и перспективности внутриутробного лечения.



