Эндометриоз (ЭМ) – заболевание, характеризующееся гетеротопией ткани, морфологически и функционально подобной слизистой оболочке тела матки, за пределами ее обычного расположения [1]. Классификация ЭМ основывается на его клинико-морфологических особенностях и подробно приведена в клинических рекомендациях по ЭМ Л.В. Адамян с соавт. [2].
В структуре гинекологической заболеваемости ЭМ занимает 3-е место после воспалительных заболеваний органов малого таза и миомы матки, поражая до 50% женщин с сохраненной менструальной функцией [3, 4]. По данным различных авторов, частота заболеваемости ЭМ составляет от 10 до 50% в популяции [3–5]. Его распространенность варьирует в зависимости от изучаемой популяции: 5–10% женщин репродуктивного возраста, 20–30% бесплодных женщин и 40–60% женщин с дисменореей [6]. Частота бесплодия у больных с ЭМ колеблется от 12 до 50% [3, 7].
Реже ЭМ диагностируется у женщин в постменопаузе. В настоящее время многие клиницисты отмечают, что эндометриоидные поражения встречаются в любом возрасте независимо от этнической принадлежности и социально-экономических условий [3].
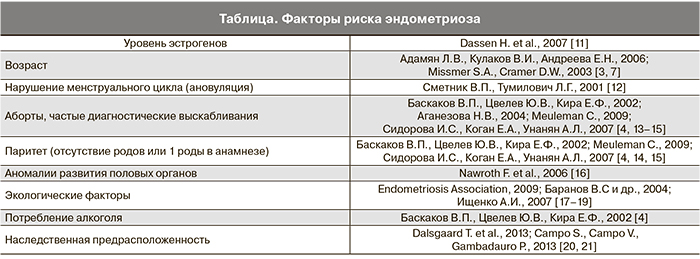
Понятие «глубокий инфильтрирующий ЭМ» является клинико-морфологическим и относится к очагам ЭМ, прорастающим в глубину 5 мм и более от поверхности пораженной серозной оболочки кишечника и мочевого пузыря, а также ректовагинальной связки [8]. Для глубокого инфильтративного ЭМ характерно мультифокальное поражение органов брюшной полости. ЭМ кишечника в популяции составляет от 5 до 12% всех больных ЭМ [9]. В 90% случаев глубокий инфильтративный ЭМ кишечника локализуется в прямой и сигмовидной кишке [10]. Этиология ЭМ неизвестна, однако имеются указания на множество факторов риска (таблица).
Одной из главных задач в исследовании ЭМ является понимание механизмов, ведущих к имплантации очагов вне матки и последующее прогрессирование заболевания.
Современные концепции патогенеза эндометриоза
Несмотря на множество существующих в настоящее время теорий патогенеза, ни одна из них не является ведущей и не может полностью объяснить клинические проявления ЭМ [2, 3, 22]. Также невозможно определить прогностические критерии прогрессирования ЭМ, степень активности процесса.
В механизмах патогенеза ЭМ рассматривают участие генетических и эпигенетических (метилирование ДНК, ацетилирование гистонов и негистоновых ДНК-связывающих белков, а также микроРНК механизмов).
Не утратили своего научного значения и ранее выдвинутые теории патогенеза ЭМ: эмбриональная, имплантационная, метапластическая.
Эмбриональная или дизонтогенетическая теория привлекает внимание в связи с увеличением частоты ЭМ в молодом возрасте. Сущность эмбриональной теории заключается в том, что ЭМ развивается из смещенных участков зародышевого материала, из которых в процессе эмбриогенеза формируются половые органы женщин, в частности эндометрий, и ЭМ развивается из остатков мюллеровых протоков. Доказательствами развития ЭМ из очагов эмбриональной ткани являются: 1) обнаружение клинически активного ЭМ в молодом возрасте, начиная с 11–12 лет, то есть в первые годы после начала менструаций; 2) сочетание ЭМ с аномалиямим развития половых органов, органов мочевыводящей системы и желудочно-кишечного тракта; 3) патоморфологические исследования плодов человека и животных подтверждают возможность эмбрионального происхождения ЭМ.
С точки зрения современных представлений о развитии тканей из стволовых клеток по-новому следует понимать эмбриональную теорию. Фактически речь может идти о тканевых или костномозговых стволовых клетках как источниках развития ЭМ [23]. В последнее время предполагается развитие ЭМ из небольшой популяции клеток, находящихся в эндометрии, обладающих свойствами стволовых клеток [24]. Эти клетки отвечают за пролиферацию и циклическую регенерацию эндометриоидной ткани после менструации. Согласно этой гипотезе, ЭМ может быть результатом миграции эндометриальных стволовых клеток в брюшную полость, их пролиферации, перитонеальной инвазии и дифференциации в клетки эндометрия в эктопических очагах.
Имплантационная теория Сэмпсона объясняет возникновение очагов ЭМ прямой имплантацией клеток эндометрия, попавших на новое место путем ретроградного тока менструальной крови. Е.А Коган и соавт. установили снижение апоптоза в ткани эндометрия женщин с ЭМ, что может способствовать имплантации клеток на брюшине в полости малого таза и базальном слое эндометрия [1]. Данная теория объясняет наиболее частую локализацию эндометриоидных очагов в области таза и тазовых органов. С ее помощью можно объяснить появление ЭМ в местах абдоминальных или эпизиотомных разрезов и рубцов. Но данная теория не получила подтверждения [25].
Ретроградный заброс менструальной крови через маточные трубы во время менструация является достаточно частым явлением и встречается у 90% менструирующих женщин. Существует гипотеза, что у 6–10% женщин с ЭМ эндометриальные стволовые/прогениторные клетки достигают брюшной полости во время менструации, где они имплантируются, пролиферируют и становятся эндометриоидными имплантами. У женщин с большим количеством менструаций (например, если возраст материнства наступает после 35–38 лет) риск ретроградной менструации выше. Более того, если пациентка имеет какую-либо генетическую предрасположенность к недостаточной местной иммунной реакции, эндометриальные клетки могут избегать иммунного ответа, имплантироваться по брюшине в разные органы и давать начало новым очагам ЭМ.
Наличие и/или рецидив ЭМ с точки зрения стволовых клеток может быть обусловлен активностью последних. Так, показано, что эндометриальные стволовые клетки способны преодолевать сопротивление местного иммунитета и имплантироваться в новые места, где формируется очаг эктопического эндометрия [24].
По мнению некоторых исследователей, эндометриоидные клетки обладают настолько мощным агрессивным потенциалом, что вызывают повреждения иммунной системы, и наблюдаемые изменения общего и локального иммунитета носят вторичный характер, являясь следствием этой агрессии [3, 26]. К настоящему времени получены данные, свидетельствующие, что существуют особые механизмы, позволяющие эндометриальным клеткам женщин с ЭМ избегать иммунного надзора. К этим механизмам относят изменение антигенных свойств железистых и стромальных клеток эндометрия [27]; изменение экспрессии разных классов белков теплового шока [28].
Теория диссеминации эндометриоидных клеток по кровеносным и лимфатическим сосудам Хальбана [4, 21] позволяет объяснить возникновение отдаленных очагов ЭМ, например, в таких местах, как лимфатические узлы, плевральная полость, легкие и почки.
Метапластическая теория Мейера [29] предполагает, что полипотентные клетки брюшной полости могут подвергаться целомической метаплазии и при определенных условиях способны превращаться в функциональную эндометриальную ткань.
Ни одна из приведенных концепций не объясняет комплекс ключевых событий в развитии ЭМ – имплантацию и превращение эндометриальной клетки в эндометриоидную гетеротопию. По-видимому, этот процесс невозможен без ряда условий, комбинация которых может бесконечно варьировать. Определенную роль играют гормональный дисбаланс (гиперэстрогения) [30], нарушения общего и местного иммунитета, генетическая предрасположенность, влияние неблагоприятной экологии, нарушения в системах протеолиза, ангиогенеза и метаболизма железа, воспаление, апоптоз, механическая травма.
Показано, что у женщин с ЭМ снижается апоптоз в ткани эндометрия, наблюдается снижение тканевых барьеров брюшины, увеличивается прооксидантная способность макрофагов, что способствует повреждению тканей [31]. Матриксные металлопротеиназы (ММР) обладают способностью разрушать любые компоненты внеклеточного матрикса. В норме MMP продуцируются в соединительных тканях и предположительно участвуют в ремоделировании ткани в процессах развития и репарации при повреждении тканей в период менструального цикла. Лейкоциты, большей частью макрофаги, являются основным источником MMP, что способствует экстравазации и проникновению их в ткани. Кроме того, метастазирующие опухолевые клетки могут использовать MMP для облегчения миграции в удаленные ткани.
Большую роль в развитии ЭМ отводят повышенной способности эндометриальных клеток у этих больных к пролиферации и инвазии [32]. Для уточнения механизмов повышенной инвазивности эндометриальных клеток особый интерес имеет определение характера экспрессии интегриновых молекул и ММР в эндометрии при ЭМ.
Резюмируя все описанные теории патогенеза ЭМ, можно предположить, что в результате генетических и эпигенетических перестроек стволовых клеток и/или прогениторных клеток с потенцией к эндометриоидной дифференцировке возникают новые тканевые компартменты не только на территории репродуктивной системы, но и за ее пределами.
Генетические механизмы патогенеза эндометриоза. Семейное наследование ЭМ выявляется у людей и человекообразных приматов. Более высокая частота ЭМ встречается среди родственников больных ЭМ. Относительный риск рецидива у братьев и сестер, чьи сестры и братья поражены, в сравнении с риском населения в целом возрастает в 2,3 раза в Австралии на примере близнецов и их семей. Трудно оценить риск рецидива, потому что среди населения распространенность неизвестна, в основном количество случаев ЭМ определяется при хирургическом вмешательстве [33].
Основные подтверждения существованию генетического фактора при ЭМ связаны с исследованием близнецов в исландской популяции. У монозиготных близнецов выявлена большая частота развития ЭМ по сравнению с дизиготными близнецами на основании исследования более 3000 австралийских близнецов. То же исследование показало, что генетические факторы способствуют риску ЭМ с оценкой вероятности, наследуемости до 51%.
Исследование родословной более 1800 резус макак из Университета Висконсия-Мэдисон показало наличие семейного наследования ЭМ при высоком среднем коэффициенте родства среди пострадавших макак по сравнению с непострадавшими [33]. Имеются данные о нарушении работы генов, принимающих участие в процессах детоксикации при ЭМ, которые оказывают влияние на метаболизм эстрогенов. Обнаружены полиморфизмы гена глутатион S – трансферазы M1 (GSTM1), локализованного на хромосоме 1p13.3, и гена глутатион S – трансферазы тета 1 (GSTT1), локализованного на хромосоме 22q11.23 [34]. Существует ряд доказательств повышенного риска развития ЭМ, связанных с вариантами в обоих ферментах. С другой стороны, в проведенном метаанализе не было получено никаких доказательств связи между полиморфизмом гена ацетилирования гистонов NAT2 и ЭМ [35].
Проведено полногеномное исследование, показавшее более 1000 обнаруженных генов при ЭМ. Наиболее значимый результат (Р=3,09×10–7) получен для гена rs2286276, локализованного на хромосоме 7, в зоне интрона гена tbl2 [36]. Резюмируя роль генетических механизмов патогенеза, следует отметить, что в патогенезе ЭМ несомненна роль генетических факторов.
Эпигенетические механизмы патогенеза играют важную роль в развитии ЭМ. Один из важных способов регуляции генов – регуляция через ремоделирование хроматина. Динамические изменения в структуре хроматина оказывают влияние на экспрессию генов и зависят от эпигенетических воздействий, включающих miRNA, метилирование генов и ацетилирование гистоновых и негистоновых ДНК-связывающих белков. У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a, DNMT3b) [33]. Модификации гистонов происходят с помощью деацетилазы (HDACs), ацетилазы (HATs), метилтрансферазы (HMTs) и метил-CpG-связывающего белка MeCP2.
Первое исследование по аномальному метилированию генов hMLH1, p16 и PTEN при ЭМ было опубликовано в 2002 г. в контексте возможной злокачественной трансформации ЭМ. Первое доказательство, что ЭМ может быть эпигенетическим заболеванием, следует из исследования, опубликованного в 2005 г., в котором предполагаемый промотер HOXA10 в эндометрии у женщин с ЭМ гиперметилирован по сравнению с женщинами без ЭМ [37]. HOXA10 является представителем семейства гомеобоксных генов, которые служат факторами транскрипции в процессе развития и играют важную роль в функциональном состоянии матки. Экспрессия HOXA10 в эндометрии человека и его количество резко возрастает в середине секреторной фазы менструального цикла, что соответствует времени имплантации и увеличению циркулирующего прогестерона. Это предполагает, что HOXA10 может иметь важную функцию в регулирования развития эндометрия во время менструального цикла и в создании условий, необходимых для имплантации. В эндометрии женщин с ЭМ экспрессия гена HOXA10 значительно уменьшается, что указывает на некоторые дефекты рецептивности матки, которые могут быть ответственны за снижение фертильности у женщин с ЭМ [38].
Доказано, что снижение экспрессии HOXA10 обусловлено гиперметилированием его промотера. При индуцированном ЭМ у бабуинов и мышей экспрессия HOXA10 снижена [33].
Существует исследование, демонстрирующее гиперметилирование промотера PR-B при ЭМ, которое сопровождается пониженной экспрессией PR-B, что может объяснить устойчивость очагов ЭМ к прогестерону. Подавление генов-мишеней прогестерона путем метилирования является эпигенетическим механизмом, который опосредует устойчивость прогестерона. Относительно постоянный характер метилирования может объяснить неэффективность лечения эндометриоз-зависимого бесплодия [33].
Стероидогенный фактор-1 (SF-1), фактор транскрипции, важный для активации множества генов, участвующих в биосинтезе эстрогена, как правило, не обнаруживается в стромальных клетках нормального эндометрия, но аберрантно экспрессируется в стромальных клетках очагов ЭМ за счет гипометилирования его промотера [39]. Они также обнаружили, что ERβ-промотер гипометилирован в эндометриоидных клетках, на долю которых приходится его избыточная экспрессия [33].
Важным эпигенетическим механизмом регулирования функции генов является ацетилирование гистонов, данные о котором при ЭМ немногочисленны. Munro и соавт. сообщают о глобальных уровнях ацетилирования гистонов H2AK5, H3K9, H4K8 и H3K14/18. Их уровень возрастает в раннюю пролиферативную фазу и снижается к овуляции [40]. Эти данные позволяют предположить, что модификация гистонов происходит при трансформации эндометрия, а их аберрации могут участвовать в развитии ЭМ и патологических процессов в эндометрии.
Другой эпигенетический механизм патогенеза ЭМ связан с miRNA. Было установлено, что miRNA участвуют в регуляции процессов метилирования и ацетилирования. Наряду с метилированием ДНК или модификацией гистонов miRNA также регулируют экспрессию генов без каких-либо изменений в последовательности ДНК, за счет либо ингибирования трансляции мРНК или, реже, вызывая деградацию мРНК.
В последние годы наблюдается возрастающий интерес к роли miRNA в функциональном состоянии эндометрия [33].
Pan и соавт. идентифицировали 65 из 287 изученных типов miRNA в нормальном эндометрии, эутопичном и эктопичном эндометрии у женщин с ЭМ [41]. В этой же группе также выявлена обратная корреляция между экспрессией miR-23a, miR-23b, and miR542-3p и экспрессией генов ароматазы и циклооксигеназы (COX)-2. Показано, что экспрессия этих генов miRNA дифференциально регулируется эстрогеном, медроксипрогестерон ацетатом, ICI-182780 и RU-486, или их соответствующими комбинациями, в эндометрии стромальных и железистых эпителиальных клеток. Эти данные показывают, что miRNA принимают участие в генной регуляции функцирования эндометрия. Kuokkanen и соавт. нашли обратную связь между экспрессией определенных типов miRNA и подавлением их предполагаемых генов-мишеней, которые участвуют в клеточном цикле [42]. Таким образом, они смогли показать, что miRNA может посттранскрипционно подавлять экспрессию генов клеточного цикла, тем самым подавляя прогрессию клеточного цикла и клеточную пролиферацию в секреторной фазе эндометриального эпителия. Их результаты также показывают, что действие прогестерона противопоставляется действию эстрогена путем экспрессии генов, участвующих в функции эндометрия.
В настоящее время актуален поиск маркеров для ранней диагностики ЭМ. В этой связи перспективны исследования по изучению роли miRNA в развитии заболеваний, в частности ЭМ. В некоторых исследованиях отмечается важная роль miRNA при ЭМ [43]. Таким образом, циркулирующие miRNA могут быть важными неинвазивными биомаркерами для выявления и классификации тяжелых и умеренных случаев ЭМ. Ряд исследователей изучали miRNA в перитонеальной жидкости [44].
Морфологическая характеристика эндометриоза
До сих пор нет единой клинико-морфологической классификации ЭМ. Cуществует несколько классификаций ЭМ таких авторов, как Wicks, Larsonet и соавт.(1949), Ph. Koninckx (1994), M. Nisolle и соавт. (1997), I. Brosens и соавт. (2000). Многочисленные исследования указывают на особенности морфологической структуры различных локализаций ЭМ. Инфильтрация эндометриодных очагов приводит к деструкции тканей и сопровождается разрастанием эпителиального и стромального компонентов. Соотношение железистого эпителия и стромы в очагах ЭМ различной локализации неодинаково. Достоверно установлено, что в гетеротопиях, развивающихся в миометрии (аденомиоз) и ректовагинальной перегородке, преобладает стромальный компонент. В то же время не отмечено определенной закономерности соотношения эпителиальной и стромальной составляющих при ЭМ яичников, брюшины, связочного аппарата матки.
Состав и количество стромы имеют определенное значение для циклических изменений эпителия в очагах ЭМ. Пролиферация эпителия невозможна без стромальной составляющей. Именно в строме содержится программа эпителиальной цитодифференцировки и функциональной активности тканей. Достаточное количество стромы с преобладанием фибробластов и многочисленными сосудами способствует циклической перестройке железистого эпителия в эндометриоидных гетеротопиях. Очаги ЭМ без признаков функциональной активности (уплощенный атрофичный эпителий) характеризуются незначительной васкуляризацией и содержанием стромального компонента.
Согласно современной гистологической классификации ЭМ различают по активности (активный и неактивный), по состоянию эпителия (только для аденомиоза) [45].
Очаги ЭМ гистологически имеют различную пролиферативную активность, глубину проникновения в ткани, размеры, макроскопически отличаются по цвету – красные, черные, белые. Красные гетеротопии являются высоковаскуляризованными и пролиферирующими, и представляют собой раннюю, активную стадию ЭМ. Черные, пигментированные очаги представляют развернутую стадию заболевания. Белые очаги содержат фибротическую ткань и плохо кровоснабжаются, являясь метаболически неактивными. Белые перитонеальные импланты вызывают меньший болевой синдром, чем черные и красные. Nisolle и соавт. исследовали васкуляризацию и пролиферацию в красных, черных и белых очагах. Был определен самый высокий уровень пролиферативной активности и васкуляризации в красных поражениях и самый низкий уровень пролиферативной активности в белых поражениях [46]. J. Donnez и соавт. сообщили о более высоком уровне фактора роста эндотелия сосудов (VEGF) в красных очагах по сравнению с черными [47]. На основании этих данных, Nisolle и соавт. [48], Келер и Лоренц [49], Brosens [50] полагали, что красные поражения представляют «свежие» имплантанты, в то время как белые очаги соответствуют «спящим» поражениям. На основании этих наблюдений было выдвинуто предположение, что различные цвета поражения также отражают различную активность заболевания [51, 52].
Результаты исследования J.D. Strehl и соавт. противоречат концепции, что различные цвета эндометриоидных очагов отражают различные степени биологической активности, так как она зависит от пролиферативной активности и экспрессии гормональных рецепторов [53]. Данные результатов исследования показывают, что цвет очага при ЭМ связан с длительностью поражения, рисунком и содержанием железы, а не с биологической активностью. Были зафиксированы стабильно высокие уровни экспрессии гормональных рецепторов в очагах ЭМ во все фазы менструального цикла, что может свидетельствовать об эндокринной автономии. В то же время авторы наблюдали существенные различия в пролиферативной активности очагов ЭМ между фазами менструального цикла, предполагая, что эндометриоидные очаги в определенной степени связаны с менструальным циклом [53].
На сегодняшний день существует лишь одно исследование, представляющее доказательство связи между пролиферативной активностью, экспрессией гормональных рецепторов и симптомами перитонеального ЭМ [51].
Выявлены различия и особенности морфологической структуры при аденомиозе, которые позволили выявить две формы течения аденомиоза. Активная и неактивная формы заболевания отражают степень клинической и морфологической активности эндометриоидного процесса. Изучались такие маркеры, как Ki-67, Apo-Cas, PCNA, MMP 1,2,9, TIMP 1,4, Е-кадгерина, CD-34. В очагах активного аденомиоза выявлены высокий уровень пролиферации, низкий апоптоз и повышенная экспрессия ММР, в то время как в неактивных очагах превалировала экспрессия ингибиторов ММР и наблюдался повышенный уровень апоптоза [54].
Изучение иммуногистохимических показателей позволит оценить степень активности инфильтративного ЭМ.
Многие исследователи обнаружили взаимосвязь между активностью цитохрома Р450, полипептида 1 (CYP17A1), рецептора андрогена (AR), рецептора прогестерона (PGR), и рецепторов эстрогена (ESR1 и ESR2) [43, 55]. Экспрессия ароматазы цитохрома Р450 эктопическим и эутопическим эндометрием является, по-видимому, важным звеном патогенеза ЭМ. Дальнейшее изучение особенностей ее экспрессии – новое многообещающее направление в исследованиях патогенеза ЭМ, которое представляет большой интерес для разработки лечебно-диагностической стратегии при этом заболевании как в плане использования ингибиторов ароматазы, так и диагностического теста [56]. Изучение уровня пролиферативной активности – Ki-67, экспрессии активаторов Bak, Bax и ингибиторов апоптоза Bcl-2, Bcl-x в клетках желез и стромы эктопического эндометрия у больных с активной и неактивной формой генитального ЭМ в пролиферативную и секреторную фазы менструального цикла показало преобладание ингибиторов апоптоза над активаторами при активной форме, и преобладание активаторов над ингибиторами при неактивной форме [57].
Резюмируя морфологические и молекулярные особенности очагов ЭМ, можно характеризовать их как эктопические образования с признаками эндометриоидной дифференцировки, обладающие автономным и инвазивным характером роста, что отчасти сближает их с опухолевым процессом и так называемыми хорестомами или эндометриомами.
Таким образом, в настоящее время ЭМ рассматривают как полиэтиологичное мультифакторное заболевание, возникающее вследствие действия факторов окружающей внешней среды, генетической предрасположенности (учитывая семейные случаи заболевания), в результате нарушения эпигенетической регуляции, с участием стволовых клеток. В заключении следует отметить, что перспективными направлениями в изучении природы патогенеза ЭМ является комплексный клинико-морфологический подход с исследованием генетических, эпигенетических и молекулярных механизмов его патогенеза. Особое внимание следует уделить участию стволовой клетки в развитии и прогрессировании ЭМ.



