Задержка роста плода (ЗРП, «intrauterine growth restriction/fetal growth retardation») – это патологическое ограничение генетически запрограммированного роста плода, свидетельствующее о его страдании, не имеющее тенденции к снижению [1–3]. В настоящее время в клинической практике используется хронологическая классификация, основанная на разделении ЗРП на раннюю и позднюю формы [4–6]. Точкой отсечки в настоящее время принят срок гестации 32 недели [1, 7, 8].
Ранняя форма ЗРП (манифестация до 32 недель гестации) составляет 20–30% всех случаев. В основе формирования данной формы лежит нарушение плацентации, а именно неполноценная инвазия трофобласта в миометральный сегмент спиральных артерий, что приводит к увеличению сопротивления в маточных артериях. Возникающая при этом гипоксия требует адаптации кардиоваскулярной системы плода, что проявляется его высокой толерантностью к низким уровням кислорода [9–11]. Перинатальная заболеваемость и смертность при ранней форме ЗРП являются крайне высокими, а главной проблемой является тактика ведения данной группы беременных [12, 13].
Поздняя форма (манифестация после 32 недель гестации) составляет 70–80% всех случаев ЗРП. При данном фенотипе незначительные плацентарные нарушения приводят к гипоксии легкой степени, которая также требует развития компенсаторных механизмов со стороны сердечно-сосудистой системы плода. При этом степень толерантности плода к гипоксии остается низкой, что делает невозможным его длительное пребывание в условиях низких уровней кислорода [14, 15]. Перинатальная заболеваемость и смертность при поздней форме ЗРП остаются низкими, а главной проблемой является диагностика, так как при незначительных плацентарных нарушениях ультразвуковые и допплерометрические показатели остаются в пределах нормативных значений [16, 17].
Отсутствие единой системы диагностических критериев приводит к недостаточной эффективности антенатального выявления ЗРП [1, 2, 4, 18, 19].
Благодаря совершенствованию молекулярно-генетических методов исследования стала возможной оценка эпигенетической регуляции, что представляет большой интерес в связи с возможностью разработки новых диагностических тестов на основании выделения эпигенетических меток в биологических субстратах [6, 10, 12, 14]. Понимание механизмов, лежащих в основе данных процессов, может стать основой для разработки в будущем новых лечебно-диагностических подходов.
Цель исследования: изучить уровень метилирования генов TLR2 и импринтинг-контролирующей области IGF2/H19 в плазме периферической крови при ЗРП.
Материалы и методы
В исследование были включены 118 беременных, которые были разделены на 2 группы: группу 1 составили 58 пациенток c подтвержденным диагнозом ЗРП (24 – с ранней и 34 – с поздней формой), группу 2 – 60 женщин без ЗРП. Исследование было одобрено локальным этическим комитетом, все беременные подписали добровольное информированное согласие.Критериями включения явились: спонтанная одноплодная беременность, отсутствие тяжелых экстрагенитальных заболеваний, миомы матки больших размеров, аномалий и пороков развития плода.
Для исследования уровня метилирования генов в плазме материнской крови был произведен сбор образцов 5 мл периферической венозной крови в пробирки с К3 ЭДТА в качестве антикоагулянта. Образцы ЭДТА-стабилизированной плазмы крови получали после проведения двухэтапного центрифугирования. Хранение образцов проводилось при температуре -80°С. Методика выделения ДНК, бисульфитной конверсии, полимеразной цепной реакции в режиме реального времени для определения полученных продуктов, а также анализа кривых плавления подробно описана в предыдущих исследованиях [6].
Статистический анализ
Для статистического анализа и построения графиков использовались пакеты программ Attestat (Россия), Statistica 10 и OriginPro 8.5 (США). При нормальном распределении (проверка гипотезы осуществлялась с помощью критерия Шапиро–Уилка) результаты были представлены в виде среднего арифметического (М) значения и его стандартного отклонения (SD). В случае если распределение признаков отличалось от нормального, результаты были описаны в виде медианы (Me) и верхней и нижней квартилей (Q1;Q3), при этом определение статистической значимости различий проводилось с помощью непараметрического критерия Манна–Уитни. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Для оценки качества исследования уровня метилирования генов с помощью анализа кривых плавления использовали ROC-анализ с определением численного показателя площади под кривой (AUC) с 95% доверительным интервалом (ДИ) и определением чувствительности и специфичности при пороговом значении. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Результаты и обсуждение
Все беременные, включенные в исследование, были сопоставимы по исходной клинической характеристике, имели отличия по сроку родоразрешения и массо-ростовым показателям новорожденных.
При изучении течения беременности статистически значимых различий в частоте ее осложнений отмечено не было (табл. 1).

Анализ перинатальных исходов (табл. 2) показал более неблагоприятное течение неонатального периода при ЗРП, особенно при ее ранней форме, что нередко было связано с досрочным родоразрешением, сроки которого в группе с ранней формой ЗРП составили 31,1 (28,1;34,7) недели, в группе с поздней формой – 35,9 (35,1;38,1) недели (p<0,001). При ЗРП значимо чаще встречались асфиксия тяжелой степени (n=4; 6,9%; p=0,05), респираторный дистресс-синдром (n=5; 8,6%; p=0,03), врожденная пневмония (n=17; 29,3%; p<0,001), внутрижелудочковые кровоизлияния (n=10; 17,2%; p<0,001).
Различия в патогенетических механизмах формирования и перинатальных исходах ранней и поздней форм ЗРП служат основой для изучения особенностей их эпигенетической регуляции с учетом форм. При анализе литературных данных [6, 8, 11, 12, 17] были выделены гены-кандидаты, уровень метилирования которых был определен в плазме крови беременных, – VEGF, HLAG, TIMP2, GNA12, DAPK3, MMP2, SOCS2, LEP, MEST, RASSF1, TLR2, BMP6, DKK3, CEBPA, DFNA5, CTCF, CDO1, PITX2, CDH1, SEPT9, PTEN, ICR (импринтинг-контролирующая область) IGF2/H19. Статистически значимые различия были установлены в уровнях метилирования генов TLR2 и импринтинг-контролирующей области IGF2/H19. Уровень метилирования гена TLR2 в плазме материнской крови при ранней ЗРП составил 0,01 (0,0;0,45) и был статистически значимо ниже уровня метилирования в группе сравнения – 0,43 (0,05;0,53; p=0,02). Относительный уровень метилирования TLR2 при поздней ЗРП составил 0,39 (0,0;0,55) и значимо не отличался от группы сравнения – 0,43 (0,05;0,53; p=0,87) (рис. 1).
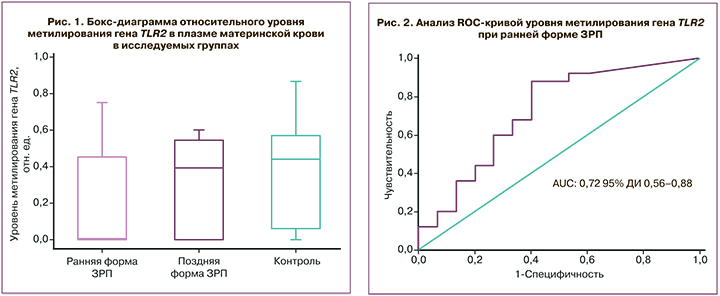
Принимая во внимание полученные данные, с целью изучения диагностической значимости определения уровня метилирования гена TLR2 был проведен ROC-анализ. При ранней форме ЗРП была получена хорошая модель AUC=0,72 (95% ДИ 0,56–0,88), при пороговом значении относительного уровня метилирования гена TLR2 0,012 чувствительность составила 88,1%, а специфичность – 60,2% (рис. 2).
 Исследование показателей метилирования импринтинг-контролирующей области IGF2/H19 показало снижение относительного ее уровня в группе ранней формы ЗРП, которое составило 0,22 (0,18;0,32) и было статистически значимо ниже, чем в группе сравнения – 0,49 (0,44;0,65; p=0,03). Относительный уровень метилирования импринтинг-контролирующей области IGF2/H19 в группе поздней формы ЗРП не выявил статистически значимых различий и составил 0,48 (0,32,0,52; p=0,53) (рис. 3).
Исследование показателей метилирования импринтинг-контролирующей области IGF2/H19 показало снижение относительного ее уровня в группе ранней формы ЗРП, которое составило 0,22 (0,18;0,32) и было статистически значимо ниже, чем в группе сравнения – 0,49 (0,44;0,65; p=0,03). Относительный уровень метилирования импринтинг-контролирующей области IGF2/H19 в группе поздней формы ЗРП не выявил статистически значимых различий и составил 0,48 (0,32,0,52; p=0,53) (рис. 3).
Для оценки значимости определения относительного уровня импринтинг-контролирующей области IGF2/H19 в плазме крови в качестве диагностического теста при ранней форме ЗРП был проведен ROC-анализ, который охарактеризовал полученную модель как хорошую и обосновал перспективность его использования для выявления ранней формы ЗРП с AUC=0,79 (95% ДИ 0,62–0,87). При пороговом значении относительного уровня метилирования импринтинг-контролирующей области IGF2/H19, равном 0,2, чувствительность метода составила 80,4%, специфичность — 80,1% (рис. 4).
В последние годы описан ряд процессов, которые, влияя на регуляцию патогенетических механизмов формирования ЗРП, способствуют снижению прогностической и диагностической ценности ее потенциальных маркеров [1, 4, 9, 13]. Наиболее изученными являются эпигенетические модификации, представляющие собой экспрессию генов за пределами кодирования в последовательности ДНК [6, 11, 16]. Изучение эпигенома, находящегося на стыке между генетическими и внешними факторами, имеет большое значение в расширении знаний не только об основах формирования ЗРП, но и развитии ее отдаленных последствий. Как известно, TLR2 – белок из класса толл-подобных рецепторов, который играет ключевую роль во врожденном иммунитете и патогенезе апоптоза, индуцированного пептидогликаном бактерий [5]. Было показано, что активация TLR2 в клетках трофобласта в I и III триместре приводит к выраженной секреции цитокинов и хемокинов и способна индуцировать усиление апоптоза клеток трофобласта и, соответственно, служить причиной развития осложнений беременности [5, 6, 8, 12]. Нами получены данные о том, что при ЗРП наблюдается снижение уровня метилирования гена TLR2, которое может приводить к усилению экспрессии данного белка и, как следствие, повышенному апоптозу в плаценте. Патологическое усиление процессов апоптоза с ранних сроков беременности может приводить к нарушению формирования плаценты и развитию ЗРП.
В настоящее время внимание исследователей уделяется изучению оси «соматотропный гормон – инсулиноподобный фактор роста 1». При этом большое значение имеют эпигенетические модификации, которые регулируют ее функционирование. IGF1 и -2 являются регуляторными пептидами, которые, находясь в тесной взаимосвязи друг с другом, с ранних сроков беременности участвуют в процессах формирования плаценты и роста плода. IGF1 участвуют в регуляции анаболических, антиоксидантных и противовоспалительных процессов [15]. При этом роль IGF1 преимущественно связана с регуляцией плацентарного транспорта питательных веществ [13, 18, 19], в то время как IGF2 является регуляторным белком процессов пролиферации и дифференцировки и инвазии вневорсинчатого трофобласта в спиральные артерии [6, 8, 11, 15]. Изменения концентрации IGF2 на любом сроке беременности могут вносить существенный вклад в нарушение нормального формирования плаценты и, как следствие, развитие ЗРП. Геномный импринтинг как один из эпигенетических процессов выражается экспрессией одного из двух аллельных генов, расположенных на отцовской или материнской хромосоме. Молекулярной основой такой моноаллельной экспрессии генов является метилирование их регуляторных областей. Одним из наиболее изученных механизмов, лежащих в основе фетального программирования, является метилирование локуса IGF2/H19. Ген IGF2 и расположенная рядом с ним некодирующая РНК H19 находятся на коротком плече хромосомы 11. Полученные нами результаты о снижении уровня метилирования импринтинг-контролирующей области IGF2/H19 при ранней форме ЗРП могут быть причиной соответствующего снижения экспрессии IGF2, что согласуется с результатами других исследований [8, 16, 17]. В исследовании J. St-Pierre et al. [11] была показана отрицательная корреляция между уровнем метилирования IGF2 и массой новорожденных; также есть данные о связи эпигенетических изменений, а именно гипометилирования импринтинг-контролирующей области IGF2/H19 на отцовской аллели хромосомы 11 с развитием наследственных заболеваний, которые характеризуются выраженной задержкой роста в постнатальном периоде. Вышеизложенное обосновывает целесообразность изучения метилирования данных генов для уточнения их роли в развитии ЗРП и возможности выделения новых диагностических и прогностических маркеров.
Заключение
Таким образом, полученные данные подтверждают роль метилирования генов TLR2 и импринтинг-контролирующей области IGF2/H19 в развитии ЗРП, которые могут быть использованы в качестве неинвазивных предикторов и позволяют предположить, что сформированные еще на антенатальном этапе эпигенетические изменения продолжаются в неонатальном периоде и имеют большое значение в реализации фетального программирования.



