Аномальные маточные кровотечения являются показанием для проведения большинства внутриматочных вмешательств как в репродуктивном периоде, так и в менопаузе [1–4]. Согласно многочисленным исследованиям, наиболее распространенными причинами аномальных маточных кровотечений являются полипы эндометрия (ПЭ), гиперплазия эндометрия (ГЭ) и хронический эндометрит (ХЭ) [2, 5, 6]. Для гиперпластических процессов эндометрия, к которым традиционно относят ПЭ и ГЭ, характерна также высокая частота рецидивов, сопряженная с неоднократными внутриматочными вмешательствами, риском повреждения эндометрия, формирования внутриматочных синехий и развития маточных форм бесплодия [1, 3, 5]. Кроме того, ГЭ рассматривается как фактор риска рака эндометрия, частота которого в последние годы не имеет тенденции к снижению.
Несмотря на длительную историю изучения гиперпластических процессов эндометрия, механизмы, лежащие в основе их формирования, остаются неясными. Перспективным направлением в исследовании пролиферативных процессов может стать изучение Wnt-сигнального пути, который является одним из важнейших в регуляции множества физиологических и патологических процессов, включая клеточную дифференцировку, пролиферацию, ангиогенез и малигнизацию [7–10]. Регуляция Wnt-каскада осуществляется посредством ряда ингибиторов, наиболее важным из них считается Wnt Inhibitory Factor 1 (WIF1). Согласно имеющимся данным, при опухолевых заболеваниях, в том числе при раке эндометрия, часто наблюдается «молчание» гена, кодирующего WIF1, что обусловлено его метилированием [8, 9, 11–15].
Метилирование – наиболее распространенная форма эпигенетических модификаций, представляющая собой присоединение метильной группы к цитозину динуклеотидов CpG, расположенных в промоторной области гена, что приводит к супрессии транскрипции ДНК [16]. Полагают, что избыточное метилирование генов-супрессоров опухолевого роста и гипометилирование проонкогенов может приводить к чрезмерной активности процессов ангиогенеза, пролиферации и лежать в основе малигнизации, в том числе в эндометрии [16, 17]. При этом вопрос о возможной роли активации Wnt-пути и метилирования WIF1 в формировании доброкачественных гиперпластических процессов эндометрия остается малоизученным. Несмотря на то что ХЭ не относится к категории пролиферативных заболеваний, имеются данные о взаимосвязи метилирования ряда генов и хронического воспаления [18–20]. Однако работ, посвященных оценке подобной взаимосвязи при воспалительных заболеваниях женской репродуктивной системы, в доступной литературе обнаружено не было.
Целью данного исследования явилось определение статуса метилирования гена WIF1 при различных видах патологии эндометрия.
Материалы и методы
В исследование включены 125 женщин в возрасте от 20 до 50 лет (35,6 (6,9) года): 60 – с гистологически подтвержденным диагнозом ПЭ (35,5 (6,7) года), 25 – с ГЭ (37,4 (8,1) года) и 20 – с ХЭ (35,2 (6,6) года). Группу контроля составили 20 женщин (36,4 (6,1) года) без нарушений менструального цикла, эндометрий которых соответствовал стадии пролиферации (СтП). Критериями исключения служили прием гормонотерапии в течение 3 месяцев, предшествующих оперативному лечению, наличие онкологической и тяжелой экстрагенитальной патологии. Полученные образцы ткани эндометрия были трижды промыты буфером PBS и заморожены при температуре -20°С. Для выявления уровня метилирования гена WIF1 полученные материалы гомогенизировали в гомогенизаторе FastPrep-24 (MP Biomedicals, США) с добавлением матрикса D. Из полученных образцов выделяли ДНК с использованием и по протоколу набора ReliaPrep gDNA Tissue Miniprep System (Promega, США). Концентрацию ДНК определяли флуориметрически с использованием стандартного набора Qubitds DNA HS Assay Kit на флуориметре Qubit 2.0 (Life Technologies, США). Бисульфитная конверсия: 150 нг полученной ДНК подвергали бисульфитной конверсии (переводу неметилированных остатков цитозина в тимин при сохранении метилированных остатков цитозина в неизмененном виде) с использованием набора innu CONVERT Bisulfite Basic Kit (Analytik Jena, Германия). Концентрацию конвертированной ДНК определяли фотометрически в планшете μ-drop (BMG Labtech, Германия) с использованием мультидетектора CLARIO star (BMG Labtech, Германия). Проведение полимеразной цепной реакции (ПЦР): 20 нг бисульфит-конвертированной ДНК отбирали для последующей «тачдаун» ПЦР-амплификации с использованием полимеразной смеси GoTaq Hot Start Green Master Mix (Promega, США) и праймеров, позволяющих амплифицировать участок промотора гена WIF1 от 554 до 140 нуклеотидов до старт-кодона, содержащих, помимо комплементарной последовательности, универсальную последовательность M13 на 5’-конце: WIF1-M13F 5’-gttttcccagtcacgacGAGTGATGTTTTAGGGGTTT-3’ WIF1-M13R 5’-ggaacagctatgaccatgCCTAAATACCAAAAAACCTAC-3’. Секвенирование проводилось по стандартному протоколу с использованием прямых праймеров и набора реактивов ABI PRISM BigDye Terminator v. 3.1. 45. Анализ продуктов реакции проводили на автоматическом секвенаторе Applied Biosystems 3730 DNA Analyzer (Applied Biosystems, США) с использованием универсальных праймеров M13: M13F 5’-GTTTTCCCAGTCACGAC-3’ M13R 5’-GGAAACAGCTATGA.
Статистический анализ
Статистическую обработку данных проводили с помощью программы Statistica 10.0. Для оценки статистической значимости различий частоты выявления метилирования гена WIF1 использовался метод хи-квадрат (χ2) Пирсона. Для количественных признаков (возраст, индекс массы тела (ИМТ)) с помощью критерия Колмогорова–Смирнова было подтверждено нормальное распределение. Значимость различий возраста и ИМТ в группах оценивалась при помощи t-критерия Стьюдента для несвязанных выборок. Данные представлены в виде среднего арифметического со стандартным отклонением M (SD). Для определения статистической значимости различий степени метилирования гена WIF1, числа беременностей, родов и внутриматочных вмешательств в анамнезе использовался непараметрический U-критерий Манна–Уитни. Для оценки зависимостей между показателями использовался коэффициент ранговой корреляции Спирмена (R). При R<0,3 сила связи определялась как слабая, при R от 0,3 до 0,6 – умеренная, при R≥0,7 – высокая. Статистически значимыми считались различия данных при р<0,05.
Результаты
Результаты бисульфитного секвенирования выявили метилирование гена WIF1 в 16 из 20 (80%) образцов эндометрия с признаками ХЭ, в 16 из 25 (72%) – с ГЭ и в 37 из 60 (61,7%) – с ПЭ. Частота метилирования не имела существенных различий между ПЭ и ГЭ (р=0,46), ПЭ и ХЭ (р=0,17), а также ГЭ и ХЭ (р=0,72). Одновременно с этим ни в одном образце эндометрия СтП аномального метилирования WIF1 выявлено не было (рис. 1). Оценка степени метилирования WIF1 проводилась по числу измененных сайтов (от 1 до 24). Число метилированных сайтов в ПЭ варьировало от 1 до 13, в среднем – 4,6 (2,9); при ХЭ – от 1 до 16, в среднем – 5,7 (4,4). Наиболее выраженная степень метилирования наблюдалась при ГЭ – от 1 до 19, в среднем составила 7,3 (5,2), что статистически значимо выше по сравнению с ПЭ (р=0,046). Не отмечено различий между ПЭ и ХЭ (р=0,08), а также ГЭ и ХЭ (р=0,84).

Для выявления возможных факторов риска эпигенетического выключения WIF1 был проведен сравнительный анализ клинико-анамнестических данных пациенток с метилированием гена и его отсутствием (таблица). При эпигенетическом «молчании» гена WIF1 в 1,6 раза чаще в анамнезе отмечались внутриматочные вмешательства (р=0,02). Количество гистероскопий также было больше среди пациенток с метилированием WIF1 (р=0,04).
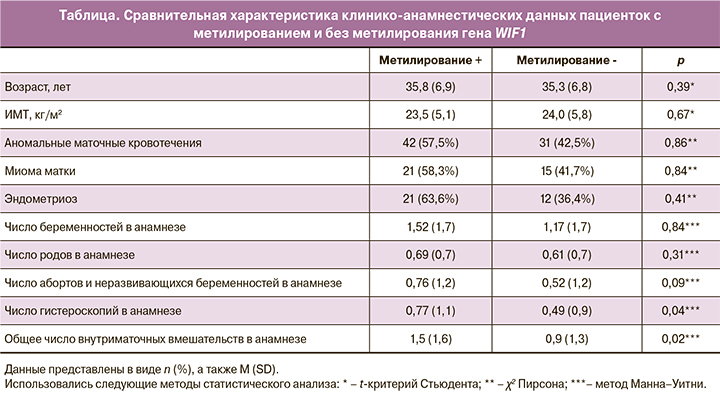
Количество оперативных вмешательств, произведенных по поводу абортов и неразвивающихся беременностей, достоверно не различалось (р=0,09). Выявлена прямая корреляция между количеством внутриматочных вмешательств и числом метилированных сайтов (R=0,197; р=0,03). Других статистически значимых различий по возрасту, ИМТ, паритету, наличию сопутствующей гинекологической патологии выявить не удалось.
 При оценке зависимости статуса метилирования от состояния прилежащего эндометрия оказалось, что 18 ПЭ были выявлены на фоне эндометрия СтП, 6 – на фоне ГЭ и 36 – на фоне ХЭ. При сопутствующем ХЭ в ПЭ наблюдалась тенденция к повышению доли метилированных образцов по сравнению с ПЭ на фоне эндометрия СтП – 72,2% и 55,6% соответственно. Однако статистически значимых различий при этом не отмечено (р=0,45). При ПЭ в сочетании с ГЭ частота метилирования составила 66,7%, что не имело существенных отличий от ПЭ, выявленных на фоне СтП (р=0,69) (рис. 2).
При оценке зависимости статуса метилирования от состояния прилежащего эндометрия оказалось, что 18 ПЭ были выявлены на фоне эндометрия СтП, 6 – на фоне ГЭ и 36 – на фоне ХЭ. При сопутствующем ХЭ в ПЭ наблюдалась тенденция к повышению доли метилированных образцов по сравнению с ПЭ на фоне эндометрия СтП – 72,2% и 55,6% соответственно. Однако статистически значимых различий при этом не отмечено (р=0,45). При ПЭ в сочетании с ГЭ частота метилирования составила 66,7%, что не имело существенных отличий от ПЭ, выявленных на фоне СтП (р=0,69) (рис. 2).
Обсуждение
ГЭ и ПЭ являются наиболее распространенными формами внутриматочной патологии, одной из основных причин аномальных маточных кровотечений и факторами риска развития рака эндометрия. Изучение молекулярно-генетических основ формирования гиперпластических процессов эндометрия продолжает оставаться актуальной проблемой в гинекологии и основой для разработки новых, патогенетически обоснованных подходов к терапии. В литературных источниках имеются лишь единичные работы, посвященные изучению эпигенетических нарушений Wnt-пути при ПЭ. Так, в исследовании Domenico et al. на малочисленной выборке ПЭ (8 образцов) в каждом третьем случае было продемонстрировано метилирование генов группы SFRP – важных супрессоров Wnt-пути [11]. В недавно опубликованной статье Feng et al. приводятся данные о том, что, по сравнению с нормальным эндометрием, в образцах ПЭ наблюдается повышение экспрессии одного из активаторов данного сигнального пути – белка Wnt1. Это, по заключению авторов, свидетельствует об активности Wnt-каскада при ПЭ [21]. Больше информации о роли Wnt-пути в возникновении доброкачественной патологии эндометрии имеется в работах, посвященных ГЭ. В ряде исследований были получены данные о метилировании различных генов-супрессоров Wnt-пути при ГЭ, в частности – SFRP, PRICKLE1, CSNK1E, SKP1, NFATC2 [11, 16, 22]. В одной из экспериментальных работ было показано, что длительная активация Wnt-пути у нокаутных мышей приводит к избыточной экспрессии основного маркера пролиферации – Ki-67 и возникновению ГЭ [23].
Приведенные данные согласуются с полученными нами результатами, которые показали, что в отличие от неизмененного эндометрия при ГЭ и ПЭ в большинстве случаев наблюдается метилирование гена WIF1. Это может быть ассоциировано с избыточной активностью Wnt-каскада и последующей индукцией пролиферативной и ангиогенной активности [7, 8, 10]. Следует отметить, что в образцах ГЭ наблюдалась более высокая степень метилирования гена WIF1 по сравнению с ПЭ и ХЭ. Нельзя исключить, что это может способствовать большей пролиферативной активности и повышению риска прогрессирования неатипической ГЭ в атипическую. Это предположение частично подтверждается данными литературы о том, что при раке эндометрия и атипической ГЭ c достаточно высокой частотой отмечается метилирование гена WIF1 [9–11]. Вследствие этого можно сделать вывод, что метилирование гена WIF1 может играть значимую роль в формировании ГЭ и ПЭ посредством активации Wnt-сигнального пути.
Патогенез гиперпластических процессов эндометрия ассоциирован с нарушением процессов пролиферации и апоптоза, что, как полагают, связано с нарушениями гормональной регуляции эндометрия [5, 23, 24]. Учитывая сведения о том, что чрезмерное воздействие эстрогенов приводит к активации, а гестагенов – к подавлению Wnt-каскада, можно предположить, что дисбаланс рецепторов к половым стероидам может способствовать формированию гиперпластических процессов эндометрия за счет усиления действия эстрогенов и активации Wnt-сигнального пути [10, 21].
ХЭ не относят к категории пролиферативных заболеваний эндометрия, он имеет другую природу происхождения, опосредованную микробным фактором и травматизацией эндометрия. Полученные данные позволяют предположить взаимосвязь гиперпластических процессов эндометрия и ХЭ, опосредованную эпигенетическими нарушениями, приводящими к индукции Wnt-сигнального пути. Известно, что хроническое воспаление и оксидативный стресс являются факторами, предрасполагающими к возникновению онкологических заболеваний. Это, по мнению ряда авторов, может быть связано с метилированием различных генов путем активации фермента ДНК-метилтрансферазы, индуцирующего присоединение метильной группы к CpG-островкам [19, 20]. Аналогичных исследований, посвященных эпигенетическим нарушениям при ХЭ, в доступной литературе нами не найдено. Однако имеются работы, касающиеся патологического метилирования туморосупрессивных генов при воспалительных заболеваниях желудочно-кишечного тракта, в частности, при язвенном колите, пищеводе Барретта, гепатите В и С, панкреатите и гастрите [19, 20]. Воспалительный генез метилирования ДНК был показан в работе японских исследователей на грызунах, у которых инфицирование слизистой желудка бактериями H. pylori приводило к возникновению хронического гастрита и метилированию ДНК. Части грызунов была назначена иммуносупрессивная терапия, способствующая подавлению воспаления и ингибированию метилирования ДНК, даже при сохранении H. pylori, что может свидетельствовать о воспалительном генезе метилирования. Более того, авторы отмечают, что после эрадикации H. pylori метилирование сохранилось и по окончании терапии в связи с персистенцией хронического гастрита [20].
В проведенном нами исследовании было установлено, что у пациенток с метилированием гена WIF1 в анамнезе было больше внутриматочных вмешательств, число которых коррелировало со степенью метилирования. Известно, что внутриматочные вмешательства являются фактором риска развития ХЭ, часто ассоциированного с формированием ПЭ [24, 25]. Роль ХЭ в генезе ПЭ подтверждают данные о высокой экспрессии провоспалительных цитокинов в ПЭ по сравнению с нормальным эндометрием СтП [24, 26], а также достаточно высокая частота формирования ПЭ на фоне ХЭ, которая варьирует от 19 до 61,7% [2, 5, 25, 27]. В литературе имеется ограниченное число данных о возможной взаимосвязи ХЭ и ГЭ. Так, в ряде исследований описано повышение экспрессии COX-2 при ГЭ и раке эндометрия по сравнению с эндометрием СтП [28, 29]. По данным Шешуковой Н.А. и соавт., в образцах ГЭ, сочетающейся с ХЭ, отмечается более высокая экспрессия маркера пролиферации Ki-67 и ростовых факторов, чем при ГЭ без ХЭ. Авторы выдвигают гипотезу о том, что хроническое воспаление путем активации пролиферации и ангиогенеза приводит к развитию гиперпластических процессов эндометрия [30]. На основе полученных нами результатов также можно предположить, что ХЭ является фактором риска развития гиперпластических процессов эндометрия за счет индукции аномального метилирования гена WIF1.
Заключение
Метилирование промоторного участка гена WIF1, выявленное в большинстве образцов ГЭ и ПЭ, при его отсутствии в эндометрии СтП позволяет сделать вывод о роли эпигенетических нарушений в формировании гиперпластических процессов эндометрия. Высокая частота метилирования гена WIF1 при ХЭ может свидетельствовать об участии хронического воспаления в генезе гиперпластических процессов эндометрия. Полученные результаты обосновывают целесообразность применения препаратов, обладающих деметилирующим эффектом, в комплексной терапии указанных заболеваний. Проведение клинических исследований в данном направлении представляется перспективным для подтверждения данной гипотезы, а также для повышения эффективности терапии и вторичной профилактики гиперпластических процессов эндометрия.



