В марте 2020 г. Всемирная организация здравоохранения объявила о пандемии новой вирусной инфекции, вызываемой новым штаммом β-коронавируса, одним из осложнений которой является тяжелый острый респираторный синдром, аналогичный синдрому 2002–2003 гг., вызванному штаммом β-коронавируса SARS-CoV-1 (Severe Acute Respiratory Syndrome Related Coronavirus-1). Новый штамм получил обозначение SARS-CoV-2, а вызываемое им заболевание – COVID-19 (COronaVIrus Disease – 2019). Отсутствие приобретенного иммунитета к новому возбудителю, восприимчивость населения всех возрастов к нему, отсутствие маркеров степени тяжести клинического течения заболевания, а также отсутствие специфической терапии потребовали введения карантинных мероприятий и перепрофилирования ряда существующих стационаров с разделением на чистую («зеленую») и заразную («красную») зоны.
В апреле–июне 2020 г. в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации (далее – Центр) был развернут инфекционный госпиталь на 190 коек для приема больных с диагнозом COVID-19.
Сотрудники «красной» зоны Центра контактировали с больными в специальных средствах индивидуальной защиты, как считается, минимизирующих возможность заражения, и проживали в режиме, минимизирующем возможность внешних контактов. Сотрудники «зеленой» зоны ежедневно соблюдали масочно-перчаточный режим как на рабочем месте, так и в общественных местах. Указанный режим работы продолжался в течение 3 месяцев до прекращения работы инфекционного стационара. По окончании карантина необходимо было подвести итоги, в частности, выяснить, можно ли зарегистрировать признаки формирования специфического противовирусного иммунитета у сотрудников Центра.
Поскольку на сегодняшний день нет общепринятых критериев оценки эффективности формирования памяти врожденного и адаптивного иммунитета к вирусным антигенам, удобных для использования в рутинной клинической практике, то существующие стереотипы в понимании значимости сероконверсии и защитной роли антител в элиминации возбудителя и формировании иммунологической памяти приводят к тому, что главный упор в оценке напряженности иммунитета для вируса SARS-CoV-2 сделан на выявление антител к его наиболее консервативным антигенам.
Целью данной работы явилось определение антител класса IgG к SARS-CoV-2 у сотрудников, работающих в Центре в период объявленных карантинных мероприятий в апреле–июне 2020 г.
Материалы и методы
Было обследовано 1589 сотрудников: 1293 сотрудника «зеленой» зоны и 296 сотрудников «красной» зоны. В исследование были включены сотрудники как медицинских, так и немедицинских специальностей на основании желания быть протестированным на антитела. Информированное согласие было получено от всех протестированных сотрудников.
Забор крови осуществлялся однократно натощак из локтевой вены.
Определение антител к SARS-CoV-2 класса IgG в сыворотке крови осуществлялось наборами реагентов для иммуноферментного определения в сыворотке (плазме) крови «SARS-CoV-2-IgG-ИФА» производства ФГБУ «НМИЦ гематологии» Министерства здравоохранения Российской Федерации. Согласно инструкции компании-производителя, тест предназначен для качественного и полуколичественного определения антител, для интерпретации результата используется индекс позитивности (ИП), который рассчитывается по формуле: ИП = ОП образца/Cut-off, где ОП образца – величина оптической плотности образца. При ИП>1,1 – образец положительный, при ИП <0,9 – образец отрицательный. При значении ИП, лежащем в промежутке от 0,9 до 1,1, результат сомнительный (неопределенный). Образцы с сомнительным результатом были повторно протестированы через 1–2 дня из другой аликвоты крови.
Материал для выявления РНК коронавируса SARS-CoV-2 был получен из ротоглотки с помощью одноразовых зондов. Выделение РНК вируса проводили с использованием комплекта реагентов ПРОБА-НК (ООО «НПО ДНК-Технология», Россия).
Идентификация вируса проводилась с помощью «Набора реагентов для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (РТ-ПЦР) (SARS-CoV-2/SARS-CoV)» (ООО НПО «ДНК-Технология», Россия). В качестве мишеней были выбраны три участка генома: специфичные для коронавируса ЅАRЅ-СоV-2 участки гена N и гена Е, а также консервативный участок гена Е, общий для группы коронавирусов, подобных ЅАRЅ-СоV (включая ЅАRЅ-СоV и ЅАRЅ-СоV-2). Амплификацию проводили на приборе «ДТ-964» (ООО НПО «ДНК-Технология», Россия). Обработка результатов осуществлялась автоматически с помощью программного обеспечения к прибору.
Результаты и обсуждение
В результате проведенного тестирования антитела к SARS-CoV-2 класса IgG были выявлены у 141 сотрудника (8,9%), сомнительный результат был получен у 2; при этом у одного сотрудника были зарегистрированы клинические симптомы острой респираторно-вирусной инфекции (ОРВИ) и положительный результат РТ-ПЦР, у второго – отсутствие клинических симптомов ОРВИ и отрицательный результат РТ-ПЦР.
У 1445 (90,9%) сотрудников антитела к SARS-CoV-2 класса IgG не были выявлены. Среди них у 46 (3,2%) наблюдались клинические симптомы ОРВИ в сочетании с выявлением в соскобах из ротоглотки РНК коронавируса SARS-CoV-2 в РТ-ПЦР.
Среди сотрудников с наличием антител класса IgG у 129 (91,5%) наблюдались клинические симптомы ОРВИ в сочетании с выявлением РНК коронавируса SARS-CoV-2 в РТ-ПЦР; у 23 (17,8%) наблюдались клинические симптомы ОРВИ без выявления РНК коронавируса SARS-CoV-2 в РТ-ПЦР; у 12 (8,5%) отсутствовали клинические симптомы ОРВИ и не выявлялась РНК коронавируса SARS-CoV-2 в РТ-ПЦР (при этом 3 сотрудника имели установленный контакт с заболевшим COVID-19).
При сравнении содержания антител в крови сотрудников «красной» и «зеленой» зон было отмечено следующее: из 1293 протестированных сотрудников «зеленой» зоны перенесли COVID-19 130 (10,1%) человек; из них антитела были выявлены у 127 человек, у 3 сотрудников был получен сомнительный результат; из 269 протестированных сотрудников «красной» зоны перенесли COVID-19 14 (5,2%) человек, что в два раза меньше, чем в «зеленой» зоне, антитела были выявлены у всех переболевших.
Особенностью сероконверсии при инфицировании SARS-CoV-2, как известно из уже опубликованных данных по результатам исследования антител у переболевших COVID-19 в провинции Ухань (КНР), является практически одновременная регистрация в крови антител классов IgM и IgG через 3–5 дней после появления симптомов ОРВИ, динамика нарастания обоих классов антител совпадает практически в течение 3 недель [1], после чего уровень антител класса IgM снижается и регистрируются только антитела класса IgG.
В работе Sethuraman N. et al. [2], опубликованной в июне 2020 г., проанализирована динамика регистрации вируса SARS-CoV-2 в ПЦР и регистрации антител классов IgM и IgG по отношению к проявлению симптомов ОРВИ и показано, что РНК вируса может выявляться за неделю до появления симптомов ОРВИ, а длительность выявления может составлять месяц после манифестации заболевания. Отсутствие РНК вируса в биоматериале совпадает по времени со снижением уровня антител класса IgM. При этом отмечается, что уровень антител не коррелирует с тяжестью заболевания. Есть публикации, в которых отмечается отсутствие выработки антител класса IgМ у некоторых пациентов с COVID-19 [3], однако такой результат может быть связан с низкой чувствительностью использованных тест-систем.
В настоящее время все предлагаемые для рутинной практики ИФА-наборы выявления антител классов IgM и IgG разных производителей – полуколичественные, количественные тесты – невозможны ввиду отсутствия стандартов антител, а также отсутствия возможности рутинной оценки качества осуществления антителами их защитной функции, то есть оценки вируснейтрализующей способности, которая на сегодняшний день может быть оценена только в системе in vitro на культуре клеток, зараженных вирусом. Показано, что уровень антител, обладающих вируснейтрализующей способностью, у некоторых реконвалесцентов очень низкий [4].
Кроме того, сложности и особенности интерпретации напряженности гуморального противовирусного иммунитета, с одной стороны, связаны с пластичностью геномов вирусов, то есть с высокой изменчивостью в результате спонтанных мутаций или в результате гомологичной рекомбинации с геномами родственных видов. Геном циркулирующих в природных резервуарах коронавирусов всегда является мозаичным, а сами коронавирусы существуют в виде квазивидовых пулов. Заражение происходит, как правило, квазивидом – совокупностью геномов гомологичных видов [5].
С другой стороны, в модельных экспериментах открыто явление антителозависимого усиления вирусной инфекции (АЗУИ, или Antibody-Dependent Enhancement=ADE). Этот феномен известен с 1964 г., к настоящему времени он показан для целого ряда семейств вирусов животных и человека, среди которых РНК-содержащие вирусы (Retroviridae, Picornaviridae – возбудители полиомиелита, ринита, гепатита), Orthomyxoviridae (возбудители гриппа А), Ebolavirus, ДНК-содержащие вирусы (Parvoviridae, Epstein-Barr virus, Herpesviridae) [6, 7]. Возможно развитие указанного феномена и для SARS-CoV-2 [8, 9]. Предполагаемые механизмы АЗУИ связаны с взаимодействием комплексов антиген-антитело через Fc-фрагменты иммуноглобулинов со своими рецепторами на клеточной поверхности и с белками системы комплемента (рис. 1).
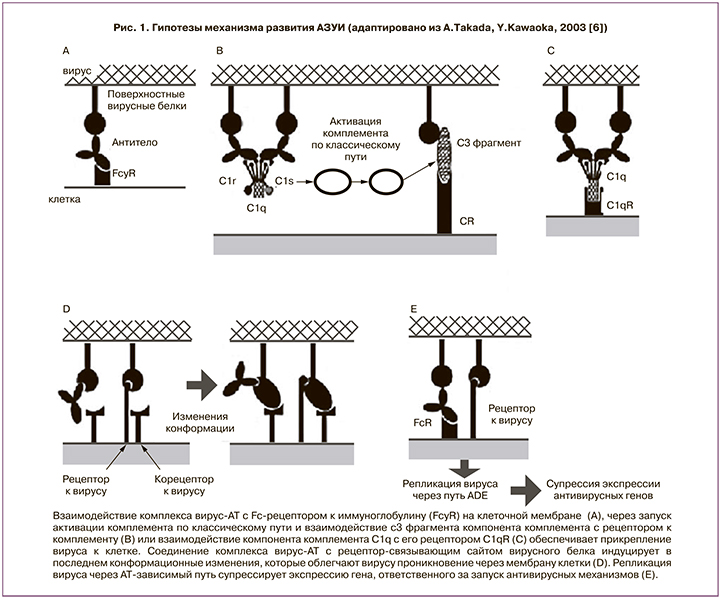
Через Fc-фрагмент осуществляются физиологические эффекты иммуноглобулинов — опсонизация (маркирование патогена), лизис клеток, нагруженных патогеном, дегрануляция тучных клеток, базофилов и эозинофилов. Рецепторы к Fc-фрагменту иммуноглобулина или к обозначенным компонентам комплемента присутствуют на всех иммунокомпетентных клетках, включая Т- и B-лимфоциты, дендритные клетки, натуральные киллеры, макрофаги, нейтрофилы, эозинофилы, базофилы, а также тромбоциты человека, тучные клетки. Считается, что в механизмах АЗУИ задействованы комплексы с низкоаффинной связью антиген-антитело (это могут быть и мультивалентные антитела класса IgM, и естественные антитела). Через Fc-фрагмент иммуноглобулина вирус попадает в клетку, но распад таких низкоаффинных комплексов в клетках не приводит к активации противовирусных метаболических механизмов. Напротив, высвобожденные из таких комплексов вирусные частицы встраиваются в метаболические пути клетки, реплицируются, реактивируются, приводя к гибели клетки-хозяина, высвобождению в межклеточное пространство разнообразных биологически активных соединений, которые в конечном счете обуславливают развитие патологических реакций, приводящих к симптомокомплексу системного воспалительного ответа, характерному для больных с тяжелой степенью COVID-19 (в том числе, «цитокиновому шторму»). Количественная оценка определения таких комплексов в настоящее время в рутинной практике не представляется возможной.
Участие антител в патогенезе усиления тяжести COVID-19 обсуждается в работе [10], в которой сделан обзор иммунологических изменений при вирусных пневмониях, вызванных коронавирусами штаммов SARS-CoV-1, MERS-CoV, SARS-CoV-2, и обобщены результаты лечения пациентов с тяжелой формой дыхательной недостаточности комбинированной терапией иммуноглобулинами для внутривенного введения в высоких дозах в сочетании с терапией низкомолекулярными гепаринами (рис. 2).
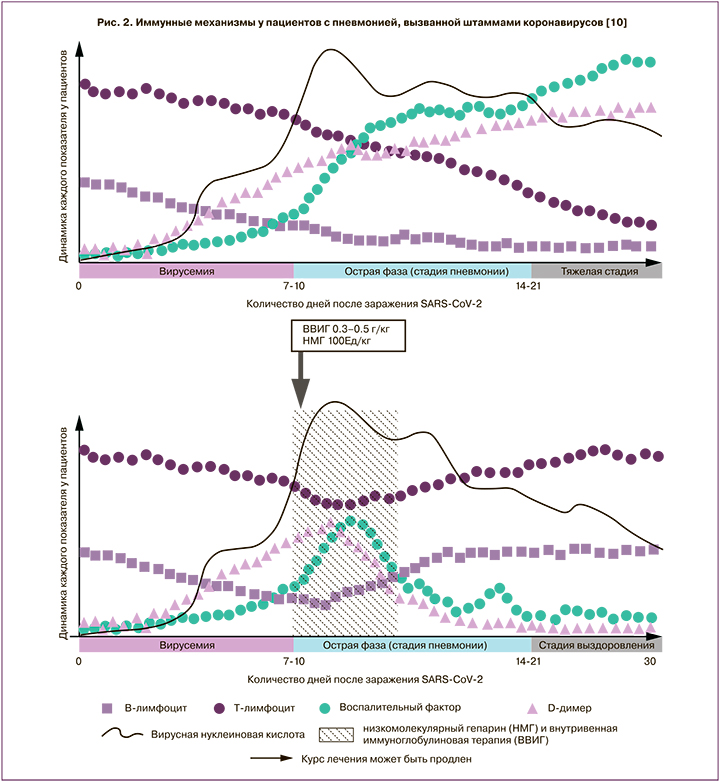
Исходя из изложенного, интерпретация результатов исследований антител класса IgG в крови сотрудников Центра сложна, во-первых, из-за отсутствия информации о конкретном штамме возбудителя, отсутствия возможности количественной оценки антител и их вируснейтрализующей способности. Важной является оценка длительности сохранения антител в крови, возможности повторного заражения при их выявлении в крови и степени тяжести повторного заражения. Дискуссионным является вопрос об использовании плазмы реконвалесцентов для лечения тяжелых форм коронавирусной инфекции, поскольку не выработаны критерии специфического донорства, хотя примеры использования реконвалесцентной плазмы уже опубликованы [11–13]. Принципиальной является оценка напряженности иммунитета при повторном заражении тех пациентов, выздоровление которых не сопровождалось выработкой антител класса IgG к SARS-CoV-2. Кроме того, в ходе проведенного нами исследования было отмечено в 2 раза меньшее количество заболевших в «красной» зоне (5,2%) по сравнению с «зеленой» (10,1%), что может свидетельствовать об эффективности используемых средств индивидуальной защиты и режимов их применения. Ответ на этот вопрос также требует дальнейших исследований.
Заключение
На основании проведенного исследования антител у сотрудников Центра и данных литературы можно сформулировать следующее заключение: наличие антител класса IgG при отсутствии РНК возбудителя в соскобе из ротоглотки и отсутствии клинических симптомов заболевания свидетельствует о перенесенном заболевании; наличие антител класса IgG при отсутствии РНК возбудителя в соскобе и проявлении клинических симптомов заболевания свидетельствует о текущем заболевании, но не о его стадии. Антитела класса IgG у бессимптомных носителей и у заболевших с легкой формой заболевания могут не выявляться в течение всего периода обнаружения РНК возбудителя в соскобе и после выздоровления. Наличие антител класса IgG при отсутствии РНК возбудителя в соскобе спустя месяц после начала заболевания не является свидетельством опасности больного для окружающих и, следовательно, не является основанием для самоизоляции и ограничения контактов.



