Преэклампсия (ПЭ) возникает у 2–8% беременных, является мультисистемным расстройством, ведущей причиной материнской и перинатальной заболеваемости и смертности [1, 2]. Этиология ПЭ остается до конца не ясной, но признается, что нарушение в росте и развитии плацентарных ворсин и сопровождающей их васкуляризации играет важную роль в патогенезе заболевания [3]. Для ПЭ характерно нарушение физиологической трансформации маточных спиральных артерий, возникновение хронической маточно-плацентарной гипоперфузии [4]. ПЭ может быть представлена двумя основными фенотипами с ранней и поздней манифестацией заболевания. Недостаточная плацентация на ранних сроках ассоциируется главным образом с ранней ПЭ [4].
Раннее выявление женщин группы риска по развитию ПЭ является ключевой задачей антенатального наблюдения, существенные ресурсы в настоящее время фокусируются на разработке и совершенствовании скрининговых тестов первого триместра, поскольку такой подход позволяет получить преимущества от назначения профилактической терапии и улучшить качество наблюдения [5]. Отмечается широкая вариабельность в эффективности существующих прогностических тестов и маркеров, к которым относятся материнские факторы риска, биофизические и/или биохимические факторы изолированно или в комбинации. Комбинирование базового материнского риска с биофизическими параметрами, такими как артериальное давление матери (АД) и допплерометрия маточных артерий (UtA), позволяет достичь 44–80% частоты выявления ранней ПЭ и 28–40% поздней ПЭ при 10% частоте ложноположительных результатов (ЛПР) [6, 7]. Допплеровские параметры кровотока в маточных артериях, отклонения в которых косвенно отражают процесс неадекватной инвазии трофобласта в материнские спиральные артерии, комбинируют с биохимическими маркерами, что позволяет лучше охарактеризовать процесс плацентации [8]. Биохимические маркеры, среди которых PAPP-A, циркулирующие ангиогенные факторы, такие как плацентарный фактор роста (PlGF), могут улучшить прогностические алгоритмы, частота выявления которых в этом случае варьирует от 47 до 96% [9, 10]. Поиск новых биомаркеров и их оптимальных комбинаций с целью улучшения эффективности прогнозирования ПЭ продолжается [8].
Технологии трехмерной (3D) эхографии с возможностью визуализации сосудистых объемов дает возможность прямой оценки ранних изменений в маточно-плацентарном циркуляторном пространстве (плацентарном ложе), включающем материнские спиральные артерии и межворсинчатое пространство [11, 12]. Использование 3D-эхографических параметров в качестве факторов риска ПЭ изучено недостаточно, с разнонаправленными результатами опубликованных данных. В недавней работе нами были подтверждены сведения, приводимые рядом автором о том, что женщины с ПЭ имеют значимо более низкие индексы объемного кровотока в плацентарном ложе и плаценте в первом триместре [13]. Однако практически отсутствуют работы, касающиеся изучения 3D-энергетической допплеровской оценки васкуляризации плацентарного ложа в комбинированных скрининговых моделях с биомаркерами, включая сывороточные маркеры ангиогенеза.
Целью данного исследование стала разработка наилучшей прогностической модели первого триместра на раннюю и позднюю ПЭ на основе комбинированной оценки клинико-анамнестических факторов, биомаркеров и 3D-энергетической допплеровской оценки васкуляризации плацентарного ложа. Исследование изучало независимую и комбинированную ценность данных о васкуляризации плацентарного ложа (PB-VI) при включении в прогностические алгоритмы первого триместра на раннюю и позднюю ПЭ.
Материал и методы исследования
В проспективном неинтервенционном когортном исследовании приняли участие 5157 женщин с одноплодными беременностями, обратившихся для проведения комбинированного скрининга в первом триместра с августа 2013 по декабрь 2016 года в клинику Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии Минздрава России (Москва). Местный Этический комитет одобрил протокол исследования, каждая пациентка подписывала информированное согласие на участие в исследовании.
Критериями включения в исследование были одноплодные беременности, прохождение комбинированного скрининга в первом триместре на анеуплоидии и последующее родоразрешение фенотипически нормального живого ребенка или антенатальная гибель в сроки ≥22 недели беременности. Критериями исключения служили беременности с анеуплоидиями и крупными аномалиями плода, а также прерывание беременности, случаи невынашивания или гибели плода до 22 недель беременности.
Обследование беременных в сроки 11+0 – 13+6 недель включало: 1) сбор сведений о материнских факторах риска и медицинском анамнезе; 2) ультразвуковое исследование с измерением копчико-теменного размера (КТР), толщины воротникового пространства, диагностикой пороков развития; допплерометрией маточных артерий и 3D-энергетической допплеровской ангиографией плацентарного ложа (см. ниже); 3) измерение среднего АД с помощью откалиброванного автоматического устройства OMRON HEM 907 (Omron Healthcare, Япония) по стандартизованному протоколу [14]; 5) измерение сывороточной концентрации β-hCG, PAPP-A, PlGF (DELFIA Xpress system, Wallac Oy, Турку, Финляндия). Сырые данные конвертировались в значения кратные медианам (Multiple of Median, MoM), рассчитываемые исходя из срока беременности (на основе данных о КТР), веса, возраста, этнической принадлежности матери, курения и метода наступления беременности. Для расчета рисков использовалось программное обеспечение Astraia v23.4 (Astraia Software Gmgh, Германия). Срок беременности определялся на основе значений КТР при ультразвуковом исследовании в первом триместре (11+0– 13+6 недель; значения КТР в диапазоне 45-84 мм).
Эхографическое исследование выполнялось как один из компонентов скрининга на анеуплоидии в первом триместре на приборах экспертного класса Voluson E8 (GE Medical Systems), оснащенных 3D/4D конвексным датчиком RAB4-8-D с частотой 4–8 МГц. Допплеровская оценка маточных артерий в первом триместре выполнялась трансабдоминально, согласно ранее описанному протоколу [14]. Автоматически измерялись пульсационные индексы маточных артерий (UtA-PI) и рассчитывалось среднее значение UtA-PI. В режиме 3D-энергетической допплеровской ангиографии забирался трехмерный объем плаценты, а также прилежащего децидуомиометрия. Допплеровские измерения выполнялись в режиме качества normal, частота повторов импульсов составляла 0.9 KHz, был использован фильтр движения объекта на уровне low1. Угол серошкальной картинки был равен 70°, увеличение 1.6, зона фокуса 1, X-beam CRI1, SRI3, OTI normal, гармоническая частота: high. Также рамка объема того же разрешения располагалась идентично позиции цветовой рамки, и процесс записи начинался в режиме настроек максимального качества, после чего данные сохранялись. Записи выполнялись с одинаковой скоростью у всех пациенток (10 с). В случае возникновения артефактов в процессе записи из-за движений плода или петель кишечника, забор объема повторялся до тех пор, пока достигалось достаточное качество записи. Режим VOCAL использовался для последовательной оценки шести срезов плаценты, каждый с углом смещения 30 градусов от предыдущего положения, ротированного горизонтального как в плоскости А, так и в плоскости В. В каждом из шести срезов вручную очерчивался контур плацентарного ложа (сублацентарного миометрия, маточно-плацентарного межворсинчатого пространства). Субплацентарный объем миометрия обозначался под плацентой в пределах до 1 см вглубь [15]. Васкуляризационные индексы плацентарного ложа автоматически рассчитывались с помощью программного обеспечения 4DView (GE Healthcare).
Преэклампсия определялась в соответствии с рекомендациями Международного общества по изучению гипертензии при беременности и Российского общества акушеров гинекологов [16, 17]. Ранняя ПЭ определялась как состояние, требующее родоразрешения до 34 недель беременности, поздняя ПЭ – после 34 недель беременности. Новорожденные считались маловесными к сроку беременности, если вес при рождении был ниже 10-й процентили [18]. К неблагоприятным перинатальным исходам относили гибель плода/новорожденного во время перинатального периода или наличие метаболического ацидоза при рождении, определяемого как наличие при рождении в артерии пуповины pH ≤7,15 и/или избытка оснований >12 мЭкв/л.
Для одномерных сравнений количественных и качественных переменных между группами ранней, поздней ПЭ и неосложненного течения беременности использовались U-критерий Манна–Уитни и χ2-критерий Пирсона соответственно. Для оценки независимого и комбинированного вклада переменных по прогнозированию ранней и поздней ПЭ и дополнительного вклада васкуляризационного индекса плацентарного ложа в улучшение существующих прогностических моделей первого триместра на ПЭ использовался многофакторный логистический регрессионный анализ. Во всех регрессионных моделях для отбора переменных использовались пошаговые алгоритмы при пороговых значениях p=0,05. Пациент-специфический риск для ранней и поздней ПЭ рассчитывается исходя из формулы: Риск = ey/(1 + ey). Значение Y для ранней и поздней ПЭ получалось из обратного ступенчатого многофакторного логистического регрессионного анализа log значения (или MoM) каждого из биомаркеров, log трансформированного априорного риска для состояния на основе только материнских факторов риска. Соответствие моделей задачам прогноза осуществлялось с помощью расчета коэффициента детерминации R2 (Nagelkerke R2). Эффективность модели также описывалась площадью под ROC-кривой операционных характеристик (AUC). Рассчитывалась чувствительность (частота выявления) модели по прогнозированию ранней и поздней ПЭ при фиксированный частоте ложноположительных результатов 10%. Для проведения статистического анализов использовался пакет статистических программ IBM SPSS 21.0 (New York, USA), построение графиков осуществлялось с помощью приложения MedCalc 18.5 (Mariakerke, Belgium).
Результаты исследования
За период наблюдения в клинику обратились и согласились принять участие в исследовании 5157 женщин с одноплодной беременностью. Из них 1733 (33,6%) женщины были исключены из исследования в связи с наличием хромосомных аномалий, крупных пороков развития, невынашиванием беременности в сроки до 22 недель, отсутствием данных об исходах, результатах допплерометрии маточных артерий (UtA-PI), васкуляризации плацентарного ложа (PB-VI) по техническим причинам, связанным с характеристиками оборудования, используемого для выполнения эхографии. Среди 3424 (66,4%) наблюдений, включенных в анализ, в 102 (3,0%) случаях развилась ПЭ, при этом в 29 (0,9%) случаях развилась ранняя ПЭ и в 73 (2,1%) случаях поздняя ПЭ. Неосложненное течение беременности наблюдалось у 3322 (97,0%) пациенток, которые представляли группу контроля.
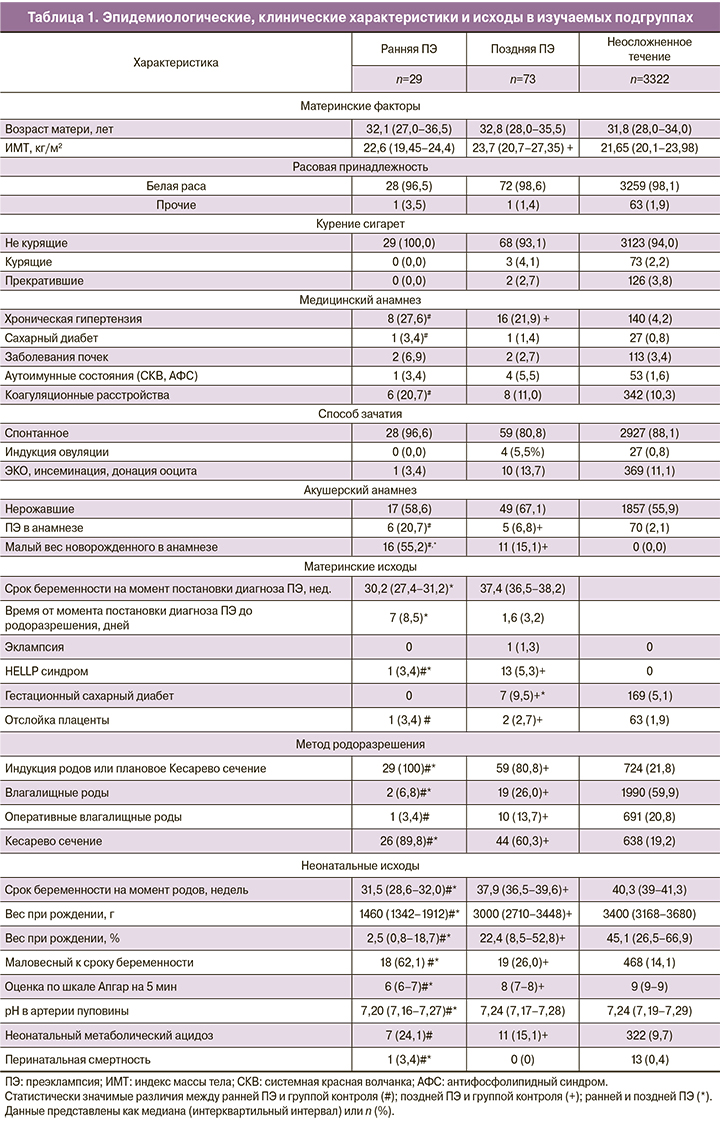
Данные о материнских характеристиках, акушерских и неонатальных исходах каждой из изучаемых групп приведены в табл. 1. Данные представлены отдельно для ранней и поздней ПЭ. Биофизические и биохимические переменные, оцениваемые в первом триместре, приведены в табл. 2.
При многофакторном анализе MAP MoM, PB-VI и UtA-PI MoM были значимо выше в группе ранней ПЭ (p<0,001) и в группе поздней ПЭ (p<0,001) в сравнении с группой неосложненного течения беременности, эти параметры также были значимо выше при ранней ПЭ в сравнении с поздней ПЭ (p<0,001).
PAPP-A MoM и β-hCG MoM были статистически незначимыми для обеих групп ПЭ. Значения PlGF MoM были значимо ниже при ранней ПЭ (p<0,001) в сравнении с группой контроля и поздней ПЭ (p<0,001).
Следующие модели наилучшим образом подходили для прогнозирования ранней ПЭ:
[Риск a priori и a posteriori = ey/(1 + ey)]:
Риск (a priori) =-5,250+ (1,329 если ПЭ в личном анамнезе) + (1,88697 если ПЭ в семейном анамнезе) + (1,739 если хроническая гипертензия) + (1,92220 если сахарный диабет); R2 = 11,9%; p<0,0001.
Риск (биофизические маркеры) =-3,651 + (0,62275×log риск a priori) + (7,418×log MAP MoM) – (0,148×log PB-VI); R2=46,8%; p<0,0001.
Риск (биофизические и биохимические маркеры) =1,74156 + (0,85468×log риск a priori) + (7,198×log MAP MoM) – (0,1456×log PB-VI) – (5,381×log PlGF MoM); R2=63,2%; p<0,0001.
Следующие модели наилучшим образом подходили для прогнозирования поздней ПЭ:
[Риск a priori и a posteriori = ey/(1 + ey)]:
Риск (a priori) =-6,047- (0,541 если рожавшая) + (1,757 если аутоиммунные заболевания, т.к. АФС, СКВ) + (1,82498 если хроническая гипертензия) + (0,0946×ИМТ); R2 = 9,7%; p<0,0001.
Риск (биофизические маркеры) =-5,011 + (0,751×log риск a priori) + (7,150×log MAP MoM) – (0,047×log PB-VI); R2=28,2%; p<0,0001.
Риск (биофизические и биохимические маркеры) =-2,92636 + (0,85468×log риск a priori) + (6,662×log MAP MoM) – (0,044×log PB-VI) – (1,599×log PlGF MoM); R2=33,1%; p<0,0001.
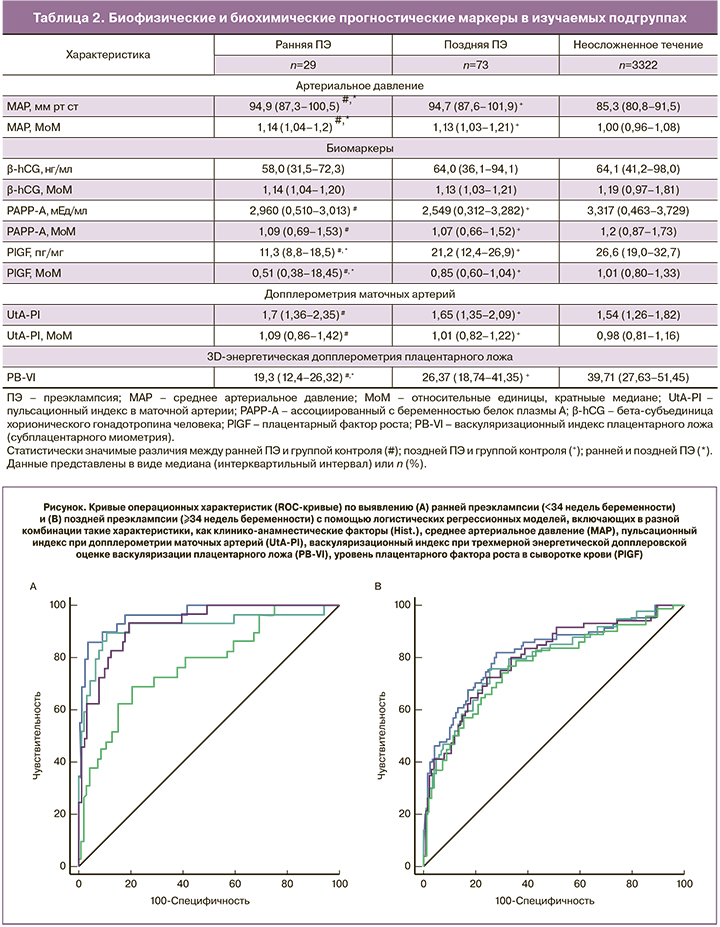
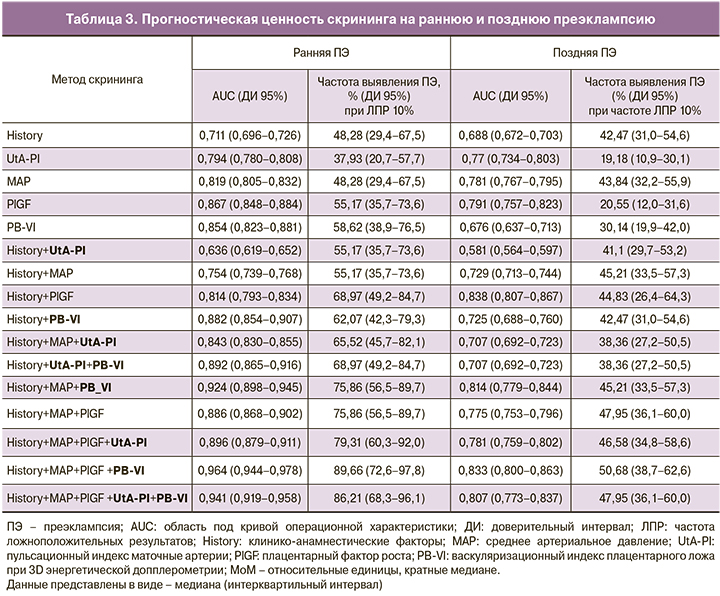
Частота выявления ПЭ для 10% частоты ЛПР представлена в табл. 3. ROC-кривые многофакторной модели, включая данные по PB-VI и UtA-PI, представлены на рис. 1. Применяя данный алгоритм для описанной ранее популяции [14], мы достигли частоты выявления ранней и поздней ПЭ с материнским риском a priori 48,3 и 42,5%; с добавлением биофизических маркеров (MAP и PB-VI) 75,9 и 45,2%; с добавлением PlGF к биофизическим маркерам (MAP и PB-VI) 89,7 и 50,7% соответственно при фиксированной частоте ЛПР 10%. Не наблюдалось значимого повышения чувствительности при добавлении в модель данных о PAPP-A, UtA-PI по отдельности или вместе.
Обсуждение
Принципиальные находки данного исследования
Это исследование оценивало новый подход к прогнозированию ПЭ в первом триместре. Его результаты подтверждают предположение, что данные о васкуляризации плацентарного ложа (PB-VI) при включении в комбинированные скрининговые модели улучшают прогнозирование ПЭ в первом триместре. Комбинация материнских характеристик, биофизических параметров (MAP, PB-VI), уровней ангиогенных факторов (PlGF) позволяла достичь частоты выявления ранней и поздней ПЭ 89,7 и 50,7% соответственно при частоте ЛПР 10%. Включение васкуляризационного индекса PB-VI улучшало частоту выявления ранней ПЭ на 14% и поздней ПЭ на 3% в сравнении с эффективностью, достигаемой при использовании базовых факторов, MAP, PlGF. Полученные данные показывают, что PB-VI при этом может иметь независимую ценность по улучшению частоты выявления как ранней, так и поздней ПЭ. Хотя уровни PAPP-A были ниже, а UtA-PI выше при беременностях с ПЭ, добавление этих маркеров не улучшало предсказательную способность индексов васкуляризации плацентарного ложа.
Сравнение с существующими исследованиями
Рядом авторов с целью прогнозирования ПЭ в первом триместре изучалась васкуляризация плаценты [19–21] и/или плацентарного ложа [12, 15, 22, 23], а также объем плаценты [19, 23–25]. Мы остановились на использовании анализа плацентарного ложа, в котором оценивался васкуляризационный индекс.
Для изучения маточно-плацентарного и межворсинчатого пространств в сроки с 5 до 12 недели беременности может использоваться как метод ручной трассировки области интересов [26], так и подход, основанной на эхобиопсии сфер [11, 23]. Оба метода демонстрировали хорошую воспроизводимость среди одного или нескольких исследователей [26]. Нами для выделения изучаемого объема использовался метод ручной трассировки.
Наши результаты согласуются с большинством ранее проведенных исследований, сообщающих о более низких индексах васкуляризации плацентарного ложа в первом триместре в случае последующего развития ПЭ, особенно у пациенток с ранним началом заболевания [12, 15, 27].
Имеются единичные публикации, касающиеся оценки эффективности комбинированных моделей прогноза ПЭ в первом триместре с использованием метода трехмерной эхографии и оценки васкуляризации плаценты и/или плацентарного ложа. В основном это были модели, в которых комбинировались данные объема плаценты, биофизические параметры (UtA-PI, MAP), биохимические маркеры (PAPP-A), данные анамнеза [21, 24, 25, 28]. В работе Hannaford и соавт. (2015) предпринята попытка оценить модели, включающие данные индексов васкуляризации плаценты/плацентарного ложа, а также допплерометрии маточных артерий и PAPP-A, на предмет прогнозирования ПЭ в первом триместре. Частота выявления ранней ПЭ составила 79% для модели, включающей данные PB-VI и UtA-PI, в то время как для всей ПЭ – 54% для модели, включающей данные PB-VI, UtA-PI, PAPP-A при частоте ЛПР 10% [12]. В нашей работе комбинирование данных PB-VI и UtA-PI не приводило к улучшению чувствительности модели, при этом PB-VI имел более высокую прогностическую ценность по сравнению с UtA-PI, что позволяло повысить эффективность прогнозирования ПЭ, достигая наилучшей частоты выявления ранней ПЭ 90% без включения UtA-PI.
Сильные стороны и ограничения
Насколько нам известно, ранее не сообщалось об изучении комбинации метода 3D энергетической допплеровской оценки васкуляризации плацентарного ложа с сывороточными маркерами ангиогенеза и широким спектром других маркеров и клинико-анамнестических факторов. Другой сильной стороной нашего исследования является его проспективный дизайн и хорошо организованная база данных с детальной регистрацией материнского анамнеза и акушерских исходов. Одним из преимуществ исследования является то, что оценка биофизических маркеров проводилась в строгом соответствии с протоколом FMF или нашими внутренними протоколами.
Ограничениями данного исследования являются относительно малый размер выборки, а также отсутствие внешней валидации построенной модели, которая должна быть оценена в общей акушерской популяции.
Ряд авторов полагает, что использование в настоящее время для скрининга в первом триместре 3D-энергетической допплеровской ангиографии мало приемлемо в клинической практике [29]. По нашим данным измерения с помощью 3D-энергетической допплеровской ангиографии являются высоко воспроизводимой методикой и могут легко проводиться во время скрининга в первом триместре при оценке воротникового пространства. Приемлемость и воспроизводимость количественной оценки допплеровских сигналов с расчетом VI, FI и VFI были признаны удовлетворительными при оценке в условиях in vivo и in vitro [30].
Время, требуемое на получение анализируемого объема, составляет около 2–3 минут при сканировании в 11–13 недель беременности. Однако следует признать, что дополнительное время будет требоваться для ручной трассировки контура плацентарного ложа (маточно-плацентарного циркуляторного пространства, децидуомиометрия). В этом контексте допплерометрия маточных артерий является относительно простым и менее затратным по времени методом. Однако полученные данные говорят о более высокой прогностической ценности PB-VI по сравнению с UtA-PI, что позволяет повысить эффективность прогнозирования ПЭ, достигая наилучшего результата 90% для ранней ПЭ в комбинированных моделях без включения в модель данных UtA-PI.
Клиническая интерпретация исследования
Приведенные данные показывают, что при скрининге ПЭ в первом триместре эффективность теста лучше для заболевания с ранним, а не с поздним началом. Это особенно важно, поскольку целью раннего скрининга является выявление группы высокого риска, которая могла бы получить пользу от терапевтических вмешательств по снижению распространенности ПЭ. Профилактическое назначение аспирина в низких дозах, начатое до 16 недель беременности, особенно эффективно в профилактике ранней ПЭ, снижая частоту возникновения осложнения в этой группе беременных на 82% [5]. В то же время с помощью 3D-энергетической ангиографии удалось выявить нарушения васкуляризации в области децидуомиометрия в первом триместре у беременных с последующим развитием как ранней, так и поздней ПЭ. До сих пор продолжаются дискуссии в отношении того, являются ли ранняя и поздняя ПЭ различными заболеваниями. Исходя из данных исследования представляется, что существует положительная зависимость между уровнем васкуляризации плацентарного ложа и сроком родоразрешения. Это подтверждает, что возможно, ПЭ является единым патофизиологическим состоянием с широким спектром тяжести, которое зависит от срока беременности на момент родоразрешения. Более точный отбор группы высокого риска позволит с большей эффективностью и в меньшей по объему выборке оценить новые методы снижения частоты развития ПЭ, такие как прием метформина или статинов.
Заключение
Исследование подтверждает, что прогнозирование ПЭ в первом триместре эффективно, и оценка васкуляризации плацентарного ложа (PB-VI) может являться ценными предиктором ПЭ в комбинированных скрининговых моделях. Среди эхографических маркеров способность повышать эффективность прогнозирование ранней и поздней ПЭ демонстрируют как UtA-PI, так и PB-VI, причем модели с PB-VI в сравнении с UtA-PI показывают значимо более высокую частоту выявления ранней ПЭ. Комбинированный скрининг с включением материнских характеристик, среднего артериального давления, PB-VI и PlGF достигал частоты выявления ранней и поздней ПЭ 89,7 и 50,7% соответственно. Полученные данные требуют подтверждения в более крупных исследованиях.



