Толщина эндометрия в конце фолликулярной фазы и в день переноса эмбриона имеет большое значение для оценки возможности наступления и пролонгирования беременности. В клинической практике минимальной толщиной эндометрия к концу фолликулярной фазы, связанной с более высокой частотой наступления беременности, принято считать толщину эндометрия 7 мм [1]. Частота наступления беременности увеличивается при толщине эндометрия более 7 мм в день переноса эмбриона [2].
В двух исследованиях при использовании ROC-анализа пороговым значением толщины эндометрия, связанной с успешной имплантацией в программах вспомогательных репродуктивных технологий (ВРТ), была выявлена толщина, равная 8 мм в день назначения человеческого хорионического гонадотропина (чХГ) [3, 4]. Несмотря на то что толщину эндометрия принято считать косвенным методом оценки его рецептивности, в одной из работ, где авторы исследовали экспрессию эстрогеновых рецепторов α (ER), прогестероновых рецепторов (PR) и лейкемия-ингибирующего фактора (LIF) в поверхностном, железистом эпителии и строме в нормальном и «тонком» эндометрии, не было найдено статистически значимых различий в рецептивности «тонкого» и нормального эндометрия [5].
Первым шагом при неудовлетворительном росте эндометрия у пациенток с бесплодием является изменение стандартной схемы назначения препаратов эстрадиола, в основном увеличивают дозу назначаемых препаратов. Эстрогены способствуют пролиферации эндометрия при помощи сокращения спиральных артерий и уменьшения кислородного напряжения в функциональном слое, что способствует имплантации эмбриона [6, 7].
За последнее время было предложено множество новых методов для увеличения толщины эндометрия, включая применение низких доз аспирина, вазодилататоров, внутривлагалищное назначение витамина Е, Л-аргинина и силденафил-цитрата, физиотерапевтические методы лечения, внутриматочное введение стволовых и прогениторных клеток [8]. Но ни один из методов не решает проблему «тонкого» эндометрия, и частота отмены циклов переноса эмбриона при данной патологии остается очень высокой.
Гранулоцитарный колониестимулирующий фактор
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) – это гликопротеин, принадлежащий к группе колониестимулирующих факторов. Он стимулирует развитие колонии гранулоцитов. Г-КСФ является аминокислотным полипептидом, и его продуцируют многие клетки, в том числе и эндотелиальные моноциты и клетки эндометрия [9]. Г-КСФ играет важную роль в децидуализации эндометрия, развитии трофобласта и плацентарном метаболизме. Г-КСФ способствует мобилизации, миграции и дифференциации стволовых клеток. Он также способствует регенерации эндометрия путем стимуляции ангиогенеза и снижения апоптозной активности клеток эндометрия. Г-КСФ играет роль в имплантации эмбриона и развитии беременности путем временной супрессии иммунного ответа, связанного с его влиянием на лимфоциты, макрофаги и Т-хелперы 2 [10].
Рекомбинантный препарат Г-КСФ уже более 20 лет применяется в клинической практике. Его используют для лечения нейтропении, возникающей при проведении химиотерапии у пациентов с онкологическими заболеваниями [11, 12].
Впервые в качестве препарата для увеличения толщины эндометрия Г-КСФ был применен N. Gleicher et al. в 2011 г. [13]. В исследовании использовался рекомбинантный препарат Г-КСФ в дозе 300 мкг внутриматочно. Авторы сообщили
об увеличении толщины эндометрия до 7 мм и более через 48 ч после введения препарата у 4 пациенток в программе ВРТ. Все 4 пациентки забеременели, но в одном случае была выявлена внематочная беременность, авторы не связывают ее с назначением препарата Г-КСФ. Далее было проведено множество исследований для определения эффективности применения Г-КСФ с целью увеличения толщины эндометрия у пациенток с рефрактерным «тонким» эндометрием в программах ВРТ [14–21]. Полученные результаты неоднозначны, авторы чаще всего отмечают статистически значимое увеличение толщины эндометрия, но не было выявлено статистически значимого увеличения частоты наступления беременности и живорождения.
Плазма, обогащенная тромбоцитами
Новым подходом лечения «тонкого» эндометрия является внутриматочное введение аутологичной плазмы, обогащенной тромбоцитами (ПОТр). После активации тромбоцитов в ПОТр они становятся биоактивными, а также высвобождаются цитокины и такие факторы роста, как сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста (TGF), фактор роста тромбоцитов (PDGF) и эпидермальный фактор роста (EGF) [22]. Предположительно они могут регулировать миграцию клеток, пролиферацию, дифференциацию и способствовать накоплению внеклеточного матрикса [23].
В настоящее время ПОТр широко используется в различных отраслях медицины, таких как ортопедия и офтальмология, ее используют для лечения ран с целью улучшения регенерации тканей [24].
Впервые применение данного препарата с целью увеличения толщины эндометрия у пациенток в программах ВРТ было предложено Yajie Chang1 et al. в 2014 г. [25]. В исследование было включено 5 пациенток с «тонким» эндометрием (<7 мм) в программе ВРТ. В дополнение к циклической гормональной терапии (ЦГТ) пациенткам внутриматочно вводили ПОТр в объеме 0,5–1 мл на 10-й день приема ЦГТ. Авторы сообщили об увеличении толщины эндометрия более 7 мм и наступлении беременности у всех пациенток после терапии. Далее последовало множество исследований, оценивающих эффективность применения данного препарата для подготовки пациенток с рефрактерным «тонким» эндометрием в программах ВРТ [26–30]. Результаты исследования также были неоднозначными, но некоторые авторы отметили статистически значимое увеличение толщины эндометрия и частоту наступления беременности по сравнению с группой контроля.
Учитывая вышеизложенное, мы решили провести исследование с целью сравнить эффективность применения препарата Г-КСФ и аутологичной ПОТр в подготовке пациенток с «тонким» эндометрием в программах переноса размороженных эмбрионов.
Материалы и методы
Мы провели проспективное когортное исследование, в которое вошли 58 пациенток, у которых в предыдущих циклах ВРТ на фоне приема ЦГТ был отменен перенос эмбриона в полость матки в связи с «тонким» эндометрием (<7 мм). В данном цикле все пациентки получали ЦГТ с 4–5-го дня менструального цикла (м.ц.): назначался препарат эстрадиола валерат (Bayer Schering Pharma, France) внутрь со стартовой дозой 6 мг в день, доза препарата увеличивалась в зависимости от «ответа» эндометрия на терапию. Максимальная суточная доза была 12 мг в день. Во второй фазе м.ц. пациентки получали 400 мг микронизированного прогестерона (CYNDEA PHARMA, S.L., Испания) во влагалище и 40 мг дидрогестерона (Solvay Pharmaceuticals, Нидерланды) внутрь.
В первую группу вошли 37 пациенток, которым в дополнение к ЦГТ назначалась аутологичная ПОТр в дозе 5–7 мл на 8–9, 10–11 и 12–13-й дни м.ц. Во второй группе была 21 пациентка, которые в дополнение к ЦГТ получали рекомбинантный препарат Г-КСФ «Филграстим» в дозе 300 мкг («Лейкостим», ЗАО «Биокад», Россия) на 5–6 и 12–13-й дни м.ц. Оба препарата вводились внутриматочно с использованием катетера для инсеминации (Smiths Medical International Ltd.).
Первичной конечной точкой исследования было увеличение толщины эндометрия более 7 мм в день переноса эмбриона, вторичной конечной точкой – частота наступления беременности. Толщина эндометрия измерялась с помощью аппарата ультразвукового исследования (УЗИ) GE Voluson E8 на 13–15-й день м.ц. – до назначения гестагенов и на 20–22-й день м.ц. – в день переноса эмбриона в полость матки. «Тонким» считался эндометрий при толщине 7 мм и менее.
Для диагностики беременности пациенткам назначался анализ крови на бета-субъединицу человеческого хорионического гонадотропина (чХГ) на 14-й день после переноса эмбриона. При положительном значении чХГ производилось УЗИ органов малого таза на 21-й день после переноса эмбриона. При обнаружении плодного яйца при УЗИ беременность была расценена как клиническая, при отсутствии данных показателей – как биохимическая. Через 5–6 недель после переноса эмбриона производилось УЗИ органов малого таза для определения сердцебиения плода.
Критериями включения в исследование были:
- возраст 20–42 года;
- регулярный овуляторный менструальный цикл (25–34 дней);
- индекс массы тела: 18–30 кг/м2;
- бесплодие, обусловленное трубным и/или мужским фактором и/или наружным генитальным эндометриозом;
- идиопатическое бесплодие;
- наличие в анамнезе отмены переноса эмбриона в связи с наличием «тонкого» эндометрия;
- отсутствие внутриматочной патологии на основании проведенной гистероскопии;
- наличие не менее 3 витрифицированных бластоцист классов: 1) excellent (≥3AA); 2) good (3, 4, 5, 6, AB и BA) и/или average (3, 4, 5, 6 BB, AC и CA) (по классификации Gardner и Schoolcraft (1999);
- отсутствие индивидуальной непереносимости препарата Г-КСФ и противопоказаний согласно инструкции данного препарата;
- информированное согласие на участие в исследовании.
Пациентки исключались из исследования при наличии онкологического заболевания в анамнезе, тяжелой формы наружного генитального эндометриоза или аденомиоза, внутриматочных синехий, полипов, субмукозной миомы матки, врожденных пороков развития матки до хирургического лечения.
Исследование было одобрено этическим комитетом Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени В.И. Кулакова. Следует отметить, что в данном случае препарат Г-КСФ является «off lable», и, согласно инструкции, он не предусмотрен для внутриматочного введения.
Изготовление ПОТр и его введение
Пациенткам на 8-й день м.ц. производился забор аутологичной крови в объеме 400,0 мл в первый контейнер строенной системы Blood bag (фирма JMS Singapure) с антикоагулянтом СPDA – 63 ml. Далее контейнер с кровью центрифугировался в рефрижераторной центрифуге Becman в течение 8 минут в режиме 1971g при температуре +22˚С. После центрифугирования с помощью плазмоэкстрактора плазма и тромбоциты (верхний и средний слой) перемещались во второй контейнер. Контейнер с аутоэритроцитами отсоединялся, и они реинфузировались пациентке. Второй контейнер с плазмой и тромбоцитами повторно центрифугировался в течение 10 минут с центробежным ускорением 5130g при температуре +22°С. После этого с помощью плазмоэкстрактора в третий контейнер удалялся верхний слой – это нативная плазма, а нижний слой – концентрированные тромбоциты, взвешенные в плазме, перемещались в специальный контейнер для хранения тромбоцитов (фирма JMS, Singapure). Контейнер с аутологичной ПОТр маркировали, оставляли в течение 1 ч в спокойном состоянии для дезагрегации тромбоцитов, далее переносили в климатическую камеру для перемешивания тромбоцитов LmB Technologie GmbH (производство Германия), где она может храниться в течение 5 суток при температуре +22–24°С. При соблюдении данной методики из 400±50 мл цельной крови в результате двухэтапного центрифугирования получали 40±5 мл аутологичной ПОТр с содержанием 0,6–0,7×1011 тромбоцитов в ней. В последующем в стерильных условиях аутологичная ПОТр разделялась на три дозы в контейнеры для хранения тромбоцитов, которые выдавались в процедурную в дни проведения манипуляции. Пациенткам вводился препарат внутриматочно в объеме 5–7 мл по вышеуказанной схеме с помощью катетера для инсеминации.
Статистический анализ
Статистический анализ производился в программе STATISTICA (StatSoft Inc.). Для описания постоянных переменных, имеющих нормальное распределение, были использованы среднее арифметическое и стандартное отклонение – М (SD), и производилось их сравнение с t-критерием Стьюдента между группами с нормальным распределением признаков и равенством дисперсий в сравниваемых группах. Для сравнения дискретных переменных был применен критерий Хи-квадрат, результаты которых представлены в виде процентов. Значение p<0,05 расценивалось как статистически значимое. Для непрерывных данных размер эффекта был рассчитан как разность средних значений с 95% доверительным интервалом (ДИ).
Результаты
Характеристика пациенток, вошедших в исследование, представлена в таблице 1.
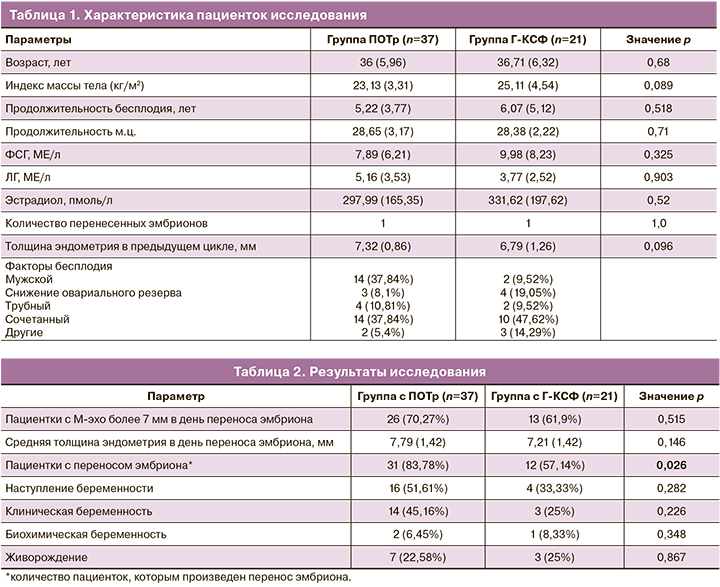
Средний прирост толщины эндометрия по сравнению с предыдущим циклом в группе с ПОТр составил 0,47 мм (р=0,085), значение статистически не значимое, в группе с Г-КСФ – 0,42 мм (р=0,329), значение статистически не значимое. Толщина эндометрия более 7 мм в день переноса эмбриона в данном цикле в группе с ПОТр была у 26 (70,27%) пациенток, а в группе с Г-КСФ – у 13 (61,9%) пациенток, различия статистически не значимы (р=0,515). Средняя толщина эндометрия в день переноса эмбриона в группе с ПОТр составила 7,79 (1,42) мм, а в группе с применением препарата Г-КСФ – 7,21 (1,42) мм, разница статистически не значима (р=0,146, разность средних значений – 0,58 с 95% ДИ -0,1972–1,3572).
В группе с ПОТр перенос эмбриона произведен 31 (83,78%) пациентке, а в группе с Г-КСФ – 12 (57,14%) пациенткам, разница статистически значима (р=0,026). Беременность наступила у 16 (51,61%) пациенток в группе с ПОТр, а в группе с Г-КСФ – у 4 (33,33%) пациенток, разница статистически не значима (р=0,282). Из них – клиническая беременность у 14 (45,16%) пациенток в группе с ПОТр и у 3 (25%) пациенток в группе с Г-КСФ, разница статистически не значима (р=0,226). Нет статистически значимого различия также в частоте живорождения между 2 группами: в группе с ПОТр – 7 (22,58%), в группе с Г-КСФ – 3 (25%) (р=0,867).
Следует отметить, что в нашем исследовании не было выявлено ни одного побочного эффекта после применения препаратов ПОТр и Г-КСФ.
Результаты исследования представлены в таблице 2.
Обсуждение
В данной работе мы ставили цель – сравнить два новых метода подготовки пациенток с рефрактерным к стандартным методам лечения «тонким» эндометрием к циклу переноса размороженного эмбриона, так как, по данным некоторых исследований, толщина эндометрия является одним из возможных показателей рецептивности эндометрия, а эффективных методов, способствующих увеличению ее толщины, в настоящее время нет. В нашем исследовании мы выбрали препарат аутологичной ПОТр и рекомбинантный препарат Г-КСФ. По результатам нашего исследования, различие в приросте толщины эндометрия после введения вышеуказанных препаратов, по сравнению с предыдущим циклом, где пациентки принимали только ЦГТ, не было статистически значимым; также не было статистически значимых различий в толщине эндометрия в день переноса эмбриона между двумя группами, а также между количеством пациенток, у которых толщина эндометрия была более 7 мм в день переноса эмбриона. Статистически различался только показатель количества пациенток, которым был произведен перенос эмбриона в полость матки: в группе с ПОТр он был выше (31 (83,78%) против 12 (57,14%), р=0,026). Возможно, это связано с наличием лучшей структуры эндометрия в группе с применением ПОТр, но данный показатель не оценивался в нашем исследовании. Не было выявлено также статистически значимых различий в частоте наступления беременности, в том числе и клинической, и частоте живорождения.
Заключение
Преимуществом препарата ПОТр можно считать то, что он изготавливается из аутологичной крови, что исключает передачу инфекций и аллергические реакции, а Г-КСФ является препаратом «off lable» в данном случае, т.к., согласно инструкции, он используется для лечения нейтропении у пациентов после химиотерапии и вводится подкожно или внутривенно. Но в нашем исследовании мы не отметили ни одного побочного эффекта после внутриматочного введения данного препарата. В результате нашего исследования мы не можем утверждать, можно ли отдавать предпочтение какому-либо одному препарату в подготовке пациенток с «тонким» эндометрием к переносу эмбриона. Следует провести дальнейшие рандомизированные исследования на большей выборке пациенток.



