Известно, что для наступления беременности необходимо наличие двух факторов: эуплоидного эмбриона хорошего качества и нормальной рецептивности эндометрия с высоким потенциалом имплантации. Считается, что эндометрий недостаточной толщины может быть причиной не аступления беременности, в том числе в программах вспомогательных репродуктивных технологий (ВРТ) [1–3]. Впервые пороговая толщина эндометрия как прогностический критерий наступления беременности была предложена Gonen и соавт. в 1989 г. [4]. С этого времени понятие минимальной толщины эндометрия стало активно использоваться в клинической практике. При этом, так называемым «тонким» эндометрием стали считать эндометрий менее 6–8 мм в период окна имплантации [2, 3, 5]. Однако нет убедительных данных о том, что «тонкий» эндометрий снижает вероятность наступления беременности как в естественном цикле, так и в программах ВРТ. Данные о прогностической ценности этого значения по-прежнему противоречивы, так же как и данные о нарушении рецептивности «тонкого» эндометрия, что может быть причиной неудач имплантации [6–10]. Сложность оценки рецептивности эндометрия заключается в ее изучении в цикле, отличном от цикла зачатия. При этом толщина эндометрия и его рецептивность могут меняться от цикла к циклу.
Целью исследования было оценить рецептивность «тонкого» эндометрия у пациенток с бесплодием в зависимости от наступления беременности в программах ВРТ.
Материалы и методы
В проспективное исследование были включены 32 пациентки, обратившиеся для лечения бесплодия с помощью ВРТ в период с 2016 по 2018 г., с отсутствием противопоказаний к проведению программ ВРТ и подписанным информированным согласием на участие в исследовании. Критерии включения: нормальный кариотип пациентки и ее партнера, возраст от 18 до 40 лет, индекс массы тела (ИМТ) от 18 до 29,9 кг/м2. Критерии исключения: наличие противопоказаний к ВРТ, выраженная патоспермия у партнера, использование донорских гамет или суррогатного материнства, «бедный» ответ на овариальную стимуляцию, отсутствие бластоцист хорошего качества, а также развитие осложнений ВРТ в изучаемом цикле.
Пациентки были стратифицированы на группы в зависимости от наступления беременности и толщины эндометрия: 1-я группа (n=12) – пациентки с нормальной толщиной эндометрия, у которых наступила беременность; 2-я группа (n=6) – пациентки с нормальной толщиной эндометрия, у которых беременность не наступила; 3-я группа (n=14) – пациентки с «тонким» эндометрием, у которых беременность также не наступила. При этом пороговый уровень толщины эндометрия составил 8 мм, согласно ранее проведенному исследованию [11].
Перед включением в программу ВРТ все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий (ВРТ), противопоказаниях и показаниях к их применению» [12].
В цикле, предшествующем циклу овариальной стимуляции и переноса эмбрионов, в период «окна имплантации» (на 6-8 день после овуляции) всем пациенткам было проведено ультразвуковое исследование (УЗИ) органов малого таза, определена толщина эндометрия, и путем аспирационной пайпель-биопсии из дна матки была получена ткань эндометрия. Овуляция подтверждалась при помощи УЗИ и тестов на овуляцию, оценивающих пик лютеинизирующего гормона (ЛГ) в моче.
Полученные образцы эндометрия обрабатывали по стандартной методике с получением парафиновых блоков. Проводилось гистологическое исследование эндометрия, и исследовалась экспрессия эстрогеновых рецепторов α (ER), прогестероновых рецепторов (PR) и лейкемия-ингибирующего фактора (LIF) в поверхностном, железистом эпителии и строме эндометрия иммуногистохимическим методом (ИГХ) на депарафинированных срезах толщиной 3–4 мкм. Уровень экспрессии стероидных рецепторов определяли с использованием мышиных моноклональных антител к ER (клон 1D5 RTU DAKO, Дания) и PR (клон 636 RTU DAKO, Дания), экспрессии LIF – с использованием мышиных моноклональных антител, (клон 9824, 1:100, R&D Systems, USA).
Анализ результатов ИГХ-реакций для ER и PR проводили с учетом количества окрашенных клеток и интенсивности окраски в эпителии и строме эндометрия, используя метод гистологического счета H-score по формуле: HS = 1a+2b+3c, где а – % слабо окрашенных клеток; b – % умеренно окрашенных клеток; с – % сильно окрашенных клеток, 1, 2, 3 – интенсивность окрашивания, выраженная в баллах. Степень выраженности экспрессии ER и PR расценивали: 0–10 – отсутствие экспрессии, 11–100 – слабая экспрессия, 101–200 – умеренная экспрессия, 201–300 – выраженная экспрессия.
Результаты ИГХ-реакции для LIF оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов; менее 20% иммуноокрашенных клеток (+) – 1 балл; от 20 до 40% окрашенных клеток (++) – 2 балла; более 40% окрашенных клеток (+++) – 3 балла.
В программе ВРТ овариальная стимуляция проводилась с применением рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата рФСГ и ЛГ и назначением антагонистов гонадотропин-рилизинг-гормона (ГнРГ). Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера использовали препарат хорионического гонадотропина (ХГ) в дозе 8000–10 000 МЕ. Трансвагинальная пункция яичников (ТВП) осуществлялась через 36 ч после введения триггера овуляции.
Оплодотворение ооцитов у всех пациенток осуществлялось методом интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Показаниями к ИКСИ у наблюдаемых пациентов были субфертильная сперма у партнера и низкая частота оплодотворения в предыдущей программе экстракорпорального оплодотворения (ЭКО). Морфологическую оценку эмбрионов проводили на 5-е сутки после ТВП согласно классификации Gardner et al. [13].
Перенос эмбриона в полость матки осуществляли на 5-е сутки после ТВП в «свежем» цикле. В полость матки переносили одну бластоцисту лучшего качества. Ведение посттрансферного периода осуществлялось по единому протоколу.
При наличии подъема уровня сывороточного ß-ХГ через 14 дней после переноса эмбриона в полость матки регистрировали биохимическую беременность, а при ультразвуковой визуализации плодного яйца в полости матки через 21 день после переноса эмбрионов – клиническую беременность.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста/ANOVA или теста Манна–Уитни/Краскела–Уоллиса для сравнения средних величин в 2 или 3 группах. Мерой ассоциации для сравнения бинарных данных было скорректированное по конфаундерам отношение шансов (ОШкор), рассчитанное с помощью метода логистической регрессии. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р=0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты
Средний возраст и ИМТ пациенток не различались в группах сравнения (р=0,05). Между группами не было выявлено различий в менструальной функции, числе беременностей, паритете, параметрах гормонального исследования и соматической заболеваемости. У пациенток с не наступившей беременностью (2-я и 3-я группы) отмечалась большая доля гинекологических заболеваний в виде наружного генитального эндометриоза, миомы матки и полипов эндометрия в анамнезе. У них также был более длительный анамнез бесплодия.
При оценке особенностей овариальной стимуляции в программе ИКСИ в группах сравнения не было отмечено различий в суммарной дозе гонадотропинов, длительности стимуляции, а также в виде препарата для овариальной стимуляции (табл. 1).
В программе ИКСИ у пациенток с наступившей беременностью отмечался более высокий уровень бластуляции и, как следствие, было получено большее число бластоцист отличного качества (табл. 2).
При проведении УЗИ не было выявлено значимых отличий в параметрах размеров матки, объема яичников и количестве антральных фолликулов, определяющих овариальный резерв. При этом отмечалось, что у пациенток с наступившей в результате переноса эмбриона беременностью была значимо больше толщина эндометрия (9,6±1,1) мм, по сравнению с пациентками, у которых беременность не наступила (7,0±1,2) мм (р<0,0001). У пациенток с толщиной эндометрия ≥8 мм беременность наступила в 66,7% случаев (у 12 из 18 человек), тогда как у пациенток с «тонким» эндометрием случаев беременности зафиксировано не было (0 из 14 человек) (р=0,0001). При этом следует отметить, что на наступление беременности могли влиять такие факторы (конфаундеры), как эндометриоз и число бластоцист отличного качества, имевшие статистически значимую связь с наступлением беременности в однофакторном анализе. При проведении многофакторного анализа методом логистической регрессии ОШ наступления беременности в зависимости от наличия «тонкого» эндометрия с учетом эндометриоза составило 1,47 (95% ДИ 1,05–2,5). Качество бластоцист потеряло статистическую значимость при проведении многофакторного анализа.
При гистологическом исследовании эндометрий во всех случаях соответствовал средней стадии секреции. При ИГХ-исследовании не было получено статистически значимой разницы в изучаемых параметрах рецептивности в зависимости от наступления беременности и толщины эндометрия (р>0,05). Экспрессия ER отмечалась во всех слоях эндометрия, была максимальной в железах, минимальной – в строме эндометрия и находилась в диапазоне от 15 до 275. При сравнении уровня экспрессии в группах пациенток было отмечено, что наибольший уровень экспрессии во всех тканях эндометрия отмечался в 1-й группе (рисунок, а). Экспрессия PR также отмечалась во всех слоях эндометрия, была максимальной в поверхностном эпителии, меньше – в железах и строме эндометрия и находилась в диапазоне от 25 до 300. При этом наибольший уровень экспрессии в поверхностном и железистом эпителии эндометрия отмечался в группе 1 и не отличался между группами в строме эндометрия (рисунок, б). Соотношение PR/ER находилось в диапазоне от 0,21 до 9,0 и было максимальным в строме и минимальным – в железах эндометрия. В поверхностном эпителии и железах несколько большее соотношение PR/ER отмечалось в группе наступления беременности (1-я группа), в железах было одинаковым вне зависимости от наступления беременности, в строме наибольшее соотношение PR/ER отмечалось у пациенток с не наступившей беременностью (2-я и 3-я группы) (рисунок, в). Экспрессия LIF отмечалась во всех тканях эндометрия, была в основном слабо выраженной, максимальной – в строме, минимальной – в железах эндометрия и колебалась от 0,65 до 1,55 балла. Наибольший уровень экспрессии LIF отмечался у пациенток с наступившей беременностью как в эпителии, так и в строме эндометрия (рисунок, г).
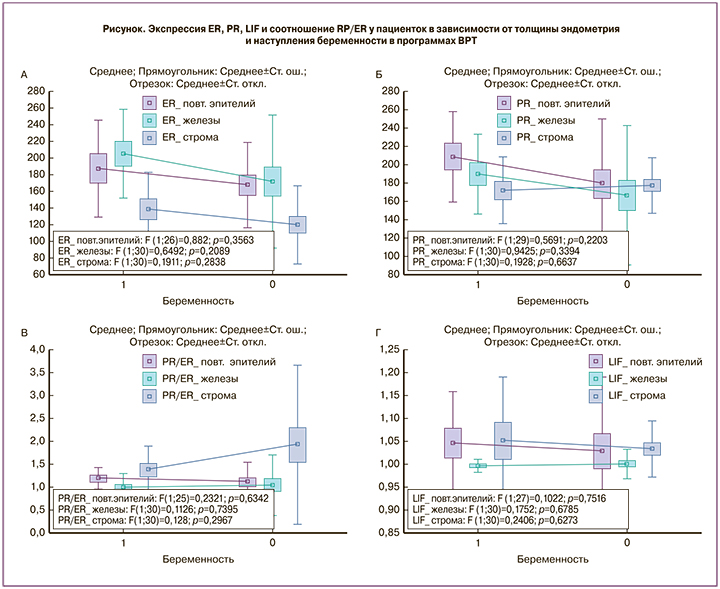
При проведении корреляционного анализа между толщиной эндометрия и экспрессией изучаемых маркеров был выявлен ряд корреляционных связей: слабая положительная корреляционная связь с экспрессией ER во всех тканях эндометрия; слабая положительная корреляционная связь с экспрессией PR в поверхностном эпителии; слабая отрицательная корреляционная связь с экспрессией PR в железах и строме эндометрия; слабая отрицательная корреляционная связь с PR/ER во всех тканях эндометрия; слабая положительная корреляционная связь с экспрессией LIF в поверхностном эпителии; слабая отрицательная корреляционная связь с экспрессией LIF в железах и строме эндометрия. Все выявленные корреляционные связи были статистически не значимы.
Обсуждение
На 1-м этапе исследования было выявлено, что в отобранной группе пациенток толщина эндометрия влияла на частоту наступления беременности в программах ВРТ. У пациенток с эндометрием <8 мм, измеренным с помощью УЗИ в период «окна имплантации», шансы наступления беременности были в 1,47 раза ниже. В ряде исследований была отмечена связь толщины эндометрия с бесплодием и невынашиванием беременности, а позже – с эффективностью программ ВРТ [14–16]. При этом пороговой величиной, определяющей «тонкий» эндометрий, по данным разных исследований, является величина от 6 до 8 мм [17–19]. В определении пороговой толщины эндометрия мы опирались на ранее полученные нами данные, в которых данная величина составила 8 мм [11]. Наши данные согласуются с исследованием Miwa и соавт. (2009) и других исследователей, в котором частота наступления беременности в программах ВРТ у пациенток с эндометрием ≤8 мм была значительно ниже, чем у пациенток с толщиной эндометрия >8 мм (5,9% по сравнению с 22,4%) [20, 21]. И все-таки, несмотря на большой пул работ, в которых было показано негативное влияние уменьшения толщины эндометрия на исходы программ ВРТ, существуют противоположные данные об отсутствии влияния толщины эндометрия на частоту наступления беременности [8].
На 2-м этапе мы провели исследование рецептивности эндометрия в зависимости от его толщины и наступления беременности в циклах ВРТ. Нами были получены неоднозначные данные. Известно, что при компрометированном эндометрии (при наличии наружного генитального эндометриоза, множественных неудачных попыток программ ВРТ в анамнезе и др.) отмечается повышение экспрессии ER и PR, и данные изменения в основном отмечаются в поверхностном эпителии эндометрия, который первый «вступает в диалог» с бластоцистой [22, 23]. Считается, что на фоне высокой экспрессии ER происходит пролиферация эндометрия, изменяется характер генной экспрессии и снижается имплантационная способность эндометрия [24]. Есть и противоположные данные, в которых, наоборот, было обнаружено снижение, а не повышение экспрессии ER и PR в эндометрии пациенток с наружным генитальным эндометриозом [25].
В нашем исследовании также отмечалось хотя и не значимое, но повышение экспрессии ER у забеременевших пациенток и у пациенток с нормальной толщиной эндометрия. Самые низкие показатели экспрессии ER были выявлены у пациенток с «тонким» эндометрием, у которых беременность не наступила. Данная тенденция была обнаружена как в эпителиальном, так и в стромальном компоненте эндометрия.
Что касается экспрессии PR, то, по данным литературы, у пациенток с наружным генитальным эндометриозом и бесплодием нарушается соотношение PR-A и PR-B, а в эндометриоидных гетеротопиях экспрессия PR-B не выявляется вовсе, что свидетельствует о развитии резистентности к прогестерону [26, 27]. В нашем исследовании отмечалась более высокая экспрессия PR в поверхностном эпителии и железах эндометрия у пациенток с наступившей беременностью и нормальной толщиной эндометрия.
Важным показателем является соотношение PR/ER, которое в норме составляет от 2 до 4 мм [22]. В поверхностном эпителии и железах несколько большее соотношение PR/ER отмечалось в группе наступления беременности, тогда как в строме наибольшее соотношение PR/ER отмечалось у пациенток с ненаступившей беременностью. При этом в нашем исследовании данный показатель был достаточно низким и в среднем в поверхностном эпителии составил 1,18±0,22 в группе наступления беременности и 1,11±0,39 в группе ненаступления беременности, в строме – 1,37±0,52 и 1,92±1,14 в группах соответственно. Данная тенденция, по всей видимости, свидетельствует о важности относительного преобладания PR над ER в поверхностном эпителии эндометрия, вступающего в контакт с бластоцистой.
Что касается важнейшего, по данным литературы, маркера рецептивности – LIF [28, 29], то в нашем исследовании он был слабо выражен, не различался значимо в группах пациенток, хотя и имел тренд к более высокому значению у пациенток с наступившей беременностью и нормальной толщиной эндометрия как в эпителии, так и в строме эндометрия. Наши данные согласуются с данными литературы о том, что у женщин с бесплодием, неудачными попытками программ ВРТ, эндометриозом и привычным выкидышем отмечается снижение экспрессии LIF в период «окна имплантации» [30–32]. При этом в строме эндометрия наблюдалась тенденция к более выраженной экспрессии LIF, по сравнению с эпителием, что отличается от ранее полученных данных другими исследователями [33].
Заключение
«Тонкий» эндометрий играет негативную роль в программах ВРТ, снижая шансы наступления беременности в 1,47 раза. При этом экспрессия маркеров рецептивности, изученная в период «окна имплантации» в цикле, предшествующем овариальной стимуляции и переносу эмбриона, не отражала вероятность наступления беременности в цикле ВРТ и не была связана статистически значимо с толщиной эндометрия, что может свидетельствовать о недостаточной точности представленных маркеров рецептивности и требует дальнейших исследований по поиску более чувствительных и специфичных тест-систем определения рецептивности эндометрия вне цикла зачатия.



