Одним из необходимых условий для успешного проведения программ вспомогательных репродуктивных технологий (ВРТ) является наличие эндометрия с нормальными морфофункциональными характеристиками. Недостаточная толщина эндометрия и снижение его рецептивности ассоциированы с репродуктивными неудачами и отменами программ ВРТ в связи с отсутствием условий для имплантации эмбриона [1].
Согласно результатам последних исследований, «тонкий» эндометрий рассматривают как независимый негативный прогностический фактор в программах ВРТ [2]. Другие авторы рекомендуют рассматривать его в качестве показания для криоконсервации эмбрионов с целью переноса их в полость матки при достижении оптимальной толщины эндометрия [3]. Кроме того, необходимо учитывать, что беременность, наступившая на фоне «тонкого» эндометрия, ассоциирована с риском самопроизвольного прерывания на ранних сроках, развития преждевременных родов и рождения детей с низкой массой тела [4].
Следует отметить, что среди ведущих факторов, негативно влияющих на толщину и рецептивность эндометрия, особо выделяют нарушение гемодинамики в маточных сосудах. Ангиогенез играет ключевую роль в формировании структурно и функционально оптимального эндометрия для имплантации эмбриона. Четкую корреляционную связь между толщиной эндометрия и показателями маточного кровотока отмечают исследователи, изучавшие динамику толщины эндометрия у пациенток в циклах овариальной стимуляции и в естественных циклах [5]. В литературе представлены данные о предиктивной способности показателей субэндометриального кровотока в отношении наступления беременности у пациенток в программах ВРТ [6]. К основным параметрам, определяющим оценку маточной гемодинамики, относят степень васкуляризации миометрия, визуализацию сосудов различного калибра (маточных, аркуатных, радиальных, базальных, спиральных артерий), систолическую и диастолическую составляющие кровотока, величину показателей кривых скоростей кровотока: пульсационного индекса, индекса резистентности, систоло-диастолического отношения [7].
На сегодняшний день основные методы лечения бесплодия, ассоциированного с истончением эндометрия, направлены на стимуляцию его роста и улучшение кровоснабжения матки. Помимо традиционной циклической гормональной терапии, в нашей стране с этой целью широко применяются физиотерапевтические методы [8]. В литературе представлены данные о восстановлении перфузии в маточных сосудах, увеличении толщины эндометрия и частоты наступления беременности после экстракорпорального оплодотворения (ЭКО) при использовании электроимпульсной терапии в комплексном лечении женщин с нарушением репродуктивной функции и «тонким» эндометрием [9]. Другие авторы сообщают о применении низкочастотной магнитотерапии, иглоукалывания и нейромышечной электростимуляции в режиме биологически обратной связи с целью стимуляции роста эндометрия и повышения эффективности программ ЭКО [10].
Новым и перспективным направлением в современной регенеративной и репродуктивной медицине является применение аутологичной плазмы, обогащенной тромбоцитами (Platelet-Rich Plasma – PRP) [11]. Терапевтический эффект применения PRP основан на способности факторов роста, цито- и хемокинов, содержащихся преимущественно в α-гранулах тромбоцитов, запускать процессы биологического синтеза в тканях при дегрануляции последних. Показано, что применение аутологичной PRP не только оказывает стимулирующее действие на пролиферацию клеток благодаря содержащимся факторам роста, но и обладает противовоспалительным и антимикробным свойствами [12]. Использование аутологичной PRP стимулирует процессы клеточной пролиферации и регенерации, а также способствует ангиогенезу [13, 14].
Согласно результатам исследования Tandulwadkar S. et al. (2017), применение аутологичной PRP в цикле переноса размороженных эмбрионов способствует увеличению толщины эндометрия и улучшению показателей гемодинамики в сосудах матки [15]. Опубликованный в 2020 г. метаанализ показал, что внутриматочное введение аутологичной PRP приводит к значительному увеличению толщины эндометрия, частоты наступления имплантации и клинической беременности [16].
Учитывая, что пациентки, включенные в наше исследование, ранее получали физиотерапию, но не отметили значимого эффекта, нами было решено дополнить схему лечения инъекционным введением аутологичной PRP в эндометрий под контролем гистероскопа, согласно разработанной и описанной нами ранее методике [17].
Целью данного исследования является оценка эффективности применения физиотерапии и аутологичной PRP у женщин с бесплодием, обусловленным рефрактерным «тонким» эндометрием.
Материалы и методы
В исследование были включены 68 пациенток репродуктивного возраста с неудачами имплантации после ЭКО и отменой циклов переноса размороженных эмбрионов в анамнезе в связи с неудовлетворительной толщиной эндометрия. Значение толщины эндометрия в период предполагаемого «окна имплантации» у всех пациенток в предыдущих циклах ВРТ на фоне приема циклической гормональной терапии составило ≤7 мм; кроме того, проводимая ранее терапия гормональными препаратами, витаминами и препаратами, улучшающими кровообращение, не имела значимого эффекта.
Все пациентки были разделены на две группы. Пациенткам из основной группы (n=38) подготовка эндометрия к переносу эмбриона проводилась в два этапа: курс физиотерапии (первый цикл), затем инъекционное введение аутологичной PRP в эндометрий с помощью эндоскопической иглы под контролем гистероскопа (следующий цикл). Пациенткам из контрольной группы (n=30) проводили только физиотерапию. Курс физиотерапии был единым для всех пациенток и состоял из процедур электроимпульсной терапии с абдоминально-вагинальным расположением электродов на аппарате BTL-4000 Premium G. Воздействие физическими факторами начинали с 5–7-го дня цикла и проводили ежедневно в течение 10–12 дней. Пациенткам из основной группы (n=38) на втором этапе проводили приготовление и инъекционное введение аутологичной PRP в эндометрий в пролиферативную фазу цикла под контролем гистероскопа, согласно описанной ранее методике [17]. Весь период проведения лечения с учетом последействия физиотерапии пациентки обеих групп использовали барьерную контрацепцию.
Критерии включения в исследование: возраст от 18 до 39 лет, нормальный кариотип пациентки и ее партнера, регулярный овуляторный менструальный цикл, толщина эндометрия не более 7 мм в период предполагаемого «окна имплантации». Критерии невключения: выраженная патоспермия у партнера, использование донорских гамет, преждевременная недостаточность яичников, аномалии развития внутренних половых органов, противопоказания к использованию физических факторов воздействия, системные заболевания крови и коагулопатии, уровень гемоглобина менее 100 г/л, уровень тромбоцитов менее 100×109/л, антиагрегантная и антикоагулянтная терапия на момент включения в исследование.
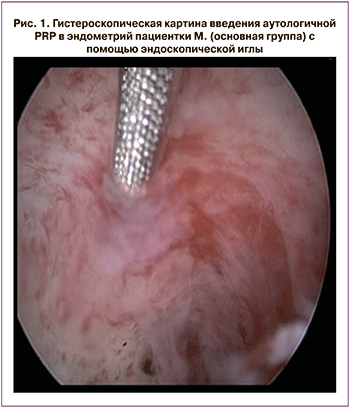 Пациенткам, включенным в исследование, было проведено полное клинико-лабораторное обследование. Всем пациенткам в период предполагаемого «окна имплантации» было выполнено ультразвуковое исследование (УЗИ) органов малого таза c использованием ультразвукового сканера экспертного класса Toshiba-Canon Aplio 500. Использовался полостной монокристальный датчик высокой плотности для оценки толщины и структурности эндометрия и допплерометрического исследования гемодинамики маточных сосудов до и после лечения с учетом последействия физиотерапии. Допплерометрия включала цветовое допплеровское картирование и спектральную допплерометрию. Нормативными считали показатели допплерометрии маточных сосудов в середину лютеиновой фазы цикла у фертильных женщин, которые были систематизированы и верифицированы в исследовании Д.М. Белоусова [18]. При допплерометрическом исследовании проводили оценку визуализации ветвей сосудов матки (маточных, аркуатных, радиальных, базальных и спиральных артерий), симметричности васкуляризации, систолической и диастолической составляющих кровотока, величины показателей уголнезависимых индексов кривых скоростей потока.
Пациенткам, включенным в исследование, было проведено полное клинико-лабораторное обследование. Всем пациенткам в период предполагаемого «окна имплантации» было выполнено ультразвуковое исследование (УЗИ) органов малого таза c использованием ультразвукового сканера экспертного класса Toshiba-Canon Aplio 500. Использовался полостной монокристальный датчик высокой плотности для оценки толщины и структурности эндометрия и допплерометрического исследования гемодинамики маточных сосудов до и после лечения с учетом последействия физиотерапии. Допплерометрия включала цветовое допплеровское картирование и спектральную допплерометрию. Нормативными считали показатели допплерометрии маточных сосудов в середину лютеиновой фазы цикла у фертильных женщин, которые были систематизированы и верифицированы в исследовании Д.М. Белоусова [18]. При допплерометрическом исследовании проводили оценку визуализации ветвей сосудов матки (маточных, аркуатных, радиальных, базальных и спиральных артерий), симметричности васкуляризации, систолической и диастолической составляющих кровотока, величины показателей уголнезависимых индексов кривых скоростей потока.
Пациенткам из основной группы (n=38) после подписания информированного согласия на медицинское вмешательство и участие в исследовании, на 6–8-й день менструального цикла под внутривенной анестезией проводили инъекционное введение 35–40 мл аутологичной PRP в эндометрий на глубину 2–3 мм эндоскопической иглой под контролем гистероскопа. Производили 6–8 вколов иглы с введением аутологичной PRP прицельно в наиболее измененные участки слизистой матки (рис. 1).
В новом менструальном цикле пациентки получали гормональную терапию, начиная с 3–4-го дня. Препараты эстрогенов назначались в виде таблеток эстрадиола валерата для перорального применения. Стартовая доза составила 4 мг эстрадиола валерата в сутки с дальнейшей корректировкой в соответствии с динамикой роста эндометрия. Максимальная суточная дозировка эстрогенов составила 12 мг. Во вторую фазу цикла пациентки получали 400 мг микронизированного прогестерона интравагинально. В середину лютеиновой фазы цикла пациенткам проводились контрольное УЗИ органов малого таза и допплерометрическое исследование маточных сосудов для оценки толщины и структурности эндометрия, показателей маточной гемодинамики после проведенной терапии. Всем пациенткам УЗИ выполнялось одним врачом-экспертом до и после проведения вмешательства.
Статистический анализ
Статистический анализ данных проводили с помощью пакета программ Statistica 10 (США) и программной среды R 3.6.2 (США). Для сравнения количественных переменных между контрольной и основной группами применяли тест Манна–Уитни, для качественных – точный тест Фишера. В случае парных наблюдений качественных переменных применяли тест МакНемара с расчетом точной вероятности в биномиальном тесте. Качественные параметры представлены в виде абсолютных чисел и процентов (%), количественные – Ме и IQR (Ме (Q1;Q3)), где Ме – медиана, Q1 и Q3 – первый и третий квартили. Размер различий между качественными признаками оценивали с помощью отношения шансов (ОШ), а для количественных – с помощью оценки Ходжеса–Леманна и их 95% доверительных интервалов (95% ДИ). Статистически значимыми считали различия между величинами при р<0,05.
Результаты
Возраст пациенток, включенных в исследование, статистически значимо по группам не различался и в среднем составил 37,5 (32;39) года в основной группе и 34,5 (31;37) года – в контрольной (р=0,076). Исследуемые группы пациенток были однородны и значимо не отличались по показателям индекса массы тела, уровням эстрадиола, лютеинизирующего и фолликулостимулирующего гормонов в крови, частоты общей соматической заболеваемости и продолжительности бесплодия. Подавляющее большинство пациенток, включенных в исследование, ранее использовали ВРТ с целью лечения бесплодия. При этом среди пациенток основной группы 89% (34/38) в анамнезе имели отмены переноса эмбриона (ПЭ) в криоциклах в связи с неудовлетворительным ростом эндометрия, несмотря на проводимую терапию; для контрольной группы данный показатель составил 83% (25/30; р=0,5). Интересными представляются данные о длительном (более 3 лет подряд) применении комбинированных оральных контрацептивов (КОК) среди пациенток, включенных в исследование. В основной группе доля этих пациенток составила 24% (9/38), а в контрольной – 27% (8/30) (р=0,079). Статистически значимо исследуемые группы пациенток различались по структуре бесплодия. Первичное бесплодие было установлено у 21% (8/38) пациенток в основной группе и 50% (15/30) – в контрольной; вторичное бесплодие соответственно – у 79% (30/38) пациенток в основной и 50% (15/30) в контрольной (р=0,02). Кроме того, пациентки основной группы имели более отягощенный гинекологический анамнез: неразвивающиеся беременности встречались у 63% (24/38) женщин, среди пациенток контрольной группы данный показатель составил 33% (10/30) (р=0,027). Клинико-анамнестическая характеристика пациенток представлена в таблице 1.

Исходная толщина эндометрия по данным УЗИ в период «окна имплантации» у пациенток, включенных в исследование, статистически значимо не различалась и в среднем составила 5,5 (4;7) мм в основной и 6 (5;7) мм в контрольной группе (р=0,17) (рис. 2).
Результаты контрольного УЗИ в период «окна имплантации» показали, что ни у одной пациентки эндометрий не стал тоньше. Прирост толщины эндометрия был статистически значимо больше в основной группе (95% ДИ для оценки Ходжеса–Леманна 2,0–3,0), чем в контрольной (95% ДИ для оценки Ходжеса–Леманна 1,5–2,0) после проведенного лечения (р<0,001) (табл. 2, рис. 3).
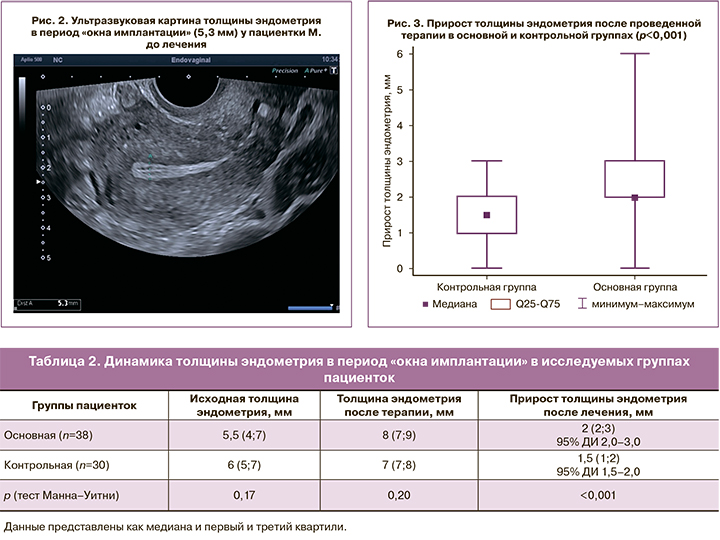
Данные представлены как медиана и первый и третий квартили.
Помимо динамики толщины эндометрия, особое внимание уделяли оценке параметров гемодинамики сосудов матки (табл. 3). При исходной оценке гемодинамики было отмечено, что базальные маточные артерии визуализировались у 84,2% (32/38) пациенток основной группы и 76,6% (23/30) пациенток контрольной группы (р=0,54), для спиральных маточных артерий данные показатели составили 42,1% (16/38) в основной и 56,6% (17/30) в контрольной соответственно (р=0,33). После проведенной терапии в обеих группах у части пациенток, у которых исходно концевые артерии маточных сосудов по данным допплерометрического исследования не визуализировались, было отмечено появление визуализации; при этом ни у одной из пациенток после терапии визуализация не исчезла. В основной группе проведение двухэтапной терапии с применением аутологичной PRP привело к статистически значимому увеличению частоты визуализации как базальных, так и спиральных артерий матки. В контрольной группе, где использовали только физиотерапию, для спиральных артерий улучшение показателя частоты визуализации не достигло статистической значимости (р=0,0625 в критерии МакНемара с расчетом точной вероятности в биномиальном тесте). Среди пациенток, у которых до терапии базальные артерии не визуализировались, возникновение визуализации было отмечено у 75% (6/8; 95% ДИ 35–97%) в основной группе и у 100% (7/7; 95% ДИ 35–97%) в контрольной группе (р=0,47 в точном критерии Фишера). Среди пациенток, у которых до терапии спиральные артерии не визуализировались, возникновение визуализации было отмечено у 55% (12/22; 95% ДИ 32–76%) в основной группе и у 39% (5/13; 95% ДИ 14–68%) в контрольной группе (р=0,49 в точном критерии Фишера). Таким образом, не было выявлено статистически значимых различий в появлении визуализации базальных и спиральных артерий при сравнении двух методов.
После проведенной терапии у части пациенток с ненормальными показателями маточной гемодинамики значения пришли в норму; при этом ни у одной пациентки не было зафиксировано ухудшение показателей гемодинамики. По данным контрольного допплерометрического исследования в обеих группах статистически значимо выросла доля женщин с нормальными показателями гемодинамики сосудов матки (р=0,00003 в основной и р=0,0312 в контрольной). При этом нормализация показателей гемодинамики значимо чаще происходила в основной группе по сравнению с контрольной (р=0,0026 в точном критерии Фишера; ОШ 10,7; 95% ДИ 2,0–80,0) (табл. 3).
Предложенные методы терапии хорошо переносились всеми пациентками. Во время и в период последействия физиотерапии не было отмечено нежелательных реакций среди пациенток. Среди пациенток основной группы не было зафиксировано ни одного случая развития аллергических реакций или инфекционных осложнений после введения аутологичной PRP в эндометрий эндоскопической иглой под контролем гистероскопа.
Обсуждение
Женщины с рефрактерным «тонким» эндометрием составляют сложную группу пациенток клиник ВРТ, так как традиционные методы подготовки эндометрия к циклам ПЭ не оказывают желаемого эффекта, и недостаточный рост эндометрия приводит к отмене циклов ПЭ и неудачам имплантации [1]. Наряду с циклической гормональной терапией, физиотерапия широко применяется в нашей стране с целью подготовки эндометрия к программам ВРТ, однако у части пациенток даже повторные курсы физиотерапии оказываются неэффективными. Единственной возможностью реализовать свою репродуктивную функцию для пациенток с рефрактерным «тонким» эндометрием часто становится суррогатное материнство, что сложно как с финансовой точки зрения, так и морально-этической.
Необходимо отметить, что пациентки, включенные в исследование, составляют сложную группу с отягощающими факторами: длительным бесплодием, репродуктивными неудачами и неоднократными внутриматочными вмешательствами с диагностической и лечебной целью в анамнезе. При этом в основной группе доля пациенток с неразвивающимися беременностями в анамнезе, а также последовавшими за этим хирургическими вмешательствами в полость матки была значимо выше, чем в контрольной.
В данной статье мы продемонстрировали эффективность нового комплексного подхода к терапии женщин с бесплодием, обусловленным рефрактерным «тонким» эндометрием. При этом прицельное введение аутологичной PRP в эндометрий пациенток с помощью эндоскопической иглы во время гистероскопии позволило достичь статистически значимого увеличения толщины эндометрия и улучшения показателей гемодинамики сосудов матки по данным контрольного УЗИ по сравнению с пациентками контрольной группы, которым проводили только курс физиотерапии.
В литературе представлены данные о корреляции показателей гемодинамики сосудов матки с толщиной эндометрия [5, 9]. В нашей работе среди пациенток с «тонким» эндометрием на этапе включения в исследование также было отмечено снижение визуализации концевых маточных артерий по сравнению с данными показателями гемодинамики у здоровых женщин. Нормативными показателями для здоровых женщин считают визуализацию базальных артерий в 100% случаев, спиральных – в 71% при допплерометрическом исследовании [18].
На сегодняшний день в литературе доступны работы с описанием применения внутриматочного орошения аутологичной PRP в дополнение к гормональной терапии у пациенток с «тонким» эндометрием при подготовке к проведению программ ВРТ [15, 16]. Однако данный метод имеет ряд ограничений, связанных с отсутствием единого протокола применения и существованием различных медицинских изделий для получения аутологичной PRP без контроля концентрации тромбоцитов в ней. Кроме того, инфузионное введение аутологичной PRP (внутриматочное орошение) происходит без визуального контроля, и специалист, производящий манипуляцию, может ввести объем, ограниченный 2–3 мл. Вследствие этого, для достижения терапевтического эффекта возникает необходимость в проведении повторных процедур забора крови, приготовления PRP и очередной внутриматочной манипуляции с целью введения PRP. Разработанная нами технология позволяет ограничиться 1 процедурой инъекционного введения аутологичной PRP непосредственно в измененные участки эндометрия пациентки под контролем гистероскопа.
Заключение
Отсутствие единого эффективного подхода к терапии пациенток с рефрактерным «тонким» эндометрием обусловливает необходимость поиска новых решений в лечении маточного фактора бесплодия. Преимуществом новой технологии инъекционного введения в эндометрий аутологичной PRP является возможность визуальной оценки состояния слизистой матки, прицельного воздействия на наиболее гипотрофичные и измененные участки ткани, введения достаточного объема PRP, что обеспечивает отсутствие необходимости в проведении повторных вмешательств. Таким образом, согласно результатам нашего исследования, считаем возможным рекомендовать новый комплексный подход в подготовке пациенток с рефрактерным «тонким» эндометрием к программам ВРТ.



