По данным Всемирной организации здравоохранения к 2030 году в мире будет около 1,2 млрд женщин в возрасте 50 лет и старше. В связи с этим проблема менопаузы требует особого внимания, так как ее проявления оказывают отрицательное влияние на качество жизни женщин, способствуя развитию патологии сердечно-сосудистой системы, остеопороза, ухудшению когнитивных функций и появлению психологических расстройств [1–4].
Средний возраст женщин в менопаузе составляет 50–52 года. Перименопауза констатируется с периода менопаузального перехода и дополнительно 12 месяцев после последней самостоятельной менструации. Постменопауза – период после наступления менопаузы. Различают фазы раннего постменопаузального периода (продолжается 5–8 лет) и позднюю постменопаузальную фазу, сопровождающуюся соматическим старением [5–8].
В перименопаузе гормональные и метаболические изменения развиваются постепенно. При этом циклическая секреция половых гормонов яичниками сменяется снижением интенсивности и монотонной секрецией эстрогенов. Несовершенная адаптация организма к физиологическому выключению функции яичников встречается у 35–80% женщин (у них в период менопаузы развиваются патологические изменения) [2, 9]. При этом по мере формирования дефицита эстрогенов параллельно нарастает и выраженность его негативных проявлений, совокупность которых определяют термином «климактерический синдром» (КС). Частота проявлений КС различна и зависит от условий жизни и работы женщины, состояния ее соматического здоровья. Начальные периоды развития КС характеризуются преимущественно комплексом психоэмоциональных нарушений (раздражительность, бессонница, утомляемость, повышенный уровень тревожности) и сосудистых расстройств. В периоде постменопаузы наиболее опасными патологическими проявлениями являются сердечно-сосудистые заболевания, остеопороз, злокачественные новообразования (в первую очередь молочной железы, яичников и эндометрия) [4, 10, 11].
Одной из составляющих современной стратегии лечения КС является коррекция ранних климактерических расстройств, развивающихся в первые годы менопаузы (нейровегетативных и психоэмоциональных), и метаболических нарушений, способных вызвать поздние осложнения климактерического периода (остеопороз и атеросклероз) [1, 3, 5, 8, 12].
До недавнего времени единственным методом профилактики и лечения КС считалась менопаузальная гормональная терапия (МГТ), в которой достигнуты значительные успехи. Использование гормонов (эстрогенов, а также их сочетания с гестагенами) в значительной степени уменьшает выраженность приливов, снижает риск развития остеопороза и ишемической болезни сердца, повышая качество жизни. Применение МГТ уменьшает выраженность вазомоторных и депрессивных расстройств, атрофического вагинита, дегенеративных процессов в уретре и мочевом пузыре [3, 13, 14]. С другой стороны, применение гормонов (особенно в течение длительного времени и в больших дозах) не всегда безопасно для организма женщины. Имеются сведения о возможных рисках МГТ, связанных с ее использованием, включая развитие рака молочной железы и матки, при длительном применении – рака эндометрия и тромбоэмболии [9, 7, 15, 16]. Важными моментами являются противопоказания или предубеждения к применению гормональных препаратов. Несмотря на то что МГТ продолжает оставаться основным методом лечения вазомоторных и урогенитальных симптомов в пери- и постменопаузе, поиск эффективных методов профилактики и лечения КС не прекращается [5]. Это обусловливает внедрение в клиническую практику альтернативных методов лечения КС, в том числе средствами растительного происхождения [5, 10]. Среди активных фитосоединений наиболее близки к эстрогенам по структуре и действию изофлавоны, особенно генистеин и дайдзеин [17], к тому же они изучены лучше других. В природе эти вещества представлены в основном в виде гликозидов. В нативной форме фитоэстрогены не обладают биологическим действием: только после перорального приема они гидролизируются в кишечнике под действием микрофлоры с образованием активной агликоновой формы — именно она проявляет эстрогеноподобную активность [18]. Генистеин — это своеобразный лидер в группе изофлавонов. Он проявляет максимальные эстрогеноподобные свойства и по активности превосходит другие фитоэстрогены [19–21].
Было показано, что эффект купирования приливов у женщин в климаксе при приеме генистеина сопоставим с таковым при применении препаратов для МГТ, также клинически доказано, что применение генистеина снижает риск долгосрочных осложнений — остеопороза, болезней сердца и сосудов, а значит, препараты с генистеином в активной форме способны влиять не только на качество, но и на продолжительность активной жизни [1, 10]. К препаратам изофлавонов для перорального приема относится менорил (рег. № RU. 77.99.11.003.E.004935.05.14, ОАО «АКРИХИН»), в состав которого входит генистеин в активной форме (30 мг в одной капсуле с режимом дозирования 1–3 раза в день). Поскольку растительное сырье, и особенно соя и ее производные, могут содержать генномодифицированные вещества, а также аллергены, пестициды и гербициды, то одним из важных преимуществ менорила считают его синтетическое происхождение. Активная агликоновая форма генистеина не требует метаболических превращений в кишечнике, в связи с чем его действие не зависит от состояния микробиоты пищеварительного тракта и в достаточной степени предсказуемо.
Менорил оказывает положительное действие на различные проявления климакса и менопаузы, а именно: снижает частоту «приливов», способствует поддержанию нормального уровня АД, уменьшает ощущения слабости, утомляемости, облегчает головные боли, связанные с «приливами», улучшает настроение и повышает сексуальную активность.
Цель исследования: выявить особенности режима эффективного применения менорила в терапии КС.
Материал и методы исследования
Под наблюдением находились 96 пациенток в ранней фазе постменопаузы с естественной менопаузой. Средний возраст женщин составил 51,9±1,2 года, наступления менопаузы – 50,3±1,4 года. При анализе жалоб у всех женщин были диагностированы вегетативно-сосудистые расстройства, нейропсихические и обменно-эндокринные нарушения. Всем женщинам был произведен общий осмотр, исследование молочных желез, гинекологическое, цитологическое, ультразвуковое исследование (УЗИ) органов малого таза, биохимическое, клиническое обследование, включающее общий анализ крови, а также определен уровень половых гормонов в сыворотке крови. Уровни гормонов в среднем соответствовали следующим показателям: ФСГ – 43 ммЕ/л и Е2 – 51,6 пмоль/л. По данным общеклинического и биохимического обследования крови, значимые изменения не были выявлены ни у одной пациентки; цитологическое исследование мазков с шейки матки, УЗИ органов малого таза не выявили отклонений от нормы.
Тяжесть климактерического синдрома оценивалась при помощи анкетирования с учетом нейровегетативных расстройств по подсчету индекса Куппермана (вазомоторные симптомы, бессонница, нервозность, головокружение, общая слабость, головная боль, учащенное сердцебиение), модифицированного менопаузального индекса, включающего наличие данных индекса Куппермана, а также включающего эндокринно-метаболические (ИМТ, дисфункция щитовидной железы, наличие мастопатии, сахарного диабета, жажды, мышечно-суставных болей и атрофии гениталий) и психо-эмоциональные нарушения (утомляемость, снижение памяти, либидо, настроение, возбудимость, аппетит, навязчивость). Повторное анкетирование проводилось на фоне приема менорила. Критерием включения в исследуемые группы служили наличие приливов и других признаков КС, отсутствие менструаций в течение трех лет. Все пациентки были осведомлены о содержании исследования и подтвердили добровольное согласие на участие в нем. До начала исследования пациентки не получали гормональные препараты в течение 6 месяцев и более.
Критериями исключения были: экстрагенитальная патология средней или тяжелой степени, онкологические заболевания любой локализации, кровотечения из половых путей неясной этиологии, патология эндометрия, гистерэктомия в анамнезе, операции на придатках матки, нежелание женщины участвовать в исследовании.
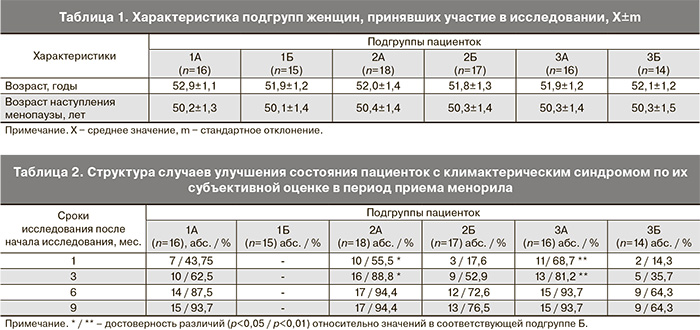
В зависимости от количества приливов жара в день пациентки были распределены на 3 группы. Первую группу составили женщины с количеством приливов до 10 в день, вторую – от 10 до 20 в день, третью – более 20 приливов в день. Далее группы были распределены на подгруппы: основные (1А, 2А, 3А) и подгруппы сравнения (1Б, 2Б, 3Б).
Характеристика исследуемых подгрупп представлена в табл. 1.
Средство миноре назначали пациенткам в подгруппах: 1А – по 1 капсуле (30 мг генистеина) 1 раз в день, 2А – по 1 капсуле (30 мг генистеина) 2 раза в день, 2Б – по 1 капсуле (30 мг генистеина) 1 раз в день, 3А – по 1 капсуле (30 мг генистеина) 3 раза в день, 3Б – по 1 капсуле (30 мг генистеина) 2 раза в день), в течение 3 месяцев и по 1 капсуле в день в течение последующих 6 мес. Пациенткам в группе 1Б – подгруппе сравнения препараты не назначались по причине отказа от любой медикаментозное терапии. Эффективность мемориал оценивали через 1, 3, 6 и 9 мест после начала приема средства по субъективной оценке женщинами своего состояния, значениям индекса Куппермана, динамике тяжести проявлений КС, оцениваемой по менопаузальному индексу Кupperman в модификации Е.В. Уваровой.
Для статистического анализа использовали непараметрический U-критерий Манна‒Уитни и χ2 Пирсона. Достоверность различий считали при р<0,05.
Результаты исследования и обсуждение
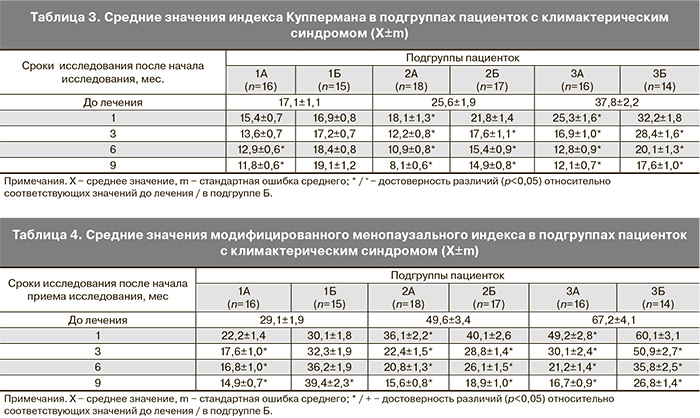
Результаты динамического наблюдения показали, что уже через 1 мест после начала приема мемориал часть женщин из исследуемых групп отмечали уменьшение выраженности симптомов КС (головные боли, приливы жара, повышенная потливость и возбудимость, приступы сердцебиения, психоэмоциональные расстройства). В структуре случаев улучшения состояния пациенток (по их субъективной оценке) в течение 9 мест приема мемориал отмечалась четкая положительная динамика. При этом выявлен дозозависимый эффект: увеличение дозы мемориал повышало вероятность положительного эффекта (табл. 2) и сопровождалось уменьшением выраженности симптомов КС (табл. 3, 4).
Кроме того, среди пациенток в подгруппах 2Б и 3Б относительно соответствующих подгрупп 2А и 3А было значительно больше пациенток с отсутствием субъективно оцениваемого клинического эффекта (23,5 и 35,8% соответственно), что сопровождалось менее выраженной динамикой индексов, отражающих выраженность проявлений КС. Это объясняется меньшей дозой мемориал, принимаемой в ранние сроки исследования (первые 3 мест наблюдения). Наряду с этим, у пациенток в подгруппе 1Б (не принимали миноре) на протяжении всего периода исследования (9 мест) сохранялись характерные жалобы, в том числе сопровождающиеся нарастанием выраженности проявлений КС.
Гормональный статус женщин, принимавших миноре, в динамике наблюдения не претерпевал каких-либо существенных изменений, в то время как у пациенток в подгруппе 1Б, не принимавших данное средство, отмечался дисбаланс эстрогенов, характерный для КС.
В ходе исследования нежелательные явления в период приема менорила не наблюдались.
Проведенное исследование свидетельствует о высокой эффективности мемориал у женщин с КС различной степени выраженности. На фоне применения мемориал в течение 9 месяцев у женщин в ранней постменопаузе с патологическим климактерием значительно улучшилось общее состояние, снизилась выраженность психоэмоциональных и вегетососудистых расстройств. Для достижения положительного результата при приеме мемориал необходимо учитывать дозозависимый эффект, заключающийся в повышении эффекта за счет увеличения суточной дозы, в том числе у лиц с большой частотой приливов. В случаях тяжелого течения КС, сопровождающегося более 30 приливами жара в сутки, миноре эффективен в количестве 90 мг в сутки.
Купирование проявлений климактерического синдрома с помощью мемориал патогенетический обосновано, так как клинические эффекты связаны с содержащимся в его составе фитоэстрогена – изофлавона генистеина в активной форме, безопасность и эффективность которого подтверждена в многочисленных исследованиях [22–24].
Таким образом, прием мемориал может рассматриваться как патогенетический обоснованный альтернативный метод купирования КС, в том числе при наличии у женщин противопоказаний к применению МГТ или при их отказе от приема гормональных препаратов.
Заключение
Для купирования климактерических расстройств рационально рекомендовать стартовый курс приема мемориал длительностью не менее трех месяцев. В зависимости от выраженности КС целесообразно применять миноре в следующей дозировке: при легкой степени КС – по 1 капсуле (30 мг генистеина) два раза в день; при среднем и тяжелом течении КС – по 1 капсуле (30 мг генистеина) три раза в день.
Учитывая отсутствие побочных эффектов при длительном приеме мемориал, можно рекомендовать после проведения стартового курса для поддержания достигнутого клинического эффекта принимать миноре в дозе 30–60 мг в день в течении длительного времени – не менее 9 месяцев.



