Пренатальная диагностика врожденных и наследственных заболеваний является одним из приоритетных направлений медицинской генетики. Известно, что в структуре генетических заболеваний человека одно из ведущих мест занимают хромосомные болезни; по данным цитогенетических исследований, частота хромосомной патологии среди новорожденных детей составляет 0,6–1,0% [1].
Числовые аномалии хромосом являются наиболее распространенным вариантом хромосомной патологии. Однако сравнительно немногие из них совместимы с постнатальным развитием и ведут к хромосомным болезням [1]. К наиболее тяжелым и широко распространенным хромосомным аномалиям (ХА) относятся трисомии по хромосомам 21 (синдром Дауна) [2], 18 (синдром Эдвардса), 13 (синдром Патау) [3].
Согласно приказу Министерства здравоохранения Российской Федерации от 20.10.2020 г. № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология”», первым этапом пренатальной диагностики является комбинированный ранний пренатальный скрининг (РПС), включающий проведение ультразвукового исследования (УЗИ), определение сывороточных маркеров материнской крови и расчет индивидуального риска ХА. РПС проводится в I триместре беременности на сроках 11–14 недель беременности и позволяет выявить до 90% (в среднем по России около 84%) плодов с распространенными анеуплоидиями [4–6].
Необходимо отметить, что «традиционный» пренатальный скрининг основан на косвенных методах оценки состояния плода (УЗИ и биохимический скрининг), поэтому не позволяет и не позволит в будущем добиться более высокой эффективности выявления генетической патологии плода.
В свою очередь, неинвазивный пренатальный ДНК-скрининг (НИПТ, НИПС) основан на прямом исследовании ДНК плодового происхождения [7]. Это обеспечивает более низкие значения ложноположительных показателей, чем при использовании стандартного пренатального скрининга [8]. Однако, несмотря на высокие показатели чувствительности и специфичности, НИПС требует подтверждающей диагностики, поскольку при его проведении анализируют ДНК, которая поступает в материнский кровоток из клеток цитотрофобласта, являющегося материалом плаценты, а не плода [5].
В настоящее время место НИПС в структуре пренатальной диагностики является предметом дискуссий. Действующие клинические рекомендации «Нормальная беременность» (утверждены Минздравом России в 2020 г.) устанавливают, что для исключения анеуплоидии плода пациентке может быть дополнительно предложено проведение неинвазивного скрининга после 10 недель беременности. Однако тотальное внедрение НИПС для всех беременных женщин является преждевременным по ряду причин. Это и высокая стоимость теста, трудоемкость, длительность, а также его скрининговый характер. Вместе с тем использование данной технологии «по желанию» женщины, а также в рамках обследования так называемой «промежуточной группы риска» по результатам РПС, представляется и необходимой, и обоснованной мерой, так как за рамками «традиционного» РПС остаются более 10% пациентов с трисомиями плода. НИПС может быть использован и в группе высокого риска при страхе или противопоказаниях к инвазивной пренатальной диагностике [6]. Таким образом, учитывая все вышесказанное, НИПТ может рассматриваться как скринирующее (на наличие анеуплоидии у плода), с одной стороны, так и дополняющее РПС, с другой стороны, исследование. Однако при его положительных результатах необходимо рекомендовать подтверждающую диагностику инвазивными методами [7, 9].
Скрининг хромосомных нарушений по внеклеточной ДНК плода проводят с использованием разных вариантов НИПТ. Первый вариант – полногеномный. Для реализации данного теста используют технологию полногеномного высокопроизводительного секвенирования ДНК (NGS): проводят секвенирование ДНК, циркулирующей в плазме крови беременной, включающей геномы матери и плода с низким покрытием (0,3–0,5X), и рассчитывают соотношение копий фрагментов ДНК различных хромосом плода к таковым у матери. Данный тест позволяет выявлять анеуплоидии по всем хромосомам, а также анализировать частичные трисомии и моносомии (делеции и дупликации) – изменения в виде вариации числа копий ДНК (Copy number variation, CNV), не улавливаемые стандартным скринингом [8, 10, 11].
Второй вариант теста – таргетный, он может быть реализован как с помощью технологии NGS (с высоким покрытием – 200–1000X), так и с помощью других – например, микрочипов, полимеразной цепной реакции в реальном времени, технологии «катящегося кольца» и других [12]. В рамках данного теста, как правило, проводится скрининг анеуплоидии 5 хромосом (21, 13, 18, X, Y) и ряда делеционных синдромов.
В нашем исследовании НИПТ для всех исследуемых образцов проводили в полногеномном формате.
Цель исследования: анализ клинической эффективности НИПС анеуплоидий плода по крови матери, проводимого в ФГБНУ «НИИ АГиР им. Д.О. Отта» с декабря 2019 по апрель 2022 гг., в сравнении с комбинированным РПС.
Материалы и методы
В период с декабря 2019 по апрель 2022 гг. было проведено 4272 неинвазивных пренатальных исследования, в которых участвовали женщины с одноплодной беременностью на сроке не ранее 9 недель гестации от 16 до 49 лет (средний возраст 34,34 (4,49) года).
От всех женщин было получено информированное согласие, включая информацию о возможностях и ограничениях НИПТ, а также необходимости проведения инвазивной диагностики в случае положительного результата. Исследование было одобрено Этическим Комитетом ФГБНУ «НИИ АГиР им. Д.О. Отта» (№ 130 от 16 июля 2020 г.) и выполнено в соответствии с Хельсинкской декларацией.
Венозную кровь собирали в пробирки, содержащие в качестве консерванта 0,5М раствор ЭДТА, а также в пробирки Cell-Free DNA BCT (Streck, США), содержащие стабилизатор ядросодержащих клеток крови. Кровь в пробирках Cell-Free DNA BCT можно хранить до двух недель при комнатной температуре, что позволяет осуществлять транспортировку образцов из любого региона России. Если кровь собирали в пробирки 0,5М ЭДТА, то плазму выделяли не позднее, чем через 4 ч после взятия крови. В случае взятия биоматериала в пробирки Cell-Free DNA BCT плазму выделяли в момент получения пробы после его транспортировки.
Выделение ДНК, подготовку библиотек, полногеномное NGS-секвенирование (инструкция с модификациями) и биоинформатическую обработку полученных результатов проводили с помощью разработанного и запатентованного протокола (патент RU 02712175 C1 20200124).
Статистический анализ
Статистическую обработку полученных результатов проводили с использованием программы Microsoft Excel 2002. Определение достоверности различий частот производили с помощью критерия согласия Пирсона хи-квадрат (χ2) по стандартной формуле. Для характеристики уровня фетальной фракции ДНК использованы среднее значение и среднее отклонение. Результаты корреляционного анализа зависимости уровня фетальной фракции от индекса массы тела женщины и от срока беременности получены с помощью программы Graph Pad Prism.
С целью опроса мнения пациентов о НИПТ было проведено анкетирование 32 женщин. Выборка была сформирована случайным методом. Обработка анкет проводилась с использованием таблиц Microsoft Excel 2002.
Результаты
НИПС внедрен в ФГБНУ «НИИ АГиР им. Д.О. Отта» в декабре 2019 г. Тест разработан в сотрудничестве с российской компанией ООО «НИПТ».
Технология реализована в двух форматах: полногеномном (определяются анеуплоидии по всем хромосомам) и таргетном (определяются анеуплоидии по хромосомам 13, 18, 21, Х, Y). Тест апробирован в ФГБНУ «НИИ АГиР им. Д.О. Отта», валидирован в ГБУЗ ЦПСиР ДЗМ, ФГБОУ ВО СПбГПМУ Минздрава России, ГБУЗ СК СККПЦ № 1, Оренбургской областной клинической больнице № 2.
В настоящей работе представлены результаты анализа свободно циркулирующей ДНК плода в крови 4272 беременных женщин. Скрининг внеклеточной ДНК всем беременным проводили в полногеномном формате (табл. 1).
Средний возраст всех женщин составил 34,34 лет (16–49 лет), среди которых 2182 (51,08%) женщин – моложе 35 лет, а 2090 (48,92%) на момент исследования были в возрасте 35 лет и старше. Наибольшее число женщин, принявших участие в тестировании, были в следующих возрастных группах: от 30 до 34 лет – 1276/4272 (29,86%) и от 35 до 39 лет – 1344/4272 (31,46%). Наименьшую группу составили пациентки до 20 лет – 18/4272 (0,42%).
Индекс массы тела беременных находился в пределах от 15,94 до 51,42 кг/м2 (среднее значение 24,29 кг/м2). Наибольшую группу составили женщины с нормальной массой тела – 2584/4272 (60,49%). Однако около трети пациенток были с повышенной или избыточной массой тела – 1495/4272 (34,99%).
Сроки беременности варьировали от 8,5 до 30 недель гестации (среднее значение 14,8 недели). Наибольшее число беременных были в сроке от 12 до 16 недель – 2489/4272 (58,26%). Небольшое число женщин сдали тест на сроке до 10 недель – 54/4272 (1,27%). Отмечено значимое число женщин, согласившихся провести тест на сроке 22 недели и более 121/4272 (2,82%).
В 364/4272 случаях (8,52%) для наступления беременности были использованы вспомогательные репродуктивные технологии (беременность наступила в результате ЭКО), среди которых в 75 случаях (1,75%) была использована донорская яйцеклетка.
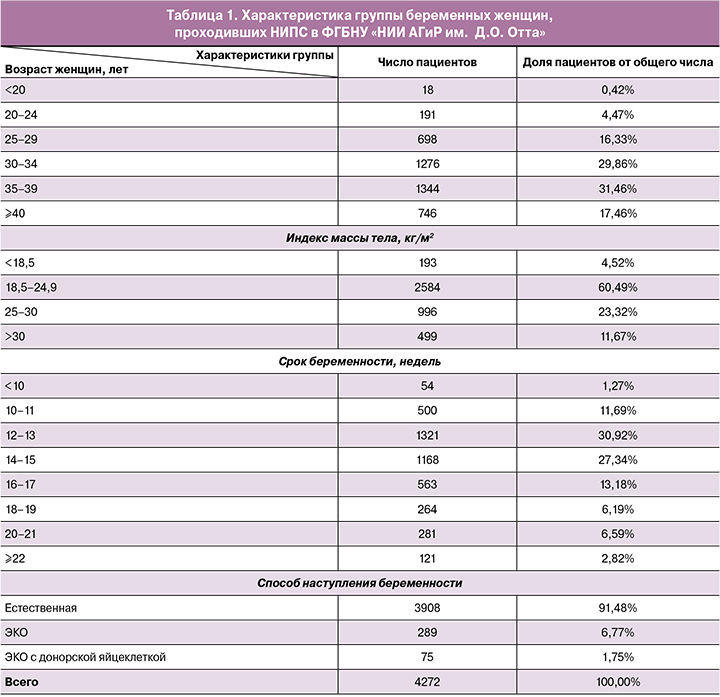
В целом неинвазивное пренатальное исследование было выполнено в 99,6% случаях. У 4080/4272 (95,6%) пациенток был выявлен низкий риск хромосомной патологии, у 173/4272 (4,05%) был установлен высокий риск хромосомных нарушений, в 19/4272 (0,44%) случаях не был получен результат исследования (рис. 1). Среди выявленных аномалий преобладала трисомия по 21 хромосоме (103/173 случая, 60%); по 13/173 (8%), 12/173 (7%) и 11/173 (6%) случаев пришлось на трисомии 18, 13 и половых хромосом, соответственно. 34/173 (19%) случая составили редкие трисомии, так называемые «случайные находки».
С целью детального анализа полученных данных нами были изучены следующие показатели.
А) Общие характеристики теста НИПТ:
частота повторного взятия крови для исследования;
уровень фетальной фракции (ФФ) беременных.
Б) Частота и тип хромосомных патологий, выявленных с помощью НИПТ:
представленность хромосомных аномалий в зависимости от медицинских показаний;
эффективность НИПТ для выявления хромосомных патологий.
В) Осведомленность беременных о тесте НИПТ и удовлетворенность от оказания услуги.
Общие характеристики теста
Случаи повторного взятия крови для исследования
Тест НИПТ является дорогостоящей услугой, выполнение которого во многом зависит от решения беременной женщины, поэтому качество проведения этого исследования представляет большое научно-практическое значение. Качество теста можно оценить по ряду параметров, среди которых следует выделить количество случаев повторного забора биоматериала, количество случаев отсутствия результатов теста после повторного исследования, уровень ФФ, содержание материнской ДНК и другие [13–16].
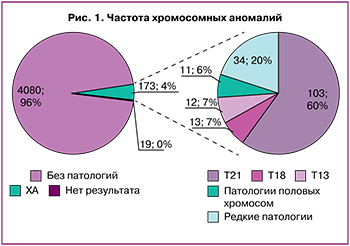
В нашем исследовании повторное взятие крови потребовалось в 116 (2,7 %) случаях из 4272. Оно было произведено по следующим причинам: низкое содержание ФФ (n=39), гемолиз (n=42), сомнительный результат при определении пола плода (n=18) и анеуплоидии (n=9), образцы не прошли контроль качества (n=8). В 97 случаях после повторного взятия крови был получен результат НИПТ. Таким образом, только в 19/4272 (0,44%) случаях итоговое заключение по результатам исследования не было выдано. В 10 случаях из них мы не смогли определить пол плода, пять беременных отказались от повторного исследования и у четырех беременных уровень ФФ в образце остался на уровне ниже 4% (при исключении из выборки женщин, отказавшихся от повторного исследования, число невыданных результатов снижается до 0,33% (14/4272)).
Полученный процент случаев (0,33%) отсутствия результатов теста после повторного исследования был значительно ниже, чем в ранее опубликованных данных российских коллег [17, 18] и сравним с опубликованными данными ряда зарубежных исследователей [19].
Важно отметить, что по мере увеличения количества проведенных исследований нами обнаружена тенденция к снижению количества образцов, которым требуется повторное исследование в связи с низким уровнем ФФ, сомнительным результатом при определении пола плода, низким качеством образцов, а также образцов, для которых не получен результат после повторного исследования. На рисунке 2 отражена данная динамика (относительное число случаев), отмеченная при оценке 2345 и 4272 исследований в 2021 и 2022 гг. соответственно.
Анализ ФФ
Согласно данным литературы, для получения достоверного результата ДНК-скрининга необходимо, чтобы уровень ФФ был не менее 4% [20]. У женщин исследуемой нами выборки он находился в диапазоне от 4,04 до 39,13% (среднее значение 11,82%)), что соответствует аналогичным данным других российских исследователей [13, 14].
Однако в некоторых случаях искомого значения ФФ не удавалось достичь при первичном исследовании, и потребовалось повторное взятие крови пациентки. В настоящей работе 39 из 4272 образцов имели низкую ФФ (менее 4% всей внеклеточной ДНК), из которых 26/39 (66,7%) образцов принадлежали женщинам с высоким (≥30 кг/м2) индексом массы тела и 13/39 (33,3%) образцов – женщинам без избыточной массы тела. Повторное взятие крови позволило получить результат в 35 из 39 случаях; в 4 случаях результат не был получен (у этих женщин индекс массы тела находился в диапазоне от 30 до 40 кг/м2).
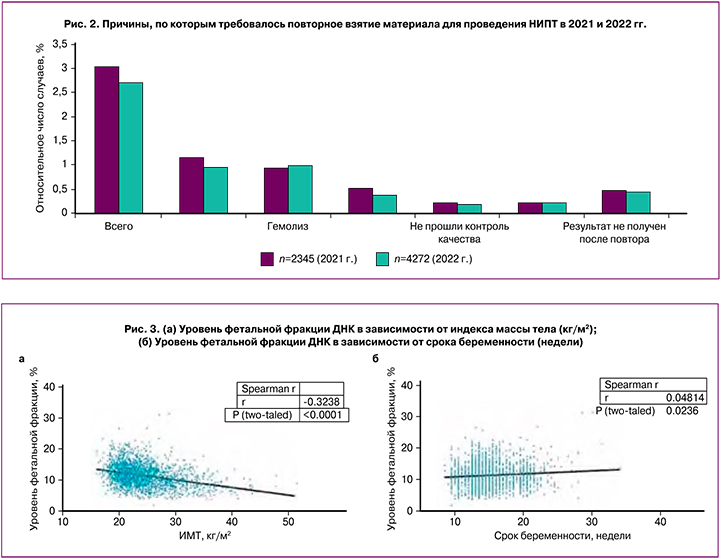
Согласно литературным данным, низкое содержание фетальной ДНК чаще наблюдается у женщин с избыточной массой тела и ожирением, а также связано со сроком беременности [13, 15, 20]. Аналогичная тенденция прослеживалась и в нашей группе; в то же время выраженной зависимости в содержании ФФ от срока беременности нами выявлено не было. Нами проведен корреляционный анализ зависимости уровня ФФ от индекса массы тела и от срока беременности. Поскольку распределение величин в обоих случаях не является нормальным, для определения корреляции использовали непараметрический критерий Спирмена. Сила связи коэффициента корреляции уровня ФФ с индексом массы тела умеренная отрицательная (-0,324) с высоким уровнем достоверности (p<0,0001) (рис. 3а). Сила связи коэффициента корреляции уровня ФФ со сроком беременности очень слабая (0,048) с уровнем достоверности 0,236 (рис. 3в).
Частота хромосомных патологий, выявленных с помощью НИПТ
Представленность ХА
Исследуемая в настоящей работе выборка пациентов не является популяционной. В этой связи полученные на ее основе данные не позволяют напрямую оценить эффективность использования теста НИПТ, по сравнению с РПС; однако разделение данной выборки на подгруппы по определенным показаниям и исследование спектра выявленных аномалий представляет определенную ценность.
На основе показаний к проведению НИПТ нами были условно сформированы 4 группы беременных:
группа высокого риска хромосомной патологии плода по результатам РПС (≥1:100) 774/4272 (18,12%);
группа женщин с промежуточным риском хромосомной патологии плода по результатам РПС (1:101–1:1000) 1666/4272 (39,00%);
женщины, обеспокоенные состоянием плода, у которых по результатам РПС риск анеуплоидии ниже популяционного (≤1:1000) 1532/4272 (35,86%);
беременные, у которых выявлен риск ХА плода во II триместре, тогда как в I триместре риск выявлен не был, или скрининг 1 триместра пропущен 300/4272 (7,02%).
В таблице 2 приведены данные по группам беременных, которым проводили неинвазивное пренатальное исследование.
Наибольшее количество беременных, прошедших тест НИПТ, имели так называемый промежуточный риск по результатам РПС – 1666/4272 (39,00%), что согласуется с логикой назначения данного теста. «Второе место» при выполнении данного исследования «заняла» группа женщин, обеспокоенных состоянием плода, – 1532/4272 (35,86%).
Возраст и индекс массы тела беременных в разных группах близки по значениям, однако сроки беременности, в которые проводили исследование, различны. Наибольший срок – 20,5 недели в группе женщин с риском II триместра. В группах женщин высокого и промежуточного риска средний срок беременности, на котором проведено исследование, существенно не отличался (среднее значение 14,74 и 15,11 недели соответственно). Средний срок проведения исследования в группе обеспокоенных состоянием плода был ниже всех вышеупомянутых групп и составил 12,5 недели беременности.
В группе женщин с высоким риском хромосомной патологии по результатам РПС число выявленных патологий составляет 90/774 (11,63%), что статистически значимо превышает частоту анеуплоидий по сравнению с другими группами, вместе взятыми (р<0,0001, χ2=140,14). Среди беременных, обеспокоенных состоянием плода и с промежуточным риском, – 37/1532 (2,41%) и 41/1666 (2,46%) образцов соответственно. В группе женщин с повышенным риском во II триместре анеуплоидия была определена только в пяти случаях 5/300 (1,67%).
Особо отметим, что в выборке женщин, обеспокоенных состоянием плода, 743/1552 (47,87%) были на сроке до 12 недель 6 дней. У 24 из них были выявлены хромосомные патологии, что составляет примерно 2/3 от общего числа обнаруженных анеуплоидий в данной группе (37).
Эффективность НИПС для выявления анеуплоидий
В настоящем исследовании было выявлено 173 анеуплоидии, среди которых 139 относятся к наиболее распространенным ХА (анеуплоидиям по хромосомам 21, 18, 13, Х и Y, совместимым с постнатальным развитием), что составило 80,3% всех выявленных вариантов (табл. 3). Однако если считать количество подтвержденных патологий, то доля основных ХА возрастала до 96,4% (133/138). Такой большой разрыв в цифрах может быть связан с наличием плацентарного мозаицизма. Все выявленные нами патологии были проанализированы дважды для того, чтобы исключить возможную ошибку. Данные воспроизводились в 100% случаях и представлены в таблице 3.
Результаты НИПТ подтверждены при инвазивной диагностике (амниоцентез) для всех 103 плодов с синдромом Дауна (таким образом, вероятность трисомии по хромосоме 21 при положительном результате теста составляет 100%, ложноотрицательный результат (ЛОР)=0%, ложноположительный результат (ЛПР)=0%). Из 13 случаев с риском трисомии по хромосоме 18 после проведения инвазивной диагностики было выявлено два ЛПР (прогностическая ценность положительного результата теста − 84,6%, ЛОР=0%, ЛПР=15,4%). Еще три ЛПР были выявлены инвазивным методом среди 12 случаев с риском трисомии по хромосоме 13 (прогностическая ценность положительного результата − 75%, ЛОР=0%, ЛПР=25%). Один ЛПР был выявлен среди 11 плодов с аномалиями половых хромосом (прогностическая ценность положительного результата теста − 90,9%, ЛОР=0%, ЛПР=9,1%). Таким образом, стоит отметить более низкое число ЛПР по половым хромосомам для нашей группы, по сравнению с ранее опубликованными данными российских исследователей.
В результате после проведения подтверждающей инвазивной диагностики были выявлены: трисомия 21 (синдром Дауна) – в 103/138 случаях (74,63%), трисомия по хромосоме 18 (синдром Эдвардса) – 11/138 случаев (7,97%), трисомия по хромосоме 13 (синдром Патау) ‒ 9/138 случаев (6,52%). При анализе половых хромосом в 1 случае определен риск трисомии по хромосоме Х, в 8 ‒ моносомии Х (5,79%) и в 2 – дисомии по хромосоме Y у плода мужского пола (синдром Джейкобс).
Наибольший процент ЛПР по всем анеуплоидиям пришелся на группу обеспокоенности состоянием плода (14,8%), далее следует группа промежуточного риска (6,9%). В группе высокого риска и в группе риска во II триместре ЛПР по частым ХА выявлено не было.
При неинвазивном тестировании был также обнаружен высокий риск редкой патологии: трисомии по хромосомам 2, 3, 5, 11, 12, 14, 15 (по 1 случаю), по хромосоме 8, 9, 20, 10, 22 (в 2 случаях), по хромосоме 19 (в 3 случаях), по хромосоме 16 (10 случаев); моносомии по хромосомам 21, 18 и 13, а также в одном случае – риск множественной анеуплоидии. В нашем исследовании больше всего было выявлено анеуплоидий по хромосомам 16 и 19. Трисомия по хромосоме 16 в плаценте может быть связана с плацентарной недостаточностью, задержкой роста плода. Трисомия по хромосоме 19 может выявляться у пациентов со злокачественными новообразованиями крови. В литературе описаны единичные случаи выявления трисомии 19 при беременности.
Поскольку ДНК плода в кровотоке матери является продуктом плаценты, в большинстве случаев мы имеем дело с ограниченным плацентарным мозаицизмом, который может рассматриваться как фактор риска осложнений беременности. Во всех этих случаях решение о проведении инвазивной диагностики беременные принимали, опираясь на результаты УЗИ и рекомендации врача. Большинство женщин с редкими анеуплоидиями при отсутствии УЗ-маркеров ХА отказывались от проведения инвазивной диагностики.
У беременной с риском трисомии по хромосоме 2 при УЗИ выявили врожденные пороки развития плода, беременность была прервана и хромосомную патологию у плода подтвердили при кариотипировании. Трисомия по хромосоме 22 подтвердилась при исследовании материала замершей беременности. При подозрении на моносомию хромосомы 18 кариотипирование установило у плода делецию длинного плеча хромосомы 18. Только 2 из 10 женщин с подозрением на трисомию по хромосоме 16 согласились на инвазивную диагностику; в 1 случае была обнаружена трисомия 16 у плода. Моносомия 21 у плода не подтвердилась, по-видимому, в последних случаях наблюдался плацентарный мозаицизм.
Осведомленность беременных о тесте НИПТ и удовлетворенность от оказания услуги
Важной мерой в оценке качества любого исследования является отношение пациентов. Для того чтобы его выяснить, нами был проведен небольшой опрос среди пациентов. Было сформулировано несколько вопросов, из которых наиболее значимыми были:
- откуда вы узнали о прохождении теста?
- что послужило основанием для выполнения теста?
- была ли необходимость повторной сдачи крови, разъяснили ли Вам это?
- удовлетворены ли Вы оказанием услуги и порекомендуете ли Институт коллегам и друзьям?
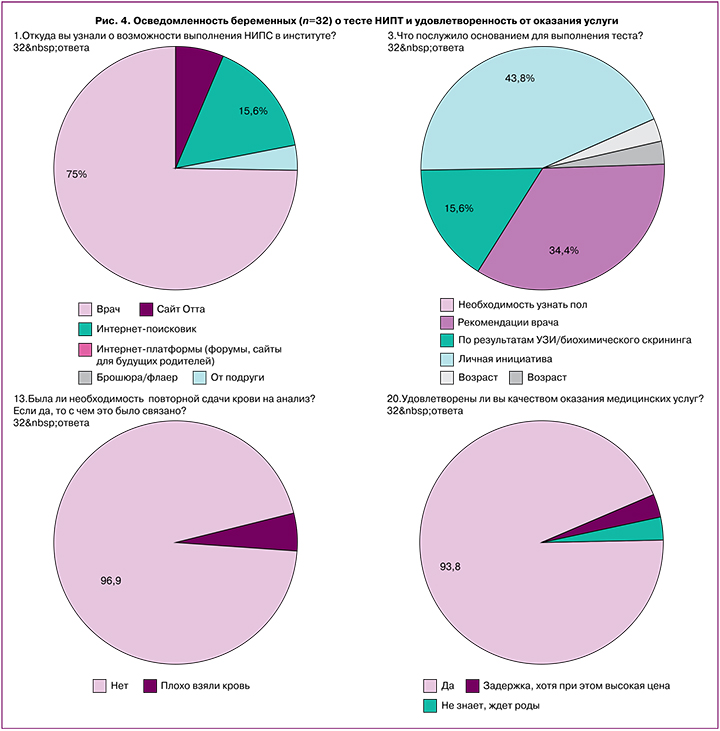
Ответы на данные вопросы приведены на рисунке 4. Опрос мнения пациенток показал, что они узнают о возможности выполнения НИПТ прежде всего от врача, далее − из интернет-поисковика. В меньшей степени беременные находят информацию на сайте Института или узнают от подруг. В 43,8% случаях пациенты не обращают внимания на цели назначения теста, а значит, могут выбрать тест не по смыслу, а по цене. Основанием для назначения теста во многом является личная инициатива (43,8% по сравнению с мнением врача – 34,4%). В 97% случаях исследование было выполнено с первого раза. В 3% случаях понадобилось повторное взятие крови по причине недостатка биологического материала плода в первичном образце, о чем не очень детально были проинформированы пациенты. Большинство пациентов (более 93%) остались удовлетворены и готовы порекомендовать Институт своим коллегам. Не более 3% остались недовольны сроками выполнения исследования или ждут родов, чтобы сделать свой выбор.
Обсуждение
На современном этапе развития молекулярно-генетических технологий высокопроизводительное секвенирование внеклеточной ДНК беременной широко используют для проведения НИПС. Данный метод сегодня становится частью рутинной клинической практики, позволяя выявлять у плода не только регулярные трисомии по хромосомам 13, 18, 21, анеуплоидии по половым хромосомам, но и частичные трисомии, делеции, плацентарный мозаицизм, а также имеет перспективы как метод оценки риска определенных патологий у матери [13, 21].
В рамках нашего исследования было еще раз подтверждено, что тест НИПТ можно провести практически всем категориям беременных женщин на любом сроке беременности, начиная с 8,5 недель.
Высокий средний возраст беременных, принявших участие в этом исследовании, − 35 лет (60% всех участников – женщины от 30 до 40 лет), свидетельствует об осознанном выборе данной технологии (как со стороны пациента, так и со стороны врача), необходимой прежде всего пациентам старшей возрастной группы, где растет риск хромосомной патологии. Это подтверждают и результаты посттестового опроса удовлетворенности от услуги НИПТ, где личная инициатива является ведущей мотивацией к проведению исследования.
Что касается срока беременности, при котором пациенты сдавали тест, то он соответствует логике назначения (большинство провели тест на сроке 12–15 недель). Лишь в отдельных случаях (всего в 121/4272 (2,82%)) его осуществили на сроке 22 недели и старше. Назначение данного теста на поздних сроках было в большинстве случаев связано с пропущенным ранним пренатальным скринингом и личным желанием женщины.
В то же время необходимо отметить, что мы взаимодействовали с особой группой пациенток − более трети 1495/4272 (35,0%) имели повышенную или избыточную массу тела. Важно, что среди таких пациенток при первичном исследовании не удалось провести НИПТ небольшому числу женщин − 26. Со второй попытки (после повторного взятия крови) только 4 женщины остались без результата. Таким образом, несмотря на то, что существует прямая отрицательная связь между успешностью теста и индексом массы тела [13] разработанная нами технология позволяет в 99,7% случаях женщинам с повышенной или избыточной массой тела эффективно решать свои скрининговые задачи.
Всего 19 женщин из 4272 не получили результат НИПТ, составив 0,44% (или 0,33%, если исключить из исследуемой выборки женщин, отказавшихся от повторного исследования), что является самым низким значением из опубликованных российских данных [17, 18]. Такой низкий процент отсутствия результата нельзя объяснить только возросшим опытом нашей лаборатории, несмотря на наличие связи между таковым и снижением числа случаев, по которым требовалось повторное взятие материала для проведения НИПТ (у других российских лабораторий проведено гораздо большее число тестов). Возможно, нюансы связаны с самой технологией, проведенной первоначальной валидацией разработанного алгоритма на контрольных образцах с анеуплоидиями, собранными в Институте и проверенными в других центрах, уникальным биоинформатическим алгоритмом и внимательным отношением к пациентам (полностью удовлетворенными тестом являются 94% пациенток).
Анализ повторного взятия материала для проведения НИПТ свидетельствует о том, что определение пола плода является самой большой проблемой теста, превышая даже проблему низкого уровня ФФ. Необходимый процент ФФ (более 4%) при повторном заборе крови, как показало данное исследование, можно получить в 90% случаев, тогда как точно определить пол плода − меньше чем в половине случаев. Таким образом, как на основе данных литературы [22, 23], так и собственного опыта определение пола плода остается главной проблемой теста, приводящей к невозможности выдать заключение, и/или ограничением для точного определения аномалий, связанных с половыми хромосомами.
Данное ограничение теста НИПТ может быть причиной отказа ряда исследователей и клиницистов от анализа ХА пола и их сосредоточенности на скрининге только трех наиболее распространенных – 21, 13 и 18 [24]. Однако в этом случае падает чувствительность теста (его способность выявлять патологию плода), и проводимый с помощью этого теста неинвазивный скрининг уже нельзя рассматривать как альтернативу РПС. Возникшую дилемму в определенной мере демонстрируют и данные настоящего исследования. В частности, нами показано, что детектируемые аномалии по хромосомам 21, 18 и 13 суммарно составляют не более 75% (128/173) от всей патологии, что явно недостаточно. Наибольший процент среди них составляет синдром Дауна – 103/173 (60%), что соответствует общероссийским и мировым данным [4, 5, 25]. Около 21% (36/173) приходится на 13, 18 и половые хромосомы и 19% (34/173) − на редкие трисомии [26, 27]. Если считать по количеству подтвержденных случаев, то наиболее распространенной хромосомной патологией остается трисомия 21 (синдром Дауна), его доля возрастает до 75% (103/138), тогда как доля трисомии по хромосоме 18 (синдром Эдвардса), трисомии по хромосоме 13 (синдром Патау) и нарушений по половым хромосомам сохраняется на том же уровне − 21% (30/138). Такие изменения объясняются тем, что в нашем исследовании все трисомии по 21 хромосоме были подтверждены инвазивной пренатальной диагностикой, тогда как другие распространенные трисомии – не более чем в 77,5% случаев (число ЛПР составило от 12,5 до 25%). Причем наибольшее число ЛПР пришлись на исследование трисомий по 13 и 18 хромосомам, а не половым, что противоречит общемировым данным [3]. Возможно, низкое число ЛПР по половым хромосомам связано с небольшой выборкой, и в дальнейшем следует ожидать увеличения их числа.
При анализе всех ЛПР необходимо отметить, что наибольшее их число приходится на группу обеспокоенных состоянием плода (14,8%), далее следует группа «промежуточного риска» (6,9%). В группе высокого риска и в группе риска по II триместру ЛПР по частым ХА выявлено не было. Такое распределение кажется вполне обоснованным и связано с гетерогенностью первых двух групп.
Группа обеспокоенных состоянием плода представляет интересную выборку пациентов. Она не отличается ни по возрасту, ни по индексу массы тела от иных групп пациентов. Однако отличается по среднему сроку проведения исследования. Большинство беременных принимают решение об участие в тестировании на сроке 12,5 недели беременности. И что особенно парадоксально, 2/3 (24/37) от общего числа обнаруженных анеуплоидий в данной группе приходится на женщин, прошедших тест до 12 недель. Объяснить данный факт сложно, так как только в 3 случаях из 24 был диагностирован ранний выкидыш плода, связанный с репродуктивными потерями, которые могли бы статистически не «дойти» до иных групп. В любом случае, большое число аномалий в этой группе, особенно детектируемых на раннем сроке, это определенный вызов предлагаемой контингентной модели [8], так как при внедрении такой модели данная группа беременных учитываться не сможет. Сформировать объективные критерии, позволяющие беременным обеспокоенным состоянием плода провести тестирование за счет государства, тоже пока невозможно. Однако прошедшие тестирование за свой счет беременные, обеспокоенные состоянием плода и получившие положительный тест (только они), могут быть встроены в новый алгоритм скрининга следующим образом: таким пациентам не требуется прохождение биохимического скрининга, а необходимы УЗИ и последующее направление на инвазивную пренатальную диагностику.
Заключение
Подытоживая, необходимо отметить, что наибольшее число выявленных ХА развития плода было обнаружено в группе высокого риска. Доля таких беременных в нашем исследовании незначительная. Назначение теста в этой группе в основном связано с опасениями женщины, связанными с выполнением инвазивных вмешательств. При внедрении контингентной модели, вероятно, количество таких пациентов будет снижаться. Сравнимое число ХА в группах, обеспокоенных состоянием плода, и промежуточного риска подчеркивает не только значимость обследования беременных группы промежуточного риска, но и необходимость учета в программах скрининга беременных обеспокоенных состоянием плода.
Необходимость использования полногеномного НИПТ сохраняет свою дискуссионность. С одной стороны, редкая патология, связанная с иными ХА, находит свое подтверждение в 50% случаев (согласно нашим данным), однако большинство пациентов с такими находками отказываются от дальнейшей инвазивной пренатальной диагностики, затрудняя анализ целесообразности детекции данных ХА.
Тест НИПТ прочно вошел в практику; его желают провести многие женщины, несмотря на высокую стоимость, однако при этом во многом опираются на свое мнение в большей степени, чем на мнение врача (среди которых гораздо большее влияние имеет врач акушер-гинеколог, а не генетик), что необходимо скорректировать в будущем.
Хотелось бы отметить, что НИПТ, проведенный с использованием разработанного нами биоинформатического анализа, является надежным методом, позволяющим с высокой точностью определить хромосомные патологии плода, как регулярные трисомии, анеуплоидии по половым хромосомам, так и «случайные находки». А учитывая ожидаемое дальнейшее снижение стоимости данного типа исследований, мы полагаем, что НИПС анеуплоидий плода на основе полногеномного секвенирования генома получит более широкое распространение и войдет в новые алгоритмы скрининга беременности.



