Потребляемые продукты питания – это модифицируемый фактор, ассоциированный с риском различных злокачественных заболеваний. Существуют убедительные данные о связи между образом питания и риском развития рака молочной железы (РМЖ).
На сегодняшний день интенсивно изучается роль пищевых биоактивных компонентов в химиопрофилактике рака молочной железы [1–3].
Индол-3-карбинол (И3К) – распространенное фитохимическое соединение овощей семейства крестоцветных. Продукт его конденсации – 3,3’-дииндолилметан (ДИМ) обладает целым рядом биологических эффектов на клеточном и молекулярном уровнях, что является основой признанного химиопрофилактического потенциала данного вещества. Исходно пищевые индолы были классифицированы как агенты, способные повышать активность ферментов, метаболизирующих экзогенные ксенобиотики.
Во многочисленных исследованиях доказано, что И3К и ДИМ влияют на множественные сигнальные пути и молекулы, контролирующие клеточное деление, апоптоз, ангиогенез, а также миграционную и инвазивную клеточную активность, регуляция которых нарушена в опухолевых клетках. Есть данные, что И3К и ДИМ могут быть эффективны в профилактике различных онкологических заболеваний, а также сердечно-сосудистых заболеваний, ожирения и диабета [4].
В последние годы появилось большое количество данных, указывающих на то, что ряд эпигенетических изменений, таких как метилирование ДНК, модификации гистонов, экспрессия некодирующих микроРНК, играют значимую роль в канцерогенезе. При этом вещества растительного происхождения И3К и ДИМ способны обращать аномальные эпигенетические нарушения, воздействуя на все три основных механизма эпигенетической регуляции [5–7].
Известно, что в популяциях населения, потребляющих большое количество овощей семейства крестоцветных, снижена частота некоторых онкологических заболеваний, а также понижены некоторые параметры оксидативного стресса [7–11]. Есть основания считать, что по крайней мере отчасти эти эффекты обусловлены биологической активностью И3К и продуктом его конденсации в кислой среде желудка – ДИМ [12].
В 1970-е годы Wattenberg и Loub [13] впервые описали присутствие ДИМ в крестоцветных, онкопрофилактический эффект брокколи, а также роль ДИМ в профилактике канцероген-индуцированного рака молочной железы у животных. Впоследствии был описан целый ряд механизмов, лежащих в основе противоопухолевой эффективности ДИМ на всех стадиях канцерогенеза в молочной железе [14]. Изучено влияние ДИМ на арилгидрокарбоновый рецептор в различных клеточных линиях рака молочной железы, а также влияние на метаболизм эстрогенов.
В 70-х годах ХХ века появились первые результаты экспериментов in vitro и in vivo, свидетельствующие о том, что И3К снижает частоту возникновения опухолей молочной железы, индуцированных химическими канцерогенами (диметилбензантраценом). Примерно тогда же было установлено, что содержащиеся в овощах семейства крестоцветных индолы являются индукторами арилгидрокарбоновой гидроксилазной активности [15]. Таким образом, стало ясно, что обезвреживание экзогенных ксенобиотических продуктов в присутствии индолов приводит к активации входящих в состав монооксигеназной системы печени индуцибельных изоформ цитохрома Р-450.
Известно, что цитохромы Р-450 относятся к ферментам I фазы трансформации и, помимо того, что метаболизируют (гидроксилируют в целях лучшей растворимости и утилизации) ксенобиотики, катализируют ключевые фазы метаболизма эстрогенов, в частности, образование «физиологического» 2-гидроксиэстрона, известного своими положительными антипролиферативными свойствами, и «агрессивного» 16α-гидроксиэстрона, обладающего генотоксическими свойствми, а также образующего с эстрогеновыми рецепторами прочную ковалентную связь и, как следствие, индуцирующего пролонгированный пролиферативный сигнал [16]. То есть 2-гидроксиэстрон (2-ОНЕ1, продукт реакции под воздействием фермента CYP1A1) известен своим защитным эффектом в отношении риска РМЖ, тогда как 16α-гидроксиэстрон (16α-ОНЕ1) является выраженным митогенным и проканцерогенным метаболитом эстрона [17].
В начале 90-х годов было доказано, что принятый перорально индол-3-карбинол способен влиять на метаболизм эстрадиола в женском организме, избирательно активируя изофермент цитохрома Р-450 CYP1A1. В результате этого повышался уровень 2-гидроксилированных эстрогеновых производных и смещалось в положительную сторону соотношение метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1 [18].
Недавний мета-анализ 13 исследований (случай-контроль и проспективных когортных) и 18 673 случаев позволил сделать вывод, что высокое потребление овощей семейства крестоцветных было значимо связано с 15% снижением риска РМЖ [19].
Число интервенционных исследований с продуктами на основе ДИМ остается ограниченным.
Известно, что у женщин с генетической мутацией BRCA1 снижение функции указанного гена приводит к повышенному риску развития рака молочной железы. Установлено, что как в гормоночувствительных, так и в гормонорезистентных клетках молочной железы белковые продукты экспрессии генов BRCA участвуют в репарации двухцепочных разрывов ДНК, а также поддерживают стабильность генома в целом [20].
В клетках с пониженной функцией генов/белков BRCA повышается частота анеуплоидии, амплификации центросом и хромосомных аномалий, что повышает их чувствительность к последующим мутациям.
Кроме того, белки BRCA1 и BRCA2 могут взаимодействовать с различными факторами транскрипции и ремоделирующими белками хроматина и таким образом функционировать как регуляторы транскрипции генов, ответственных за деление и выживаемость клеток [21, 22].
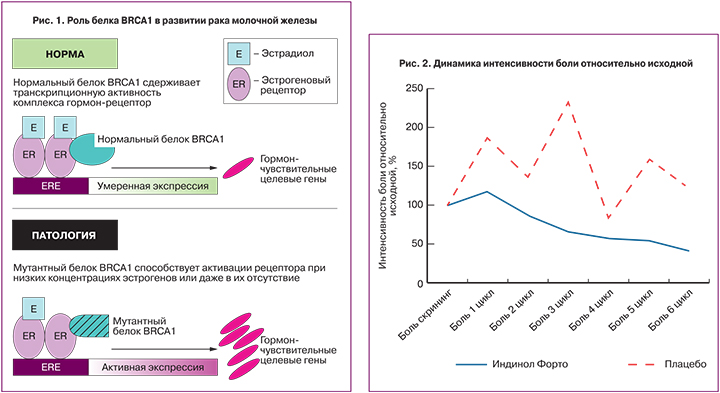
Другой вероятный кандидат на роль целевого гена, активность которого регулируется геном BRCA1 – это ген, кодирующий эстрогеновый рецептор a (ERa). В настоящее время накоплено довольно большое количество данных, не только подтверждающих факт регуляции ERa-транскрипционной активности посредством прямого взаимодействия эстрогенового рецептора с белком BRCA1, но и объясняющих как именно это происходит [23–25]. Считается, что в норме белок BRCA1, напрямую взаимодействуя с комплексом эстроген – эстрогеновый рецептор, сдерживает его транскрипционную активность, в результате чего имеет место умеренная экспрессия стимулирующих клеточную пролиферацию эстрогензависимых генов (рис. 1).
 В наблюдении L. Zheng и соавт. [25] обнаружено, что в фибробластах, дефектных по гену BRCA1, наблюдается спонтанная активация рецептора ERα в отсутствие гормонального сигнала. По существу, это означает, что белок BRCA1 контролирует лиганднезависимую репрессию эстрогенового рецептора α. Эти данные получили подтверждение в другой работе, в которой было показано, что ингибирование экспрессии гена BRCA1 в клетках рака молочной железы линии MCF-7 приводит к активации ERα в отсутствие эстрадиола [26]. Более того, оказалось, что в отсутствие экспрессии гена BRCA1 в несколько раз увеличивается уровень активации ERα при действии эстрадиола, в результате чего активация эстрогенового рецептора отмечалась при существенно более низких концентрациях гормона.
В наблюдении L. Zheng и соавт. [25] обнаружено, что в фибробластах, дефектных по гену BRCA1, наблюдается спонтанная активация рецептора ERα в отсутствие гормонального сигнала. По существу, это означает, что белок BRCA1 контролирует лиганднезависимую репрессию эстрогенового рецептора α. Эти данные получили подтверждение в другой работе, в которой было показано, что ингибирование экспрессии гена BRCA1 в клетках рака молочной железы линии MCF-7 приводит к активации ERα в отсутствие эстрадиола [26]. Более того, оказалось, что в отсутствие экспрессии гена BRCA1 в несколько раз увеличивается уровень активации ERα при действии эстрадиола, в результате чего активация эстрогенового рецептора отмечалась при существенно более низких концентрациях гормона.
Эти факты приводят к следующему выводу. В случае сниженного (по сравнению с нормой) уровня экспрессии гена/белка BRCA1 в организме создаются необходимые предпосылки для активации эстрогеновых рецепторов при очень низких концентрациях эстрадиола или даже в его отсутствие. Это означает, что как при нормальном содержании эстрогенов в крови, так и при их резком падении (что наблюдается в постменопаузе) на фоне мутации гена BRCA1 может происходить активация эстрогеновых рецепторов, вследствие чего индуцируется транскрипция целевых генов и генерируются длительные пролиферативные сигналы, вызывающие неконтролируемое клеточное деление. Следовательно, положительное внешнее воздействие, способное повысить экспрессию гена BRCA1, может являться профилактической стратегией в отношении риска рака молочной железы.
Установлено, что одной из многочисленных молекулярных мишеней И3К является опухоль-супрессорный ген BRCA1. На гормоночувствительных и гормонорезистентных опухолевых клетках молочной железы было показано, что И3К дозозависимым образом повышал уровень экспрессии белка BRCA1, а также соответствующей мРНК [27]. Ряд исследований показал, что ДИМ также способен повышать экспрессию гена BRCA1 в клетках рака молочной железы [28].
Несколько лет тому назад было проведено исследование по изучению способности ДИМ при пероральном применении повышать экспрессию мРНК BRCA1 в лейкоцитах. В исследование вошли 18 женщин – носительниц мутации BRCA1 (25–63 года), 13 из которых получали 300Тмг/сут ДИМ в течение 4–6 недель (группа воздействия), 5 пациенток не получали ДИМ (группа контроля). Экспрессия мРНК BRCA1 оценивалась исходно и через 4–6 недель посредством количественной ПЦР в реальном времени.
У 13 женщин с мутацией BRCA1 применение ДИМ в течение 4–6 недель привело к повышению экспрессии мРНК BRCA1 в среднем на 34% (24–194%), что достигало границы статистической значимости (р=0,05). Значимых различий в изменении экспрессии мРНК BRCA1 в контрольной группе выявлено не было (р=0,45) [28].
Таким образом, пероральный прием ДИМ ассоциирован с повышением экспрессии мРНК BRCA1 у женщин с мутацией BRCA1. Возможное снижение пагубного эффекта мутации BRCA1 за счет повышения экспрессии здоровой копии данного гена и нормализации уровня соответствующего белка является клинически значимым сдвигом парадигмы в профилактических стратегиях у женщин с высоким риском рака молочной железы. Указанное пилотное исследование было первым, показавшим возможность повышения экспрессии мРНК BRCA1 с помощью метаболита индол-3-карбинола [28].
Важно отметить, что у больных спорадическими формами РМЖ в большом проценте случаев наблюдается снижение или полное отсутствие экспрессии BRCA1 в опухолевой ткани. В этом случае применение препарата, стимулирующего экспрессию гена и белка BRCA1, способно повышать его опухоль-супрессорные функции [29].
В 2004 г. было проведено двойное слепое плацебо-контролируемое исследование по изучению активности ДИМ у 19 женщин в постменопаузе с начальной стадией РМЖ. Женщины были рандомизированы в две группы и получали 108 мг/сут ДИМ или плацебо в течение 30 дней. По сравнению с плацебо у пациенток в группе приема ДИМ было отмечено значимое повышение уровня 2-гидроксиэстрона (р<0,02) и умеренное протективное изменение соотношения 2ОНЕ1:16αОНЕ1 (р=0,059) [30]. Согласно другим данным у женщин в пременопаузе на фоне приема ДИМ было отмечено снижение симптомов циклической масталгии [31], которая, как известно, является потенциальным индикатором повышенного риска рака молочной железы [32].
В ФГБУ НЦАГиП им. акад. В.И. Кулакова Минздрава России в 2010–2013 гг. проведено рандомизированное двойное слепое плацебо-контролируемое исследование лекарственного препарата на основе индол-3-карбинола (индинол форто) – средства таргетной терапии, созданного российскими учеными НИИ молекулярной медицины при Первом МГМУ им. И.М. Сеченова. В исследование вошли 62 пациентки в возрасте 20–45 лет с циклической масталгией (мастодинией), в том числе на фоне доброкачественной дисплазии молочной железы (мастопатии, фиброзно-кистозной болезни молочных желез), которые были рандомизированы в две группы: группа 1 – прием препарата индинол форто (производства МираксБиоФарма, Россия), содержащего 200 мг индолкарбинола в капсуле, по 200 мг 2 раза (400 мг) в сутки (30 пациенток); группа 2 – прием плацебо по 1 капсуле 2 раза в сутки (32 пациентки). Продолжительность лечения составила 6 менструальных циклов. Эффективность оценивалась по следующим показателям: данные дневников пациенток, результаты пальпации молочных желез, результаты УЗИ молочных желез. Также оценивалась интенсивность боли по визуально-аналоговой шкале. Кроме того, определяли концентрацию половых гормонов в сыворотке крови и уровень метаболитов эстрогенов – 2-ОНЕ1 и 16α-ОНЕ1 – в моче методом иммуноферментного анализа (Immunacare, CШA).
Поскольку циклическая масталгия (мастодиния) является преимущественно субъективным симптомокомплексом, эффективность препарата оценивалась по его влиянию на чувство боли и нагрубания в молочных железах. Пациентки использовали дневники, заполняемые ежедневно. Соответственно, критерием эффективности лечения был факт уменьшения (более чем на 2 балла по визуально-аналоговой шкале) либо исчезновения ощущения боли и нагрубания в молочных железах.
В результате проведенного исследования было установлено, что по данному критерию оценки эффективность лечения в группе терапии индинолом форто оказалась значимо выше по сравнению плацебо как через 3 месяца (78,0% по сравнению с 59,5%, р=0,044), так и через 6 месяцев лечения (83,3% по сравнению с 50,3%, р=0,002). По данным пальпации и УЗИ молочных желез значимых различий выявлено не было.
Заслуживает особого внимания эффективность лечения пациенток (n=44), у которых циклическая масталгия (мастодиния) развилась как проявление доброкачественной дисплазии молочных желез (мастопатии). Диагноз устанавливался по данным УЗИ (наличие диффузных изменений ткани молочных желез и кист). Частота мастопатии в группе индинол форто значимо не отличалась от таковой в группе плацебо (р=1,0, точный критерий Фишера). Согласно полученным результатам, по субъективному критерию оценки (по данным дневников пациенток), эффективность лечения в группе терапии индинолом форто по сравнению с плацебо значимо различалась через 6 месяцев лечения (83,0% по сравнению с 47,0%, р=0,004).
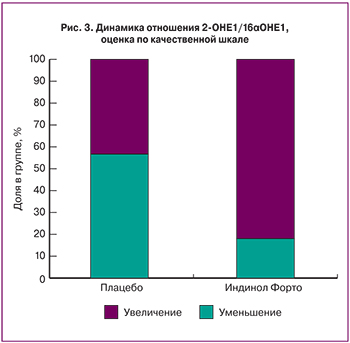
При анализе интенсивности боли в молочной железе было установлено, что в группе плацебо интенсивность боли менялась из месяца в месяц, но в целом была выше исходной, в то время как в группе индинола форто отмечалось стабильное уменьшение боли от исходного уровня до величины менее 50% к 6-му циклу терапии. Наиболее выраженное снижение интенсивности боли было отмечено в первые 3 менструальных цикла (рис. 2).
При анализе уровня метаболитов эстрогенов определяли соотношение 2-гидроксиэстрон (2-ОНЕ1)/16α-гидроксиэстрон (16α-ОНЕ1). Динамика данного показателя в течение 3 месяцев, оцененная по качественной шкале, приведена на рис. 3.
Сравнение в группах уровней репродуктивных гормонов в сыворотке крови показало отсутствие различий данных показателей для фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), тиреотропного гормона (ТТГ) и пролактина, однако в группе индинола форто был установлен достоверный прирост уровня глобулина, связывающего половые стероиды (ГСПС), что, по-видимому, стало основанием для снижения свободного эстрадиола через 6 месяцев лечения в среднем на 25%. Данные изменения не требовали отмены препарата и находились в пределах физиологической нормы.
Таким образом, в ходе проведенного исследования была доказана эффективность нового мультитаргетного лекарственного средства индинол форто для лечения пациенток с циклической масталгией (мастодинией) и мастопатией. Учитывая, что известные механизмы действия индолкарбинола характеризуют его как средство, обладающее онкопротекторным эффектом [3, 8, 27, 33], данный результат особенно важен в плане профилактики рака молочной железы у пациенток с циклической масталгией.
По результатам описанного выше плацебо-контролируемого клинического исследования Министерством здравоохранения РФ был зарегистрирован первый в мире лекарственный препарат на основе индол-3-карбинола – индинол форто.
Согласно данным И.И. Черниченко и Ю.А. Кулаковой [34], на фоне приема данного препарата было выявлено купирование клинических симптомов дискомфорта в молочных железах у 25 (62,5%) женщин, уменьшение их выраженности у 9 (22,5%) пациенток, и нормализация психоэмоционального состояния у 32 (27,4%) пациенток, а также улучшение данных рентгеновской маммографии и ультразвукового обследования у 33,7% женщин. Отдельно следует отметить, что большинство женщин субъективно отмечали, что молочные железы становились более мягкими и эластичными.
В заключение необходимо подчеркнуть, что на сегодняшний день детально описаны молекулярные механизмы, посредством которых И3К и ДИМ могут снижать риск развития РМЖ. Важнейшим из этих механизмов является нормализация баланса метаболитов эстрогенов и снижение активности про-пролиферативных эстрогеновых рецепторов α. Выявлено положительное влияние этих молекул на клеточный цикл, апоптоз, изменение ответа на оксидативный стресс, а также наличие у этих соединений других антипролиферативых и противовоспалительных эффектов в экспериментах на клеточных культурах и на животных [14, 35].
Очевидно, что факт обнаружения стимуляции экспрессии опухоль-супрессорного гена/белка BRCA1 со стороны И3К и ДИМ имеет огромное значение с точки зрения перспективы профилактики не только наследственного, но и спорадического рака молочной железы. Это является особенно актуальным с учетом того, что традиционная медицина на сегодняшний день не располагает эффективными щадящими нехирургическими методами, предупреждающими появление наследственного РМЖ.
Результаты исследований о положительном влиянии И3К и ДИМ на клинические маркеры повышенного риска рака молочной железы (масталгия, мастодиния и другие проявления фиброзно-кистозной болезни молочных желез) также подтверждают важную роль указанных молекул в качестве профилактических стратегий для снижения риска РМЖ.



