Неоспоримые достижения в области лучевого и лекарственного лечения рака молочной железы, которые нивелируют в ближайшей и отдаленной перспективе какие-либо преимущества агрессивного хирургического подхода у пациенток с начальными стадиями заболевания, направляют современные исследования ученых в сторону дальнейшей минимизации хирургической травмы. Это требует проведения адекватного стадирования на этапе планирования лечебной тактики. Огромную роль в этом играет определение состояния регионарного лимфатического коллектора. Для предоперационной диагностики состояния регионарных (в первую очередь аксиллярных) лимфатических узлов используются различные неинвазивные способы визуализации, однако наиболее распространенным и доступным методом является ультразвуковое исследование, тем более что данное исследование позволяет при необходимости одномоментно выполнить прицельную биопсию подозрительного лимфатического узла. Для адекватного стадирования и точного определения объема хирургического вмешательства, одной из задач оценки состояния регионарных лимфатических узлов у пациенток с начальными стадиями рака молочной железы (РМЖ), которым, возможно бы, планировалось проведение интраоперационной биопсии сигнальных лимфатических узлов, является отказ от данной процедуры. В связи с этим встает вопрос о создании оптимального алгоритма диагностики состояния регионарного лимфатического коллектора с использованием современных возможностей ультразвукового метода. В настоящее время «методологический предел» УЗИ и тонкоигольной аспирационной биопсии (ТАБ), по данным многих авторов [1–21,] на протяжении последних двух десятилетий приблизительно определен в коридоре от 50 до 80%, специфичность достигает 100%, а частота ложно-отрицательных результатов колеблется в пределах от 14 до 30% и в среднем находится на уровне 20–25%, что вынуждает значительную часть пациентов все же отправлять на процедуру биопсии сторожевого лимфатического узла (БСЛУ), при этом не более чем у 20% этих больных будут выявлены метастазы в аксиллярных лимфоузлах, причем до 50% этих больных будут иметь микрометастазы, которые при современных возможностях адъювантного лечения не имеют клинического значения. Однако с внедрением во врачебную практику современных возможностей УЗ-технологий возможно улучшить данные показатели.
Материалы и методы
В данной работе на примере 118 пациенток с клинической стадией T1–2 и отсутствием пальпируемых подмышечных лимфатических узлов (N0) мы хотим продемонстрировать полученные результаты оценки состояния подмышечных лимфатических узлов, которые были получены с использованием различных методик ультразвуковой диагностики. Для оценки эффективности определения метастатически измененных лимфатических узлов по данным предоперационной диагностики были определены показатели информативности: чувствительность, специфичность и точность по формулам расчета статистических показателей. Ультразвуковая визуализация тканей подмышечной области выполнялась по стандартной методике, в В-режиме, с использованием высокочастотных датчиков с рабочей частотой от 5 до 13 МГц. Первым этапом исследования выполнялся полипозиционный осмотр с использованием стандартных методик. Ультразвуковая визуализация дополнялась исследованием в режиме цветового допплеровского кодирования для определения степени васкуляризации лимфоузлов. На втором этапе с целью объективизации полученных результатов использовалась эластография сдвиговой волной, что снижает количество артефактов и позволяет получить предварительную, визуальную информацию о степени жесткости лимфоузлов. На третьем этапе исследования выполнялась эластометрия выявленных и размеченных ранее лимфоузлов. При выполнении эластометрии окно опроса устанавливается последовательно на периферическую часть лимфоузла и его центральные отделы, при этом выполняется не менее трех измерений с вычислением среднего значения. При средних значениях скорости сдвиговой волны ниже 1,85 м/с результат расценивается как отрицательный, т.е. метастатическое поражение отсутствует. При скорости сдвиговой волны ≥1,85 м/с результат расценивается как сомнительный или положительный – метастатическое поражение лимфоузла. Четвертым этапом пациенткам, у которых результаты расценивались как сомнительные или положительные в отношении метастатического поражения, выполнялась чрескожная пункционная биопсия предварительно размеченных лимфоузлов. Всем пациенткам выполняли лечебную подмышечную лимфаденэктомию (ПЛАЭ) или биопсию сторожевого лимфатического узла (БСЛУ) на регионарном (аксиллярном) лимфоколлекторе одномоментно с операцией на молочной железе. Результаты неинвазивных методик сравнивались с результатами патоморфологического исследования.
Статистический анализ
Статистический анализ полученных данных производился с помощью стандартных методов математико-статистической обработки с использованием программного обеспечения для ПК (MS Office Excel и IBM SPSS v 20). При описании количественных данных рассчитывали среднее значение и стандартное отклонение (СО), тест на нормальность распределения выполняли при помощи критерия W-критерия Шапиро–Уилка. Представленные в работе количественные данные имели нормальное распределение. Качественные показатели представлены как в абсолютных, так и в относительных величинах (%). Для оценки эффективности метода определения метастатически измененных лимфоузлов по данным предоперационной диагностики мы определяли чувствительность, специфичность и точность по формулам расчета статистических показателей. Чувствительность, специфичность, распространенность заболевания, положительная и отрицательная прогностическая ценность, а также точность выражаются в процентах. Доверительные интервалы для чувствительности, специфичности и точности – это «точные» доверительные интервалы Клоппера–Пирсона. Различия между группами в частотах событий оценивались при помощи Z-теста, для непрерывных переменных – при помощи критерия Манна–Уитни. Для всех критериев и тестов величина критического уровня значимости принималась равной 0,05, т.е. различия признавались статистически значимыми при p<0,05. Для определения точек отсечения с заданной чувствительностью и специфичностью, положительного и отрицательного прогностического значения выполнялся ROC-анализ с расчетом AUC.
Результаты
Так, при оценке изменений в аксиллярных лимфоузлах по данным УЗИ в В-режиме (табл. 1) было установлено, что чувствительность данного УЗ-метода составила 73,3% (22 из 30, 95% ДИ от 54,1% до 87,7%), специфичность – 94,3% (83 из 88, 95% ДИ от 87,2% до 98,1%). Точность метода составила 88,9% (95% ДИ от 81,9% до 94,0%). Прогностическая ценность положительного результата (ПЦПР) – 81,4% (95% ДИ от 64,6% до 91,4%), прогностическая ценность отрицательного результата (ПЦОР) – 91,2% (95% ДИ от 85,1% до 94,7%)
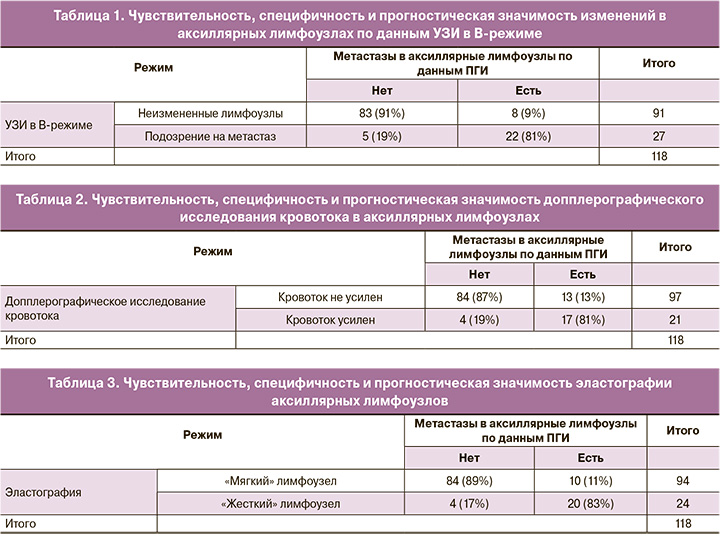
В таблице 2 представлена частота выявления патологического активного кровотока в аксиллярных лимфоузлах по данным допплерографии. Прогностическая ценность данного отдельного УЗ-признака была нами также дополнительно проанализирована, поскольку мы располагаем сведениями относительно наличия или отсутствия метастазов в аксиллярных лимфоузлах по данным морфологического исследования. Чувствительность данного УЗ-признака составила 56,7% (17 из 30, 95% ДИ от 37,4% до 74,5%), специфичность 95,5% (84 из 88, 95% ДИ от 88,7% до 98,8%). Точность метода 85,6% (95% ДИ от 77,9% до 91,4%). ПЦПР 80,9% (95% ДИ от 60,8% до 92,1%), ПЦОР 86,6% (95% ДИ от 81,1% до 90,7%)
Далее всем больным УЗ-исследование в В-режиме и М-режиме дополнялось данными эластографии, результат которой записывался в виде интегральной оценки – «мягкий» лимфатический узел или «жесткий» лимфатический узел (табл. 3).
Исходя из полученных результатов можно сделать вывод, что чувствительность признака составила 66,7% (20 из 30, 95% ДИ от 47,2% до 82,7%), специфичность 95,5% (84 из 88). Точность метода – 88,4% (95% ДИ от 80,9% до 93,36%), ПЦПР – 83,3% (от 65,0% до 93,1%), ПЦОР – 89,3% (от 83,5% до 93,3%).
Всем больным также выполнялась эластометрия и измерение скорости звуковой волны в тканях аксиллярной области (как в лимфатическом узле, так и в окружающих тканях). В качестве демонстрации приводим результаты эластометрии сдвиговой волной одной из наших пациенток (рис. 1).

У 118 пациенток мы оценили полученные средние значения скорости сдвиговой волны в лимфатических узлах подмышечной области и окружающих тканях в зависимости от наличия или отсутствия метастатического поражения аксиллярного лимфоколлектора по данным морфологического исследования (табл. 4).
Таким образом, скорость сдвиговой волны в аксиллярных лимфоузлах у больных с метастатически измененными узлами статистически значимо отличалась от таковой у больных без метастазов в лимфатические узлы.
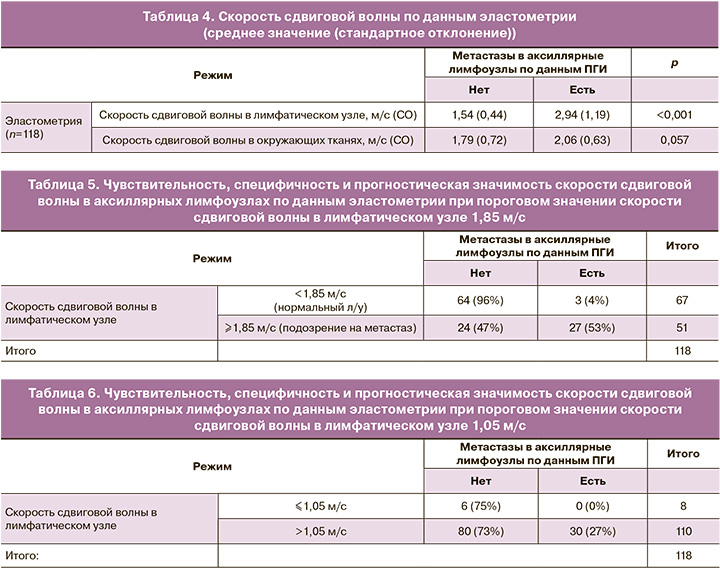
Мы использовали ROC-анализ, чтобы определить пороговое значение величины скорости сдвиговой волны в лимфатическом узле, который бы позволил нам с приемлемой чувствительностью и специфичностью различать на дооперационном этапе метастатически измененные и «нормальные» лимфатические узлы. В ходе анализа было рассчитано пороговое значение скорости сдвиговой волны равное 1,85 м/с, при которой данная модель показала чувствительность в обнаружении метастазов в лимфатических узлах в 90% (27 из 30 больных, 95% ДИ от 73,5% до 97,9%), а специфичность 72,7% (64 из 88 больных, 95% ДИ от 62,2% до 81,7%). Точность метода при этом составила 77,1% (95% ДИ от 68,5% до 84,4%). ПЦПР 52,9% (95% ДИ от 43,9% до 61,8%), а ПЦОР 95,5% (95% ДИ от 87,9% до 98,4%) (табл. 5).
Анализ ROC-кривых позволяет выбрать и другие варианты пороговых значений для диагностического метода, отвечающих задаче данной работы, а именно, выяснить может ли УЗИ с использованием дополнительных методик на дооперационном этапе позволить избежать лимфаденэктомии или процедуры БСЛУ хотя бы у части пациенток с клинически неопределяемыми метастазами в аксиллярных лимфоузлах. В этой связи мы попробовали пожертвовать чувствительностью обнаружения метастазов в лимфоузлах с целью усилить предсказательную ценность негативного результата, иначе говоря, мы попытались найти значения скорости сдвиговой волны, при которой с максимальной вероятностью (100%) мы не обнаружим метастазы в подмышечных лимфатических узлах. Таким пороговым значением в нашей ROC-модели оказалась величина скорости сдвиговой волны 1,05 м/с (табл. 6).
 При использовании порогового значения скорости сдвиговой волны в 1,05 м/с данная модель показала чувствительность в обнаружении метастазов в лимфатических узлах в 100% (95% ДИ от 88,4% до 100%), специфичность при этом составила 9% (95% ДИ 2,6% до 14,6%), ПЦПР 27,3% (95% ДИ от 26,1% до 28,4%), а ПЦОР 100%. К сожалению, построенные ROC-модели не позволили найти более приемлемых сочетаний прогностической ценности отрицательных результатов (что чрезвычайно важно в нашей работе), чувствительности и специфичности теста. Таким образом, применяя пороговую величину скорости сдвиговой волны 1,85 м/с у пациентов без клинически определяемых метастазов в лимфатические узлы при негативном результате исследования (скорость менее 1,85 м/с) мы пропустили бы 3 случая метастатического поражения из 67 больных в группе (прогностическая ценность отрицательного результата составляет 95,5%, (95% ДИ от 87,9% до 98,4%)), но при этом 67 больных из 108 могли бы избежать операции (БСЛУ или ПЛАЭ) на лимфоколлекторе. Пытаясь добиться 100% прогностической ценности отрицательного результата мы вынуждены снизить специфичность методики, в результате чего лишь у 8 больных из 108 удалось бы избежать манипуляции (БСЛУ или ПЛАЭ) на лимфоколлекторе. Полученные данные демонстрируют, что ультразвуковые характеристики, такие как скорость сдвиговой волны, интегральная оценка данных В-режима, допплерография, эластография и интегральная оценка всех методик имеют приблизительно похожие и очень надежные предсказательные модели.
При использовании порогового значения скорости сдвиговой волны в 1,05 м/с данная модель показала чувствительность в обнаружении метастазов в лимфатических узлах в 100% (95% ДИ от 88,4% до 100%), специфичность при этом составила 9% (95% ДИ 2,6% до 14,6%), ПЦПР 27,3% (95% ДИ от 26,1% до 28,4%), а ПЦОР 100%. К сожалению, построенные ROC-модели не позволили найти более приемлемых сочетаний прогностической ценности отрицательных результатов (что чрезвычайно важно в нашей работе), чувствительности и специфичности теста. Таким образом, применяя пороговую величину скорости сдвиговой волны 1,85 м/с у пациентов без клинически определяемых метастазов в лимфатические узлы при негативном результате исследования (скорость менее 1,85 м/с) мы пропустили бы 3 случая метастатического поражения из 67 больных в группе (прогностическая ценность отрицательного результата составляет 95,5%, (95% ДИ от 87,9% до 98,4%)), но при этом 67 больных из 108 могли бы избежать операции (БСЛУ или ПЛАЭ) на лимфоколлекторе. Пытаясь добиться 100% прогностической ценности отрицательного результата мы вынуждены снизить специфичность методики, в результате чего лишь у 8 больных из 108 удалось бы избежать манипуляции (БСЛУ или ПЛАЭ) на лимфоколлекторе. Полученные данные демонстрируют, что ультразвуковые характеристики, такие как скорость сдвиговой волны, интегральная оценка данных В-режима, допплерография, эластография и интегральная оценка всех методик имеют приблизительно похожие и очень надежные предсказательные модели.
Заключение
Из 118 больных с клинически неопределяемыми лимфоузлами в подмышечной области, при помощи расширенного УЗ-исследования удалось выявить 27 больных с метастазами в регионарных лимфоузлах в сравнении с 22 при использовании обычного В-режима 90% и 73% соответственно, и этим пациентам была выполнена ПЛАЭ, минуя этап БСЛУ.
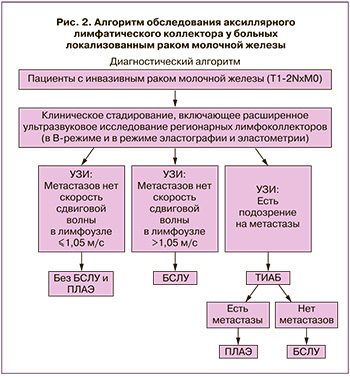
Таким образом, можно сформулировать алгоритм обследования аксиллярного лимфатического коллектора у больных локализованным раком молочной железы (рис. 2).



