Эндометрий всегда было принято считать стерильным у небеременных, беременных женщин и в послеродовом периоде, что доказывалось культуральными методами диагностики [1, 2]. И действительно, инфекционный процесс в эндометрии или присутствие высоких концентраций микробных продуктов – эндотоксинов – привычно ассоциировалось с неудачами имплантации, спонтанными самопроизвольными выкидышами, привычным невынашиванием беременности или спонтанными преждевременными родами [3–8].
При этом сложно представить, что слизистая оболочка матки, находясь в непосредственной анатомической близости к различным микроорганизмам нижних отделов репродуктивной системы, как и постоянно взаимодействуя со сперматозоидами, которые потенциально способны переносить на себе бактерии, при этом продолжает оставаться зоной, свободной от бактериальной колонизации.
Восходящий путь попадания бактерий через шейку матки считается самым вероятным источником существования бактерий в эндометрии [9]. Например, в экспериментальных моделях было показано, что меченые частицы, по размерам идентичные сперматозоидам (микроагрегаты человеческого белка альбумина) могут попадать из влагалища в матку через цервикальный канал в течение нескольких минут у небеременных женщин [10]. Таким образом, маточные перистальтические контракции, способствующие попаданию сперматозоидов в полость матки из влагалища, могут также осуществлять механизм обсеменения эндометрия бактериями. С другой стороны, особое строение шейки матки и цервикальная слизь защищают матку от попадания микроорганизмов из влагалища. Возможно, поэтому имеются данные о быстро снижающейся относительной и абсолютной представленности лактобактерий в нижней, средней и верхней трети эндометрия соответственно; то есть чем выше мы «движемся» по репродуктивному тракту в сторону дна матки и маточных труб, тем меньше представленность лактобактерий [9]. Таким образом, представления об эндометрии как о стерильной ткани на сегодняшний день подвергаются существенным сомнениям.
Недавние исследования в этой области с использованием молекулярных технологий доказывают наличие резидентной микрофлоры в эндометрии человека и ее потенциальное влияние на репродуктивное здоровье женщин, особенно на процессы имплантации оплодотворенной яйцеклетки и исходы беременности [11–25].
Наиболее распространенной и обсуждаемой на сегодняшний день гипотезой является гипотеза о «лактобациллярном» и «не-лактобациллярном» микробиоме эндометрия. Так, показано, что доминирование лактобактерий (относительная доля более 90%) в составе микробиоты эндометрия ассоциировалось с успешной имплантацией и высокой частотой живорождений у пациенток, прошедших процедуру ЭКО [15, 21]. В связи с этим появилось логичное утверждение, что увеличение относительной доли лактобактерий до 90% и более у женщин с не-лактобациллярной микрофлорой эндометрия может способствовать увеличению частоты имплантации у бесплодных женщин и ассоциировано с понятием «здорового» маточного микробиома.
К сожалению, на сегодняшний день количество научных публикаций и накопленный научный материал не позволяют в полной мере формировать понятие о нормальном и дисбиотическом маточном микробиоме, тем более о способах его коррекции.
Целью настоящего исследования явилась оценка маточного микробиома у женщин с бесплодием и многократными неудачными попытками вспомогательных репродуктивных технологий (ВРТ) и у здоровых фертильных женщин без осложненного акушерско-гинекологического анамнеза, имевших хотя бы одни успешные вагинальные роды в анамнезе.
Материалы и методы
В исследование были включены 35 женщин, разделенных на 2 группы. Все пациентки были обследованы на базе кафедры акушерства и гинекологии №1 ФГБОУ ВО РостГМУ Минздрава России (Ростов-на-Дону, Россия). В 1-ю группу вошли 20 женщин с бесплодием различного генеза и многократными неудачными попытками ЭКО (2 и более попытки) в возрасте от 20 до 42 лет. Критериями исключения были любая патология матки, в том числе врожденные аномалии развития, миомы, полипы, внутриматочные синехии, внутриматочные манипуляции в течение последних 6 месяцев, присутствие внутриматочной спирали в течение последних 6 месяцев, любое системное воспалительное заболевание или тяжелая экстрагенитальная патология, применение системной антибактериальной терапии в последние 3 месяца.
Во 2-ю группу вошли 15 здоровых женщин от 20 до 42 лет без каких-либо жалоб, без отягощенного акушерско-гинекологического анамнеза, имевших хотя бы одни роды через естественные родовые пути в анамнезе. Критерии исключения, помимо критериев для 1-й группы, включали в себя также хирургические аборты, самоаборты, неразвивающиеся беременности, выскабливания стенок полости матки в послеродовом периоде, кесарево сечение в анамнезе.
Каждая участница исследования заполнила информированное добровольное согласие на исследование. Локальный этический комитет ФГБОУ ВО РостГМУ Минздрава России одобрил проведение настоящего исследования.
Забор образцов
Все образцы для исследования были собраны с 22-го по 24-й день регулярного менструального цикла. С целью избежать контаминации микроорганизмами из влагалища или цервикального канала и получить данные исключительно о видовом составе полости матки для забора материала использовался катетер для переноса эмбриона в полость матки, состоящий из внешней твердой части и внутренней мягкой части. После визуализации шейки матки в зеркалах стерильным марлевым тампоном, смоченным раствором хлоргексидина, удалялась слизь с поверхности шейки матки и обрабатывалась шейка. Катетер для переноса эмбрионов в полость матки аккуратно вводился в цервикальный канал, не касаясь стенок влагалища, при этом внутренняя мягкая часть катетера была помещена в наружную полностью, что позволяло избежать контаминации бактериями цервикального канала. После попадания в полость матки внутренний катетер аккуратно выдвигался из внешнего до области дна матки, производился забор материала для исследования микробиома из дна матки, после чего внутренний катетер снова помещался в пространство наружного, и вся система удалялась из цервикального канала и влагалища. Образец эндометриальной флоры помещался в пробирку Эппендорфа со специальной транспортной средой «транспортная среда с муколитиком» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва, Россия), среда сохранялась при температуре +4°С до выделения ДНК.
Суммарную ДНК выделяли с использованием набора «Рибо-преп» (ФБУН ЦНИИэпидемиологии Роспотребнадзора, Москва, Россия) по протоколу производителя.
Библиотеки фрагментов гена 16S рРНК готовили по протоколу компании «Иллюмина» «16S Metagenomic Sequencing Library Preparation» (Part №15044223 Rev. B). 5 нг суммарной ДНК амплифицировали в течение 25 циклов с использованием рекомендованных в протоколе праймеров к участкам V3 и V4 гена 16S рРНК бактерий и готовой смеси для ПЦР KAPA HiFi HotStart ReadyMix (2X) (Roche Diagnostics, Швейцария). Полученные фрагменты ДНК очищали с использованием парамагнитных частиц AMPure XP beads (Beckman Coulter, США). Для проведения индексирующей ПЦР 5 нг ДНК после первого раунда амплификации подвергали восьми циклам амплификации с использованием биркодированных праймеров из набора Nextera XT Index Kit (Illumina, США) и готовой смеси для ПЦР KAPA HiFi HotStart ReadyMix (2X) (Roche Diagnostics, Швейцария). Полученные библиотеки очищали с помощью парамагнитных частиц, пулировали в эквимолярном соотношении и секвенировали на приборе MiSeq System (Illumina, США) в режиме парноконцевого секвенирования 2*151.
Анализ данных
Анализ данных, полученных в ходе секвенирования библиотек, проводили с помощью собственного пайплайна, реализованного на языках программирования R v.3.6 (R Core Team, 2014) и Python. На первом этапе пайплайна удаляли последовательности праймеров с начала прочтений. Прочтения, которые не содержали праймеров, также удаляли. Далее удалялись по 25 последних нуклеотидов прочтений, как имеющие низкое качество, и обрабатывали полученные данные, используя протокол DADA2 для детекции точных вариантов последовательностей [26]. После определения точных вариантов последовательностей объединялись прямые и обратные прочтения конкатенацией и использовались полученные последовательности для байесовской таксономической классификации [27], используя референсную базу данных SILVA v132 [28]. Видовое определение проводили с использованием алгоритма полного соответствия в DADA2 с использованием последовательностей базы данных SILVA v132, предварительно процессированных с помощью собственных скриптов для соответствия анализу.
Статистический анализ
Для проверки клинико-демографических характеристик пациенток обследуемых групп на нормальность распределения использовался критерий Шапиро–Уилка (табл. 1). Концентрации исследуемых микроорганизмов не имеют нормальной природы и значительно разрежены, поэтому представлены в виде медиан (табл. 2). Сравнение количественных показателей в группах проводилось с помощью непараметрического теста Манна–Уитни. Различия признавались статистически значимыми на уровне р<0,05.

Расчеты выполнялись в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Результаты
Клинико-демографические характеристики пациенток обеих групп представлены в таблице 1. Пациентки обеих групп были сопоставимы по индексу массы тела, возрасту менархе, продолжительности менструального цикла и продолжительности самой менструации, возрасту. Эти показатели были нормально распределены в обеих группах.
Исследование микробиома эндометрия путем секвенирования позволило выявить микроорганизмы, относящиеся в общей сложности по таксономической классификации к 19 типам, 26 классам, 89 семействам, 257 родам и 366 различным видам. Сравнение между группами проводилось на таксономическом уровне родов.
По уровню родов между двумя группами были выявлены статистически значимые отличия в относительных представленностях следующих родов микроорганизмов: Acidovorax, Brevibacillus, Brevundimonas, Caulobacter, Comamonas, Delftia, Distigma, Pseudomonas, Ralstonia, Schlegelella, Thermus. В группе женщин с бесплодием и многократными неудачными попытками ЭКО регистрировались статистически значимо более высокие доли бактерий рода Brevundimonas [0,065 (0;0,38) в 1-й группе и 0 (0;0) во 2-й группе)] и Ralstonia [0,21 (0;1,2) в 1-й группе и 0 (0;0,12) во 2-й группе].
При этом у фертильных женщин 2-й группы регистрировались статистически значимо более высокие доли Acidovorax [0 (0;1,33) в 1-й группе и 2,1 (0,75;3,44) во 2-й группе], Brevibacillus [0 (0;0) в 1-й группе и 0,11 (0;0,3) во 2-й группе], Caulobacter [0 (0;0,28) в 1-й группе и 0,54 (0,15;1,07) во 2-й соответственно], Comamonas [0,01 (0;6,37) в 1-й группе и 7,44 (4,15;18,2) во 2-й группе], Delftia [0,025 (0;1,26) в 1-й группе и 2,4 (0,81;4,11) во 2-й группе], Distigma [0 (0;0,22) в 1-й группе и 0,64 (0,11;1,22) во 2-й группе соответственно], Pseudomonas [0 (0;0,12) в 1-й группе и 0,48 (0,01;2,26) во 2-й], Schlegelella [0 (0;0,72) в 1-й группе и 1,18 (0,29;2,14) во 2-й], Thermus [0 (0;2,63) в 1-й группе и 2,57 (1,05;5,62) во 2-й] (табл. 2).
Помимо сравнения медиан в группах, была посчитана средняя относительная представленность родов бактерий в группах. Самыми представленными в группе здоровых фертильных пациенток были роды Lactobacillus – 29,4%, Comamonas – 16,8% и Mesorhizobium – 6,0%, а в группе бесплодных пациенток с многократными неудачами ЭКО – Lactobacillus –33,3%, Ralstonia – 7,9% и Pediococcus – 4,8% (рис. 1). При этом доля лактобактерий у пациенток 1-й группы значимо не отличалась от доли лактобактерий у пациенток 2-й группы (33,3 и 29,4% соответственно) (рис. 2). Кроме того, нельзя уверенно говорить о доминировании лактобактерий более 90% в составе микробиома матки у здоровых женщин, как утверждает по данным своих наблюдений Moreno [15]. Категория «другие микроорганизмы» включала в себя разнообразные микроорганизмы, чья относительная представленность в микробиоме составляла менее 1%. У пациенток 1-й группы «другие» микроорганизмы составляли 18,7%, у пациенток 2-й группы – 14,4% соответственно. Кроме того, неклассифицируемые микроорганизмы, то есть те, которых не удалось идентифицировать или чей геном отсутствует в известных базах данных, составляли 10,5% в 1-й группе и 7,5% – во 2-й. В целом можно утверждать, что микробиом эндометрия достаточно разнообразен как у здоровых фертильных пациенток, так и у пациенток с многократными неудачами ЭКО, что может быть связано непосредственно с местом забора материала для исследования микробиома – а именно дном матки. Ведь, как известно, чем «выше» локус забора материала в женской репродуктивной системе, тем меньше представленность лактобактерий. Однако, несмотря на разнообразие микроорганизмов, обращал на себя внимание факт практически полного отсутствия (менее 1%) у фертильных пациенток и присутствие у бесплодных женщин с неудачами ЭКО следующих родов микроорганизмов: Streptococcus (3,2% в 1-й группе), Ralstonia (7,9% в 1-й группе), Pediococcus (4,8% в 1-й группе), Clostridium (4,0% в 1-й группе). При этом бактерии, которые регистрировались у фертильных пациенток, но не обнаруживались в значимых долях (более 1%) у пациенток с бесплодием, были представлены родами Acinetobacter (1,7% во 2-й группе), Anaerobacillus (1,3% во 2-й группе), Cupriavidus (1,1% во 2-й группе), Curvibacter (2,0% во 2-й группе), Delftia (2,8% во 2-й группе), Paucibacter (1,3% во 2-й группе), Prevotella (1,7% во 2-й группе), Shlegelella (1,3% во 2-й группе).
Обсуждение
Выполненное нами исследование имело ряд ограничений. Первое из них заключалось в объеме выборки: 20 пациенток из 1-й группы и 15 из 2-й группы не могут быть репрезентативными для популяции в целом, однако могут указывать на некоторый тренд, подлежащий дальнейшему изучению. Поэтому полученные результаты требуют дальнейших исследований на больших когортах пациентов.
Другое ограничение настоящего исследования касалось отсутствия негативных контрольных образцов. В научных публикациях, посвященных изучению микробиома биотопов сложных локализаций, все большее значение придается не только наличию контрольных образцов, но и их отрицательным значениям. Если микробиота эндометрия действительно существует, то она представлена в очень низких концентрациях, и, следовательно, ее молекулярные характеристики подвержены влиянию фонового загрязнения ДНК из наборов для экстракции, а также реагентов для ПЦР и секвенирования [29]. По этой причине загрязняющая ДНК может составлять значительную часть, если не все, регистрируемых молекулярных микробных сигнатур внутри эндометрия. Поэтому необходимо, чтобы в исследования микробиоты эндометрия были включены технические средства контроля потенциальных источников фонового загрязнения ДНК, а также необходимо подробное представление микробных профилей этих контрольных образцов. Большинство из имеющихся на сегодняшний день исследований либо не включают в себя контрольные образцы, либо данные об их микробном профиле представлены недостаточно. При секвенировании контрольных образцов питательной среды или воздуха из операционной количество ридов должно в сотни раз быть меньше количества ридов материала из эндометрия. Потенциальная микробная контаминация возможна из наборов для экстракции, питательной среды, воздуха, что может сильно влиять на достоверность результатов, интерпретацию клинической значимости идентифицированных микроорганизмов. Поэтому роль отрицательных контролей имеет колоссальное значение. Однако это увеличивает стоимость исследования практически в 3 раза, что не может не затруднять планирование работы.
Третье ограничение заключалось в способе забора материала для исследования – это трансцервикальный доступ. В большей части из существующих на сегодняшний день в мире исследований микробиома эндометрия забор материала осуществлялся трансцервикально, что, возможно, сопряжено с контаминацией образцов эндометрия микробами или микробными молекулярными сигналами из влагалища и цервикального канала. В большинстве исследований на сегодняшний день, в которых материал для секвенирования был забран трансцервикальным доступом, отмечено присутствие лактобациллярной микрофлоры, характерной для вагинального микробиома. При этом в исследованиях, в которых забор материала проводился трансабдоминальным способом, представленность микроорганизмов была больше. Так, Chen et al. использовали секвенирование 16S рРНК для оценки микробиома как нижних, так и верхних отделов женского репродуктивного тракта, показав, что для верхних отделов средняя доля лактобактерий составляет всего 1,7% (маточные трубы). В эндометрии при этом относительная представленность лактобактерий составила 30,6%, но при этом широко представлены были Acinetobacter (9,1%), Pseudomonas (9,1%), Vagococcus (7,3%), Sphingobium (5,0%) и Comamonadaceae (4,9%) [15]. Walther-Antonio et al. обследовали 10 женщин после гистерэктомии, связанной с доброкачественными новообразованиями. В миометрии и эндометрии Lactobacillus встречались в крайне низких долях. При этом самыми представленными в эндометрии были Shigella и Barnesiella [17]. В исследовании, в котором материал был получен из средней трети эндометрия после гистерэктомии, также не было зарегистрировано доминирования лактобактерий [30], а эндометриальные бактериальные профили были представлены в основном Acinetobacter, Pseudomonas, Comamonadaceae и Cloacibacterium. Таким образом, во всех исследованиях, в которых способ забора материала был трансцервикальным, доложено о преобладании лактобактерий в составе микробиома матки, при этом при других способах получения образцов микробиом был более вариабельным.
Значимость представленного нами исследования состоит в нескольких позициях. Во-первых, представленные данные подтверждают концепцию нестерильности эндометрия и существования маточного микробиома в целом. Однозначно секвенирование дает возможность выявить присутствие бактерий в эндометрии, но результаты самого анализа не позволяют дать количественную оценку этого присутствия, то есть сказать, сколько именно бактерий обнаружено в конкретном образце, невозможно.
Мы получили статистически значимые отличия между группами по следующим родам микроорганизмов: Acidovorax, Brevibacillus, Brevundimonas, Caulobacter, Comamonas, Delftia, Distigma, Pseudomonas, Ralstonia, Schlegelella, Thermus. Однако их средняя относительная представленность в составе маточного микробиома была зачастую менее 1%, поэтому дискутабелен вопрос их влияния на процессы имплантации оплодотворенной яйцеклетки.
Полученные нами данные подтверждает существующую на сегодняшний день концепцию доминирования лактобактерий в маточном микробиоме. Учитывая анатомическое соседство полости матки и эндометрия с основным источником лактобактерий в репродуктивной системе – с влагалищем – и существование перистальтических маточных контракций, способствующих захвату лактобактерий из влагалища и восходящему пути попадания их в полость матки, доминирование именно лактобактерий становится объяснимым и логичным фактом. Различные данные о процентной доле лактобактерий в составе микробиома могут объясняться местом забора материала для изучения: чем ближе к области цервикального канала, тем процент лактобактерий выше, чем ближе к области дна матки, тем, очевидно, этот процент меньше.
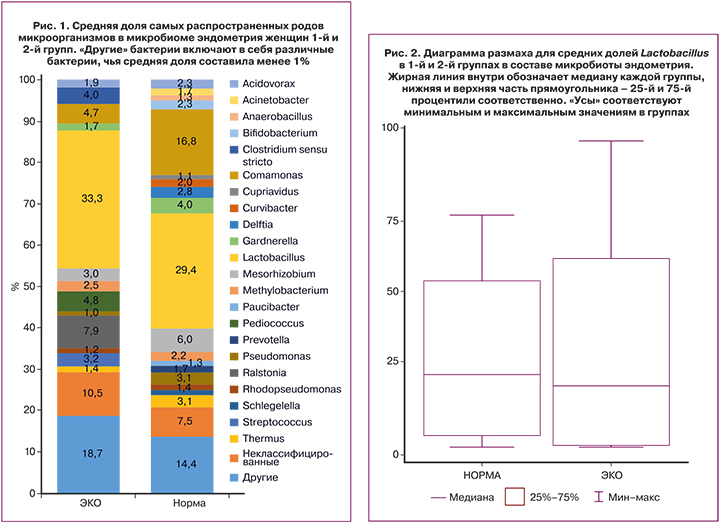
Кроме того, наши данные опровергают теорию лактобациллярного и нелактобациллярного микробиома в генезе неудач имплантации оплодотворенной яйцеклетки. По нашим данным, доли лактобактерий у фертильных пациенток и у пациенток с многократными неудачами ВРТ значимо не отличались и составляли 33,3 и 29,4% соответственно (рис. 1). Не исключено, что это связано с местом забора материала – в нашем исследовании это дно матки, то есть максимально отдаленный от источника лактобактерий (влагалища) локус матки. Кроме того, относительная представленность лактобактерий более 50% в составе микробиома регистрировалась всего у 5 из 15 женщин из группы фертильных пациенток и у 7 из 20 женщин из группы женщин с неудачами ВРТ (рис. 3); абсолютное доминирование лактобактерий – более 90% – отмечено всего у 3 женщин из всей выборки (35 человек), что не соотносится с данными Moreno [15]. По всей вероятности, не только относительная представленность лактобактерий влияет на успешность имплантации; необходим поиск тех патогенных микроорганизмов, которые запускают каскад воспалительных реакций в эндометрии, тем самым определяя нарушение имплантации. Важно изучение микробиома эндометрия содружественно с маркерами хронического эндометрита, с данными гистологического исследования эндометрия при биопсии.

Согласно полученным нами данным, в группе женщин с бесплодием и многократными неудачными попытками ЭКО регистрировались статистически значимо более высокие относительные доли бактерий рода Brevundimonas и Ralstonia, а у фертильных женщин 2-й группы регистрировались статистически значимо более высокие доли Acidovorax, Brevibacillus, Caulobacter, Comamonas, Delftia, Distigma, Pseudomonas, Schlegelella, Thermus. Имеет ли клиническое значение эта статистически значимая разница – остается неясным, поскольку, во-первых, средняя относительная представленность этих родов бактерий была менее 1%; во-вторых, все эти микроорганизмы являются условно-патогенными и приводят к развитию заболевания только при сопутствующих обстоятельствах.
Самыми представленными в группе здоровых фертильных пациенток были роды Lactobacillus, Comamonas и Mesorhizobium, а в группе бесплодных пациенток с многократными неудачами ЭКО – Lactobacillus, Ralstonia и Pediococcus. Касательно Lactobacillus, их биологическая роль в составе микробиоты более или менее ясна. Что касается Comamonas, этот род относится к условно-патогенным микроорганизмам, устойчивым во внешней среде и характерным для желудочно-кишечного тракта [31]. Mesorhizobium являются также условно-патогенными микроорганизмами, которые встречаются в природе в качестве симбионта растений, однако имеются единичные сообщения о причастности их к развитию перитонита [32]. Ralstonia характерны в целом для такой экониши, как вода; способны выживать в условиях малого обеспечения нутриентами; у человека причастны к возникновению остеомиелитов и менингитов [33]. Pediococcus являются бактериями, продуцирующими молочную кислоту, используются в качестве пробиотиков. Роль всех этих родов микроорганизмов в составе маточного микробиома остается на сегодняшний момент еще недостаточно изученной [34].
Заключение
Настоящее исследование, безусловно, подтверждает, что даже такие труднодоступные для изучения локусы, как эндометрий, не являются стерильными. Безусловно, эндометрий не является таким «густонаселенным» биотопом, как, например, кишечник, и концентрация бактерий здесь ничтожно мала, однако нельзя не учитывать роль обнаруживаемых микроорганизмов в генезе различных гинекологических заболеваний и акушерских проблем.
Наши данные подтверждают теорию доминирования лактобактерий в составе микробиома эндометрия; однако доля лактобактерий значимо не различалась у здоровых пациенток и пациенток с неудачами ВРТ, поэтому доминирование лактобактерий нельзя рассматривать как фактор, определяющий безусловный успех имплантации.
Очевидно, что механизмы, обеспечивающие положительный результат при имплантации оплодотворенной яйцеклетки, являются более тонкими и включают в себя, помимо влияния тех или иных патогенных микроорганизмов, еще и состояние локального иммунного ответа эндометрия. В этой связи целесообразнее изучать состав микробиома эндометрия в тесной связи с маркерами эндометрита, включать в алгоритмы диагностики оценку функционального состояния эндометрия (допплерометрия маточных спиральных артерий), оценивать морфологию ткани при биопсии.
Кроме того, знание о составе микробиома эндометрия влечет за собой необходимость разработки алгоритмов коррекции дисбиоза, и в этом случае крайне важно учитывать пути попадания микроорганизмов в полость матки – восходящий из влагалища, гематогенный из кишечника и ротовой полости. Все это составляет обширные перспективы для дальнейшего исследования.



