Толщина эндометрия (ТЭ) является одним из основных общепризнанных маркеров его рецептивности. Минимальной ТЭ, необходимой для успешного переноса эмбриона, считается 7–8 мм, хотя до настоящего времени еще отсутствует стандартизированное диагностическое значение для «тонкого эндометрия» [1]. Прогностическая ценность этого показателя противоречива, так как есть данные, где беременность наступает у пациенток с ТЭ 4–5 мм [2]. В то же время все существующие современные маркеры эндометрия, оцениваемые с помощью ультразвука, биопсии эндометрия, аспирации жидкости эндометрия, гистероскопии и т.д., демонстрируют недостаточную прогностическую ценность для клинических событий беременности [3].
Точной статистики распространенности тонкого эндометрия в литературе не содержится. Одни авторы выделяют всего от 1 до 2,5% в циклах вспомогательных репродуктивных технологий (ВРТ) [4], другие считают, что эта цифра в циклах стимуляции может достигать от 38 до 66% [5].
Достоверно известно, что у пациенток с данной патологией более низкие показатели клинической беременности и живорождения, причем вне зависимости от возраста, времени переноса эмбриона (например, стадии дробления или стадии бластоцисты) или количества ооцитов при заборе [6]. Тонкий эндометрий связан с более высокой частотой патологии плаценты [7], а ТЭ прямо пропорциональна риску предлежания плаценты и внематочной беременности [8]. Тонкий эндометрий увеличивает риск преждевременных родов, акушерских осложнений и рождения детей с малым весом [9].
Учитывая негативные последствия, к которым может привести наличие у пациентки тонкого эндометрия перед беременностью, представляется важным и необходимым использование наиболее эффективного метода терапии.
На сегодняшний день предложено множество стратегий лечения тонкого эндометрия. Непостоянство в увеличении ТЭ является распространенным ограничением следующих методов лечения: цитрат тамоксифена в качестве средства для индукции овуляции, иглоукалывание, длительный прием пентоксифиллина и токоферола или только токоферола, низкие дозы хорионического гонадотропина человека во время подготовки эндометрия, аспирин, лютеиновый гонадотропин, введение агонистов, высвобождающих гормоны, и расширенная терапия эстрогенами (увеличение дозы эстрогена или продление продолжительности приема эстрогена) [5].
В попытках усовершенствовать данные подходы использовалась иммуномодулирующая терапия: иммуноглобулины, инфузия интралипидов, применение гранулоцитарного колониестимулирующего фактора, подкожное введение ингибиторов фактора некроза опухоли (ФНО)-альфа, ингибирующего фактора лейкемии, пероральное введение глюкокортикоидов противовоспалительного действия, иммунодепрессантов, препаратов, используемых для пациентов с трансплантацией (например, такролимус). К большому сожалению, ни один из методов не может полностью решить задачу восстановления нормальной функции эндометрия [10].
Эндометрий представляет собой ткань с высокой регенеративной способностью в течение каждого цикла, где ответ на половые стероидные гормоны зависит от состояния локального микроокружения, которое создается стромальными, эпителиальными, эндотелиальными и иммунными клетками эндометрия [11].
Известно, что тонкий эндометрий характеризуется недостаточной пролиферацией клеток и дисфункциональными клетками. В настоящее время клеточные и молекулярные механизмы тонкого эндометрия остаются не до конца изученными, именно поэтому возможности лечения данной патологии ограничены и противоречивы из-за ее сложного патогенеза.
Чтобы обеспечить эффективное восстановление и регенерацию эндометрия в условиях медицинского учреждения клеточная терапия была предложена как альтернатива стимуляции регенерации эндометрия, включая использование стволовых клеток, плазмы, богатой тромбоцитами (PRP), мононуклеаров периферической крови (МНПК) [12] и факторов роста в качестве терапевтических агентов. В целом механизмы действия методов включают индукцию цитокинов, выработку факторов роста, снижение активности естественных клеток-киллеров, уменьшение Th17 и Th1, а также увеличение Treg-клеток и Th2 [13]. Со временем было признано, что за реализацию терапевтических эффектов в основном отвечают не используемый тип клеток, а его паракринные факторы [14].
Вместе эти паракринные факторы имеют собирательное название «секретом» и могут быть изолированы отдельно от клетки для терапевтических целей [15]. Секретом включает различные сывороточные белки, факторы роста, ангиогенные факторы, противомикробные пептиды, гормоны, цитокины, белки матрикса, протеазы и ферменты, а также внеклеточные везикулы, которые транспортируют липиды, белки, подтипы РНК и ДНК, хемокины и даже в небольшом количестве – липидные медиаторы. Состав секретома динамичен и зависит от типа клеток и раздражителей микроокружения, он играет важную роль во многих биологических функциях, включая гомеостаз, передачу сигналов, иммуномодуляцию, воспаление, ангиогенез, апоптоз, протеолиз, адгезию и организацию внеклеточного матрикса и т.д.
Однако в целом известно, что секретом, к примеру, стволовых клеток или МНПК, обладает терапевтическими эффектами, необходимыми для восстановления тканей, такими как проангиогенный, антиапоптотический, антифибротический, противовоспалительный и иммуномодулирующий [16–18].
Бесклеточная терапия на основе секретомов имеет существенные преимущества перед использованием живых клеток в плане безопасности применения, а также производственную масштабируемость, доступность и более длительный срок хранения [19]. В последнее десятилетие секретомная терапия стала многообещающим подходом к преодолению ограничений, связанных с клеточной терапией для регенерации тканей и органов [20].
Одним из самых доступных секретомов в выделении и производстве лекарственных форм считается секретом МНПК (СМНПК). Согласно исследованиям, секретомы МНПК и стволовых клеток имеют схожий набор регуляторных молекул и, соответственно, обладают аналогичным терапевтическим действием на регенерацию [18].
В мировой литературе существуют публикации, доказывающие репаративные свойства СМНПК при применении у пациентов с диабетической стопой, кожными ранами [21], после экспериментального острого инфаркта миокарда [22], при ожогах, повреждениях нервов и т.д.
Использование СМНПК в терапии тонкого эндометрия в доступной литературе отсутствует.
Учитывая регенеративный потенциал и безопасность данного биологического метода, нам представляется возможным применение секретомов для улучшения толщины и рецептивности эндометрия у пациентов с бесплодием.
Первенство в разработке и клиническом применении СМНПК принадлежит отечественным ученым [23]. Задолго до появления термина «секретом» отечественная литература оперировала его аналогом – термином «лимфокины» (биологически активные вещества, синтезируемые и выделяемые всеми популяциями лимфоцитов, с их помощью осуществляются кооперация, координация и регуляция функции клеток) [24]. Соответственно, получаемый СМНПК, который находился в надосадочной жидкости после центрифугирования (супернатант) активированных мононуклеаров, имел название «супернатант лимфокинов», или, сокращенно, «суперлимф». Данный метод широко применяется в клинической практике в разных нозологиях, где он неоднократно демонстрировал регенеративный, противовоспалительный и антибактериальный эффекты, подтвержденные в более чем 300 научно-клинических работах (www.dissercat.com), на фоне отсутствия побочных явлений. Также с 2010 г. в гражданском обороте присутствует единственное лекарственное средство на основе ксеногенного СМНПК под историческим названием «Суперлимф».
Препарат «Суперлимф» (ЛП-№(004385)-(РГ-RU)) представляет собой естественный комплекс природных противомикробных пептидов и цитокинов с активностью фактора, угнетающего миграцию макрофагов, ИЛ-1, ИЛ-6, ФНО, трансформирующего фактора роста. Препарат обладает иммуномодулирующим, противовирусным и противомикробным действиями, стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, ФНО), индуцирует противоопухолевую цитотоксичность макрофагов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров.
Так как отсутствует необходимость приготовления секретома в лабораторных условиях при наличии доступной лекарственной формы, мы посчитали целесообразным использовать данный препарат для терапии пациенток с тонким эндометрием. Стоит отметить, что в отечественной литературе уже существуют публикации, описывающие положительное влияние суппозиториев, содержащих СМНПК, на состояние эндометрия. К примеру, Суперлимф использовался в комплексной терапии у пациенток с подтвержденным хроническим эндометритом (ХЭ). Исследователями были продемонстрированы более выраженное купирование хронического воспаления по сравнению со стандартной терапией, а также нормализация рецептивности эндометрия (за счет увеличения числа пиноподий (в 1,27 раза) при сохранении превалирования экспрессии рецепторов прогестерона над рецепторами эстрогенов) [25], улучшение показателей васкуляризации [26].
В рандомизированном плацебо-контролируемом слепом исследовании по оценке эффективности препарата в комплексном лечении ХЭ у пациенток с бесплодием было показано, что на фоне патогенетически обоснованной терапии верифицирована тенденция к восстановлению рецепторного профиля эндометрия, данные подтверждались результатами молекулярно-генетических и иммуногистохимического исследований [27].
Выявленные положительные эффекты, предположительно, будут полезны в терапии тонкого эндометрия, так как известно, что одним из механизмов, приводящим к явлению тонкого эндометрия, является аномальное ремоделирование сосудов спиральных артерий. Тонкий эндометрий характеризуется склерозом сосудов и сниженным кровоснабжением плаценты. Это ставит под угрозу плацентацию и рост плода и, таким образом, приводит к неблагоприятным перинатальным исходам [28].
Масштабное исследование с использованием препарата проведено Дикке Г.Б. и соавт. В работе описано клинико-морфологические исследование 2252 пациенток с ХЭ и бесплодием. Авторами показано, что общая частота наступления спонтанной беременности в течение 6 месяцев после лечения составила 44,9% в группе СМНПК против 26,1% в группе контроля. Использование препарата «Суперлимф» в комплексной терапии способствовало увеличению шансов наступления беременности в 1,5 раза (ОР=1,58; 95% ДИ 1,40–1,78) по сравнению со стандартной терапией, вне зависимости от приема прогестерона.
Спонтанное наступление беременности наблюдалось в группе Суперлимфа у 33,7% пациенток, со стандартной терапией – у 17,4%, р=0,0001 (ОР=1,93; 95% ДИ 1,66–2,25). Показатель живорождения составил 37,3% и 21,1% соответственно, р<0,001 (ОР=1,77; 95% ДИ 1,55–2,03). Также отмечены снижение риска выкидышей в ранние сроки в 6,3 раза и уменьшение риска рождения недоношенного ребенка почти в 2 раза [29].
Примечательно, что в другом исследовании тех же авторов, но у пациенток с ХЭ и бесплодием, прошедших программы ВРТ с переносом криоконсервированного эмбриона, на фоне приема препарата «Суперлимф» беременность наступила у 57,0% против 38,7% в контрольной группе (ОР=1,47; 95% ДИ: 1,24–1,75, р<0,001), живорождение – у 45,3% и 20,7% соответственно (ОР=2,19; 95% ДИ: 1,70–2,83, р<0,0001) [30].
Цель исследования: оценить влияние СМНПК на ТЭ у женщин с тонким эндометрием и бесплодием.
Материалы и методы
Набор пациенток осуществлялся из числа обратившихся в специализированный центр ЭКО клиники ноября 2023 г. В исследование включены 252 пациентки репродуктивного возраста (медианное значение – 36 (33–38) лет), перед проведением программы ВРТ. Подписано информационное согласие. При статистическом анализе использовались методы наблюдения, группировки и расчет средних величин.
Критерии включения: возраст 18–45 лет; бесплодие (N97.0, N97.1, N97.4, N97.8, N97.9); не менее двух неудачных циклов ВРТ в анамнезе; толщина эндометрия менее 8 мм в период предполагаемого имплантационного окна; овуляторный менструальный цикл; проведение терапии тонкого эндометрия другими методами в предыдущих попытках (включая высокие дозы эстрогенов, внутриматочные инсталляции гемопоэтическим фактором роста, магнитотерапия и др.).
Критерии исключения: мужской фактор бесплодия; миома матки, полипы, генитальный эндометриоз; пороки развития матки; наличие соматической и онкологической патологии; инфекции, передающиеся половым путем в настоящее время и в течение предыдущих 2–3 месяцев; наличие внутриматочных вмешательств в течение предыдущих 12 недель.
Всем женщинам проведены комплексное клинико-лабораторное обследование и трансвагинальное ультразвуковое исследование (УЗИ). Диагностическая гистероскопия проведена всем пациенткам.
УЗИ проводилось на 5, 9, 11, 14-й дни менструального цикла. До начала исследования ТЭ у пациенток варьировала от 3,2 до 6,7 мм (в среднем – 6,25 мм). Клинико-статистический анализ анамнеза, состояния репродуктивного и общесоматического здоровья, социального статуса показал, что все обследованные женщины проживали в идентичных климатогеографических условиях (Урал); среднее образование имели 17% (44/252), среднее специальное – 42% (105/252) и высшее – 41% (103/252). Профессиональных вредностей не было. Неудачные попытки программ ВРТ заканчивались неразвивающейся беременностью у 13,9% (35/252), самопроизвольными выкидышами – у 9,9% (25/252), беременность не наступала у 76,2% (192/252).
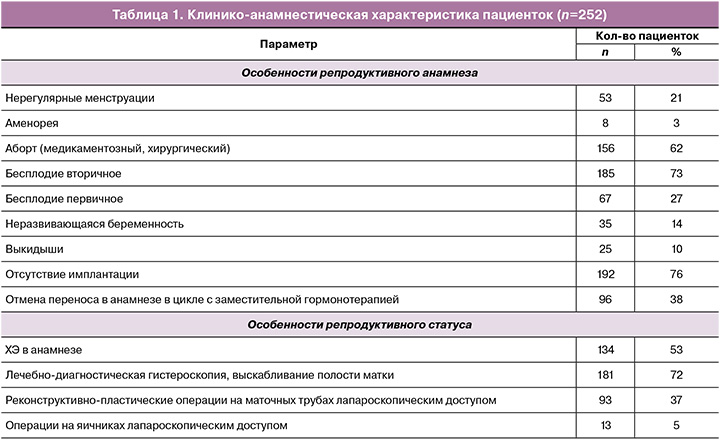
Клинико-анамнестическая характеристика пациенток представлена в таблице 1.
После комплексного обследования пациенток на этапе прегравидарной подготовки эндометрия перед переносом криоконсервированного эмбриона на фоне гормональной заместительной терапии (с 5-го по 25-й день применялись препараты эстрадиола валерата или эстрадиола в форме гемигидрата с добавлением в лютеиновую фазу, с 16-го по 25-й день, препаратов микронизированного прогестерона или прогестерона в виде вагинального геля) использовался СМНПК (Суперлимф 25 ЕД) в суппозиториях вагинально 1 раз в день на ночь, с 5-го по 25-й день менструального цикла, сроком от 2 до 3 месяцев до удовлетворительных значений толщины эндометрия (более 8 мм) (рисунок).

Если ТЭ на 21–23-й день менструального цикла не достигала 8 мм, пациентке назначался следующий курс с применением СМНПК.
Для подтверждения наступления беременности исследовали содержание бета-субъединицы хорионического гонадотропина человека в крови на 12-й и 14-й дни после переноса эмбрионов. УЗИ органов малого таза проводили на 21-й и 28-й дни после переноса эмбрионов.
Результаты
Проведена оценка ТЭ матки (М-эхо) по данным УЗИ до и после комплексной терапии. Данные представлены в таблице 2.
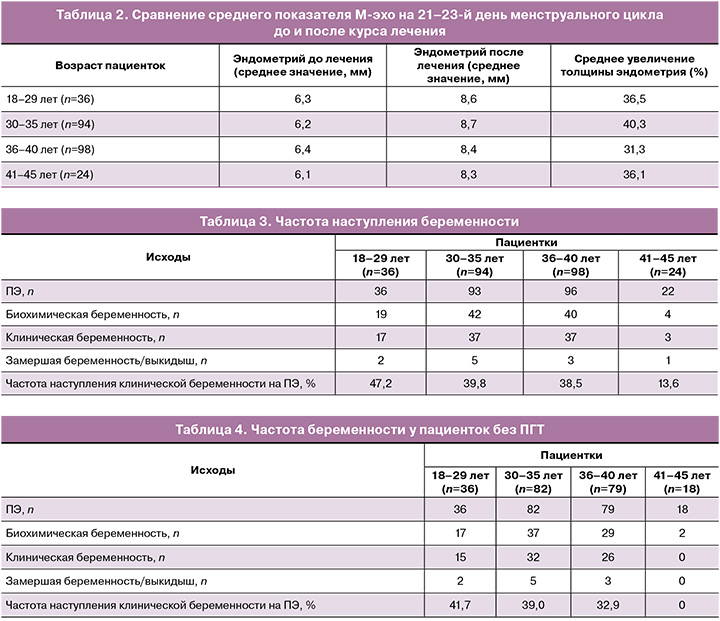
Отмечено значимое увеличение среднего показателя ТЭ по данным УЗИ – до 8,5 мм. У 80,2% (202/252) пациенток по окончании терапии ТЭ превышала 8 мм, из них у 46,5% (94/202) ТЭ составляла 8–9 мм, у 33,7% (68/202) – 9–10 мм, у 19,8% (40/202) – свыше 10 мм. У 17,9% (45/252) пациенток наблюдалось увеличение ТЭ на фоне проводимой терапии, но ТЭ не достигла 8 мм после трех курсов. У 2% (5/252) женщин ТЭ не изменилась относительно состояния до лечения и не превышала 7,4 мм.
По нашим данным, для достижения ТЭ более 8 мм в среднем понадобилось проведение от двух до трех курсов комбинированной с СМНПК терапии, причем чем моложе женщина, тем короче курс. Из 202 назначений один курс комбинированной терапии прошли 9 пациенток (4,5%), два курса – 110 (54,5%), три – 65 (32,2%) и четыре курса – 18 (8,9%). Решение о проведении последующих курсов принималось на основе динамики увеличения ТЭ по согласованию с пациенткой и не носило регламентированный характер.
Перенос криоконсервированного эмбриона (ПЭ) был осуществлен в 247 случаях, из них в 215 – без преимплантационного генетического тестирования (ПГТ) эмбрионов. ПГТ эмбрионов проведено у 32 пациенток. В связи с тем, что у 5 женщин отсутствовала динамика улучшения ТЭ после проведенных нескольких курсов лечения, было принято решение о прекращении существующей терапии и отмене переноса. Напротив, ПЭ был осуществлен у 45 пациенток с положительной динамикой увеличения ТЭ, но не достигшей 8 мм.
Наступление самостоятельной беременности в исследовании не зарегистрировано.
Общая частота биохимической беременности составила 42,5% (105/247), а частота клинической беременности – 38,1% (94/247). Доклиническая потеря беременности (отторжение оплодотворенного ооцита в первые 10–14 дней после зачатия) определена у 11 пациенток (4,5% от числа ПЭ). Частота наступления клинической беременности на ПЭ у пациенток 18–29 лет составила 47,2% (17/36), 30–35 лет – 39,8% (37/93), 36–40 лет – 38,5% (37/96), 41–45 лет –13,6% (3/22). Данные приведены в таблице 3.
В группе пациенток, которым был проведен ПЭ без ПГТ, частота биохимической беременности составила 39,5% (85/215), частота клинической беременности – 35% (75/215). Доклиническая потеря беременности отмечена у 10 (4,6%) пациенток. Частота наступления клинической беременности на ПЭ у пациенток 18–29 лет составила 41,7% (15/36), 30–35 лет – 39,0% (32/82), 36–40 лет – 32,9% (26/79), 41–45 лет – 0% (0/18) (табл. 4).
В группе пациенток, которым был проведен ПЭ с ПГТ, частота биохимической беременности составила 62,5% (20/32), частота клинической беременности – 50% (16/32). Доклиническая потеря беременности имела место у 4 пациенток (12,5%). Частота наступления клинической беременности на перенос у пациенток 30–35 лет – 57,1% (4/7), 36–40 лет – 52,6% (10/19), 41–45 лет – 33,3% (2/6) (табл. 5).
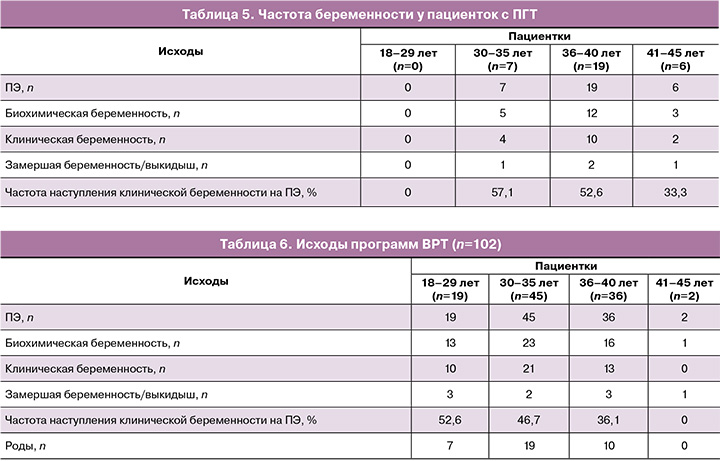
На момент написания статьи для анализа данных частоты живорождения были доступны 102 пациентки за 2022 г., прошедшие комбинированное лечение с СМНПК. Родами завершились 35,3% (36/102) беременностей после переноса одного криоконсервированного эмбриона. У пациенток 18–29 лет – 36,8% (7/19), 30–35 лет – 42,2% (19/45), 36–40 лет – 27,8% (10/36), 41–45 лет – 0% (0/2). У данных пациенток можно было проследить общую частоту биохимической беременности – 52,0% (53/102) и частоту клинической беременности – 43,1% (44/102). Доклиническая потеря беременности у 9 пациенток составила 8,8% от числа ПЭ. Частота наступления клинической беременности на ПЭ у пациенток 18–29 лет составила 52,6% (10/19), 30–35 лет – 46,7% (21/45), 36–40 лет – 36,1% (13/36), у пациенток 41–45 лет – 0% (0/2). Данные приведены в таблице 6.
Самые низкие показатели биохимической беременности и частота клинической беременности – 26,7% (12/45) и 20,0% (9/45) соответственно, наблюдались у пациенток, у которых имело место увеличение ТЭ на фоне проводимой терапии, но ТЭ не достигла 8 мм после трех курсов.
О побочных реакциях не сообщалось.
Обсуждение
В течение жизни женщины эндометрий до 400 раз претерпевает цикличные изменения, связанные с регенерацией, секрецией, децидуализацией и десквамацией. Основой всех этапов является воспаление, которое завершается ремоделированием и образованием новых тканей. Физиология эндометрия – динамичный межклеточный диалог между составляющими его клетками – эпителиальными, стромальными, сосудистыми и иммунными. Трансформацию эндометрия сравнивают с поврежденной, или «раневой» поверхностью [31]. Тонкий эндометрий демонстрирует признаки дисбаланса регенеративного процесса, где происходит не только снижение ответа на стероиды в связи с уменьшенной экспрессией эстрогеновых и прогестероновых рецепторов, но и пролиферации как в стромальных, так и в эпителиальных клетках с повышенным клеточным старением и избыточным отложением коллагена, а также нарушение ангиогенеза и снижение количества Т-клеток, NK-клеток и макрофагов [32].
Процессы регуляции воспаления и регенерации многофакторны, в них участвуют различные классы клеточных мессенджеров (цитокины, хемокины, ростовые факторы, липиды, мРНК, противомикробные пептиды и т.д.), и недостаток некоторых из них может приводить к нарушению формирования тканей [33]. При применении биологических методов, таких как PRP, МНПК и др., используется основной принцип клеточной терапии – «адресная доставка генетических конструкций и биомолекул», что приводит к стимуляции собственных клеток организма и усилению репаративной регенерации [34]. В сравнительной оценке эффективности и безопасности 36 методов лечения или вмешательств при повторных неудачах имплантации 2023 г. отмечается, что внутриматочная инстилляция МНПК ((1–100) × 106 клеток/мл) может улучшить частоту имплантации, кумулятивную частоту наступления беременности и частоту живорождения. МНПК координируют весь процесс имплантации и поддерживают эмбриональное развитие, усиливая рецептивность эндометрия через местные иммунные клетки и индукцию гормонов в микроокружении эндометрия [35].
В метаанализе применения внутриматочной инстилляции МНПК при неудаче имплантации отмечалась высокая (в 2 раза) вероятность клинической беременности (ОР 1,92, 95% ДИ: 1,48–2,49; P<0,001) и живорождения (ОР 1,93, 95% ДИ: 1,35–2,76; P<0,001) у женщин, получавших МНПК, по сравнению с контрольной группой [36].
Бесклеточный СМНПК содержит спектр секретируемых регуляторных паракринных факторов живых МНПК и, соответственно, воспроизводит подобный терапевтический эффект [37].
Учитывая сложность физиологии эндометрия, а также нарушения клеточной регуляции как основы патогенеза тонкого эндометрия, лекарственное средство на основе СМНПК может воздействовать на многие звенья процессов восстановления эндометриальной функции.
В литературе встречается несколько схем применения препарата, которые не совпадают с рекомендованными в его инструкции «от 10 до 20 дней», что означает – идет поиск оптимального применения. Из полученных нами и другими коллегами результатов следует, что режим использования СМНПК в суппозиториях имеет терапевтическое значение. Применение препарата «Суперлимф» 25 ЕД в течение 40 дней 1 раз в день в прегравидарной подготовке эндометрия имело преимущество перед режимом 1 раз в день в течение 20 дней по показателям частоты наступления беременности и коррекции локального иммунитета эндометрия [26]. Примечательно, что в программах ВРТ с переносом криоконсервированного эмбриона до удовлетворительных значений готовности эндометрия в среднем требовалось 2–3 курса по 20 суппозиториев «Суперлимф» 25 ЕД 1 раз в день [30], что соответствовало нашим данным.
Согласно полученным нами результатам, общая частота клинической беременности и частота живорождения достигала 38,1% и 35,3% соответственно. Важно отметить, что циклы, где ПЭ осуществлялся с ПГТ, показатели частоты биохимической беременности и частоты клинической беременности превышали таковые у группы ПЭ без ПГТ (62,5% и 50,0% по сравнению с 39,5% и 35,0% соответственно), оставаясь при этом высокими независимо от возраста пациенток. Соответственно, использование терапии СМНПК и выполнение ПГТ перед ПЭ в 1,4 раза увеличило результативность терапии.
Нами было продемонстрировано увеличение среднего показателя М-эхо после курсов СМНПК у 80,2% пациенток до 8 мм и более. Положительная динамика наблюдалась у 98,0% пациенток, не отвечавших на предшествующие варианты лечения. Возможно, это связано с влиянием на пролиферативную активность эндометрия.
Таким образом, применение СМНПК в суппозиториях способствует улучшению репродуктивных исходов у пациенток с маточной формой бесплодия и невынашиванием беременности, обусловленными гипопластическим тонким эндометрием. Анализ данных использования препарата «Суперлимф» в нашей клинике указывает на необходимость дальнейшего изучения и организации хорошо спланированных рандомизированных сравнительных исследований для возможного включения СМНПК в протоколы преимплантационной подготовки пациенток. Данный метод получил патент на изобретение № RU 2835449.
Заключение
Использование СМНПК в суппозиториях вагинально в комбинации со стандартной терапией способствует увеличению ТЭ, повышению частоты наступления беременности и живорождения у пациенток с бесплодием, имеющих в анамнезе две и более попытки ВРТ, и наличием тонкого эндометрия, не поддающегося терапии другими методами, в том числе не отвечающего на высокие дозы эстрогенов, что может стать перспективным направлением в поиске способов преодоления репродуктивных неудач.



