Развитие женской репродуктивной системы состоит из нескольких этапов трансформации парамезонефральных (мюллеровых) протоков, которые закладываются в виде тяжей к концу 1-го месяца внутриутробной жизни. Далее происходит формирование парных каналов, дистальные отделы которых сближаются, формируя с 6-й по 13-ю неделю развития срединную сагиттальную перегородку. Разграничение на фаллопиевы трубы, тело матки, шейку и верхнюю треть влагалища происходит с 12-й по 14-ю неделю. К концу 20-й недели происходит редукция срединной сагиттальной перегородки, а матка и влагалище становятся однополостными. Таким образом, женские половые пути формируются с 6–8-й по 16–18-ю неделю эмбрионального развития. Дефекты эмбрионального развития на любой из стадий могут приводить к появлению различных аномалий, соответствующих данному периоду эмбриогенеза.
Этиология аномалий матки и влагалища остается на сегодняшний день предметом дискуссии. Предполагается роль наследственной предрасположенности формирования пороков развития органов женской репродуктивной системы, однако молекулярно-генетические предикторы развития данной патологии не определены. В качестве другой гипотезы рассматривается влияние различных экзогенных тератогенных факторов на 6–18-й неделях гестации.
Пороки развития матки и влагалища в 63,7% случаев сочетаются с аномалиями развития других органов и систем, чаще с аномалиями мочевыделительной системы – 48,3% [1].
Общая распространенность врожденных пороков развития женских половых путей у женщин репродуктивного возраста, по разным данным, находится в пределах 5,5–6,7%; у женщин с бесплодием – в 7,3–8,0% случаев, а у пациенток с привычным невынашиванием беременности – в 13,3–16,7% [2, 3]. Пороки развития мочеполовой системы занимают 4-е место (9,7%) в структуре всех аномалий развития человека [4].
Аномалии половых органов, в зависимости от формы и вида, могут проявляться болью с началом менструаций, невозможностью половой жизни, отсутствием менструаций, нарушениями менструального цикла либо нарушением репродуктивной функции. При этом основными причинами нарушения репродуктивной функции у данных пациенток выступают аномалии строения матки, которые приводят к изменениям маточно-плацентарного кровотока, истмико-цервикальной недостаточности.
Клинически пороки развития можно разделить на пороки, не связанные с нарушением оттока менструальной крови, и пороки, связанные с нарушением оттока менструальной крови, которые приводят к выраженному болевому синдрому, развитию гематометры, гематокольпоса и распространенного эндометриоза [1].
Подходы к лечению вариабельны и зависят от клинических проявлений и/или возможного влияния на репродуктивный потенциал женщины.
Полноценная диагностика включает в себя сбор анамнеза, гинекологический осмотр, ультразвуковое исследование (УЗИ) и магнитно-резонансную томографию (МРТ), гистероскопию и лапароскопию. Гистеросальпингография в настоящее время не используется для диагностики пороков развития и полностью заменена МРТ.
Ранняя диагностика врожденных аномалий женской репродуктивной системы в препубертатном периоде позволяет избежать соответствующих клинических проявлений и возможных серьезных осложнений [5].
Методы диагностики пороков развития женской репродуктивной системы
Основным методом диагностики пороков развития женской репродуктивной системы является УЗИ, однако даже после установления предварительного диагноза зачастую требуется дальнейшее обследование с целью точного определения типа врожденной аномалии для планирования возможного хирургического вмешательства.
Основными показаниями к выполнению МРТ следует считать:
1) недостаточность данных, получаемых с помощью УЗИ;
2) несоответствие клинической картины результатам УЗИ;
3) необходимость оценки распространенности патологического процесса;
4) планирование хирургического вмешательства.
МРТ является методом выбора в диагностике данного вида патологии ввиду высокого естественного контраста мягких тканей, точной визуализации всех анатомических особенностей матки, шейки матки и влагалища, неинвазивности и отсутствия ионизирующего излучения [6]. Последние два пункта особенно важны для детей. В отличие от УЗИ, при МРТ отсутствуют «невидимые» зоны (зоны затрудненной визуализации). МРТ позволяет получать изображения в любой плоскости с большим полем обзора. На Т2 взвешенных изображениях (ВИ) четко отображается положение матки, наиболее выражены различия в интенсивности магнитно-резонансного (МР) сигнала от эндометрия, переходно-соединительной зоны, собственно миометрия, слизистой оболочки цервикального канала. На Т1ВИ при наличии обструкции матки или влагалища хорошо визуализируется их геморрагическое содержимое. Для дифференциальной диагностики жирового и геморрагического компонента выполняются Т1ВИ с подавлением сигнала от жировой ткани. Кроме того, на МРТ есть возможность наиболее точно диагностировать сочетанную патологию, такую как аденомиоз или миома матки, сочетанные пороки развития. В то же время МРТ имеет ряд недостатков и противопоказаний. К недостаткам относятся невозможность выполнения исследования у кровати больного, большая продолжительность исследования. Противопоказания к проведению МРТ стандартны.
Классификация пороков развития женской репродуктивной системы
В настоящее время существует множество различных классификаций аномалий развития женской репродуктивной системы, основывающихся на выделении отдельных клинико-анатомических форм, на различиях эмбриогенеза внутренних половых органов, на результатах различных методов визуальной диагностики. На наш взгляд, наиболее часто используемыми и практически значимыми являются: классификация, разработанная Л.В. Адамян, А.З. Хашукоевой (1998); переработанная классификация Л.В. Адамян и соавт. (2014) и классификация, представленная Европейским обществом репродукции человека и эмбриологии совместно с Европейским обществом гинекологов-эндоскопистов (ESHRE/ESGE) (таблица). В своей практической деятельности гинекологи наиболее часто используют клинико-анатомическую классификацию аномалий матки и влагалища, разработанную Л.В. Адамян и А.З. Хашукоевой в 1998 г. на основании оперативного лечения 855 больных с различными пороками развития матки и влагалища.

I класс. Аплазия влагалища
1. Полная аплазия влагалища и матки:
а) рудимент матки в виде двух мышечных валиков;
б) рудимент матки в виде одного мышечного валика (справа, слева, в центре);
в) мышечные валики отсутствуют.
2. Полная аплазия влагалища и функционирующая рудиментарная матка:
а) функционирующая рудиментарная матка в виде одного или двух мышечных валиков;
б) функционирующая рудиментарная матка с аплазией шейки матки;
в) функционирующая рудиментарная матка с аплазией цервикального канала.
При всех вариантах возможны гемато- и пиометра, хронический эндометрит и периметрит, гемато- и пиосальпинкс.
3. Аплазия части влагалища при функционирующей матке:
а) аплазия верхней трети;
б) аплазия средней трети;
в) аплазия нижней трети.
II класс. Однорогая матка
1. Однорогая матка с рудиментарным рогом, сообщающимся с полостью основного рога.
2. Рудиментарный рог замкнутый.
В обоих вариантах эндометрий может быть функционирующим или нефункционирующим.
3. Рудиментарный рог без полости.
4. Отсутствие рудиментарного рога.
III класс. Удвоение матки и влагалища
1. Удвоение матки и влагалища без нарушения оттока менструальной крови.
2. Удвоение матки и влагалища с частично аплазированным влагалищем.
3. Удвоение матки и влагалища при нефункционирующей одной матке.
IV класс. Двурогая матка
1. Седловидная форма.
2. Неполная форма.
3. Полная форма.
V класс. Внутриматочная перегородка
1. Полная внутриматочная перегородка — до внутреннего зева.
2. Неполная внутриматочная перегородка.
VI класс. Пороки развития маточных труб и яичников
1. Аплазия придатков матки односторонняя.
2. Аплазия труб (одной или обеих).
3. Наличие добавочных труб.
4. Аплазия яичника.
5. Гипоплазия яичников.
6. Наличие добавочных яичников.
VII класс. Редкие формы пороков половых органов
1. Мочеполовые пороки развития: экстрофия мочевого пузыря.
2. Кишечно-половые пороки развития: врожденный ректовестибулярный свищ, сочетающийся с аплазией влагалища и матки; врожденный ректовестибулярный свищ, сочетающийся с однорогой маткой и функционирующим рудиментарным рогом. Встречаются изолированно или в сочетании с пороками развития матки и влагалища.
I класс. Аплазия влагалища
Аномалии I класса являются наиболее тяжелыми формами врожденных пороков развития внутренних половых органов и варьируются от полной аплазии до различной степени гипоплазии матки и влагалища. Частота возникновения данных пороков составляет приблизительно 1 на 5 000 случаев, при этом сочетанные пороки развития встречаются у 30% пациентов с данной патологией [7, 8].
Аплазия матки и влагалища является результатом полного нарушения развития мюллеровых протоков. Частичная агенезия встречается чаще, в таких случаях наблюдается, например, рудиментарная матка. В зависимости от наличия функционирующего эндометрия может прослеживаться зональная анатомия стенок рудиментарной матки [8].
При синдроме Майера–Рокитанского–Кюстнера–Хаузера (МРКХ-синдроме) наблюдается аплазия матки и верхних отделов влагалища (рис. 1). МРКХ-синдром чаще диагностируется в подростковом возрасте в виде первичной аменореи либо невозможности полового акта ввиду врожденной аплазии матки и влагалища. У пациенток астенического типа телосложения удается пропальпировать один или два мышечных валика. При этом женщины имеют нормальный женский фенотип и кариотип (46, ХХ). МРКХ-синдром является второй после дисгенезии гонад причиной первичной аменореи [9].

Существует 2 типа МРКХ-синдрома:
1-й – комбинация аплазии матки и отсутствия 2/3 верхних отделов влагалища; 2-й – сочетание с другими врожденными пороками развития (скелета, органов мочевыделения, сердца или слуха). Наиболее часто определяются пороки мочевыводящих путей – у 30–40% пациентов.
У большинства женщин с МРКХ-синдромом 1-го типа наблюдается атрезия влагалища и шейки матки с наличием либо отсутствием маточных рудиментов – мышечных валиков, расположенных у латеральных стенок таза, зональная дифференциация которых может быть выражена в различной степени. В некоторых случаях зональная анатомия стенок маточных рудиментов прослеживается с наличием функционирующего эндометрия, который является причиной циклических болей [5]. Яичники, как правило, располагаются ортотопически, но может наблюдаться эктопия яичников. Маточные рудименты всегда расположены каудально от яичников.
При МРКХ-синдроме 2-го типа может наблюдаться унилатеральная агенезия почки, как правило, ассоциированная с эктопией дистальных отделов уретры во влагалище.
При пороках развития матки и влагалища I класса беременность невозможна. В этой ситуации используют различные методы вспомогательной репродукции и суррогатного материнства.
Последние публикации свидетельствуют о превосходстве МРТ в диагностике 2-го типа МРКХ-синдрома, по сравнению с лапароскопией и УЗИ. Мальформации мочевыделительного тракта, такие как удвоение мочеточника или его эктопическое отверстие, хорошо визуализируются при использовании МР урографии.
Ключевые признаки: визуализируются двусторонние тяжистые мышечные валики, сходящиеся срединно над куполом мочевого пузыря с формированием вытянутой треугольной формы мягкотканной структуры. Всегда прослеживается связь между описанными структурами и аплазированным влагалищем. Кроме того, при МРКХ-синдроме рядом с мышечными валиками визуализируются нормальные яичники (но может встречаться их эктопия) [10].
II класс. Однорогая матка
Среди пороков развития матки и влагалища однорогая матка встречается приблизительно в 10% случаев [5, 11]. Данный вид аномалии является результатом асимметричного нарушения развития одного из парамезонефральных протоков с формированием типичной удлиненной «бананообразной» формы матки, расположенной латерально от срединной линии с наличием, либо отсутствием рудиментарного рога [5, 12]. Примерно в 65% случаев рудиментарный рог присутствует, при этом сообщение с полостью основного рога визуализируется только в 10% случаев [11].
Диагноз у таких пациенток обычно устанавливается в процессе обследования по поводу бесплодия. При наличии функционирующего рудиментарного рога, сообщающегося с полостью основного рога, происходит ретроградный заброс менструальной крови. Диагноз устанавливается в период менархе с клинической картиной дисменореи и гематометры [5, 13]. Если функционирующий рудиментарный рог не сообщается с полостью основного рога, возникает дилатация стенок рога за счет геморрагического содержимого, возможен заброс менструальной крови в маточную трубу с формированием гематосальпинкса и в полость таза (рис. 2).

У пациенток с однорогой маткой повышен риск развития эндометриоза, эктопической беременности, акушерских осложнений [5, 13]. Примерно в 40% случаев наблюдаются сочетанные пороки развития мочевыделительной системы, чаще ипсилатеральная к рудиментарному рогу почечная агенези [8, 13]. В визуализации данного типа мальформаций МРТ превосходит УЗИ [5].
Ключевые признаки: типичный сформированный рудиментарный рог визуализируется, как изогнутая мягкотканная структура малых размеров, локализованная латерально от срединной линии с нормальной зональной анатомией стенок (функциональный эндометрий, переходно-соединительная зона, миометрий). Рудиментарный рог без полости выглядит, как однородное низкой или средней интенсивности МР-сигнала мягкотканное образование (рис. 3). При наличии замкнутого (не сообщающегося) рудиментарного рога с функционирующим эндометрием у взрослых женщин визуализируется гематометра. Кроме того, могут быть выявлены признаки эндометриоза [10].
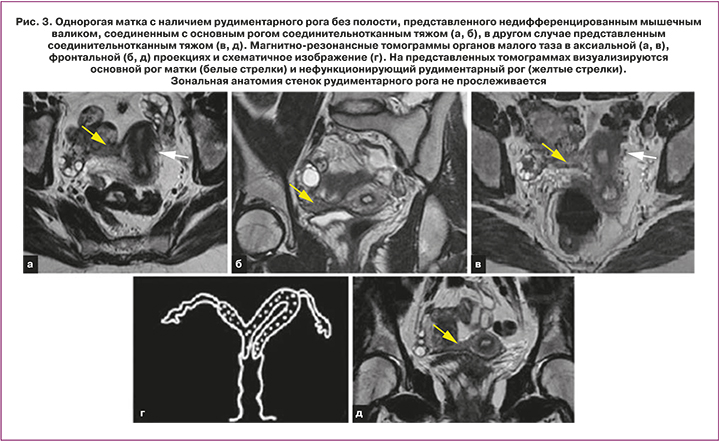
Основной рог принимает изогнутую и удлиненную, «бананообразную» форму. При этом объем матки уменьшается, ее конфигурация становится асимметричной. Нормальная зональная анатомия присутствует, но эндометрий может быть атипично тонким, сужающимся к вершине рога (форма «пули») [5].
III класс. Удвоение матки и влагалища
III класс врожденных пороков возникает на фоне полного неслияния парамезонефральных протоков с формированием двух отдельных маток c отдельными полостями и шейками и с нормальной зональной анатомией стенок. В 75% случаев наблюдается полная или частичная продольная перегородка влагалища. Этиология продольной перегородки влагалища на данный момент остается предметом дискуссии. Большинство авторов сходится во мнении, что данная аномалия является результатом комбинированных дефектов более чем на одной стадии эмбриогенеза [14—16]. Продольная перегородка влагалища может быть полной (от шейки матки до входа во влагалище), высокой (от шейки матки до любого уровня выше входа во влагалище) или низкой (от гимена до любого уровня влагалища, но не доходит до шейки матки) [15, 16]. Изолированная продольная перегородка без обструкции не связана с бесплодием или акушерскими осложнениями и, как правило, бессимптомна [5, 15, 16]. Наличие продольной влагалищной перегородки лучше визуализируется при введении стерильного эндовагинального ультразвукового геля либо при наличии обструкции гемивлагалища или полной обструкции влагалища с формированием гематокольпоса (рис. 4).

При полной обструкции влагалища диагноз устанавливается, как правило, во время менархе с клинической картиной первичной аменореи, абдоминальными болями, пальпируемым образованием брюшной полости (гематометра). При частичной обструкции влагалища женщины предъявляют жалобы на циклические боли внизу живота, болезненный половой акт.
Удвоение матки с обструкцией одного из гемивлагалищ и ипсилатеральной агенезией соответствующей почки выделяют в синдром Вундерлиха–Херлина–Вернера (ВХВ-синдром) [10].
Ключевые признаки: на МРТ визуализируются два широко разведенных рога матки с глубокой щелью между ними и две разделенные шейки матки. Наличие глубокой щели на уровне дна матки (где ее контур в норме слегка выпуклый) является типичным признаком аномалий слияния Мюллеровых протоков (удвоения матки и двурогой матки). По этому признаку аномалии слияния легко дифференцируются от аномалий резорбции срединной сагиттальной перегородки (внутриматочная перегородка). Соотношение и зональная анатомия стенок при удвоении матки сохранена. При наличии поперечной перегородки одного из гемивлагалищ либо обструкции на фоне гипоплазии или поперечной перегородки формируются гематокольпос и гематометра, возникает дилатация стенок за счет геморрагического содержимого, гиперинтенсивного по Т1 ВИ. Зачастую встречаются свищевые ходы в паравагинальной клетчатке со стороны нарушенного оттока менструальной крови. При проксимальном удвоении без поперечной перегородки дилатацию влагалища (с целью лучшей визуализации) можно получить путем введения стерильного ультразвукового геля [10].
IV класс. Двурогая матка
Среди пороков развития матки и влагалища двурогая матка встречается приблизительно в 10% случаев [5, 17]. При этой аномалии не происходит полного слияния мюллеровых (парамезонефральных) протоков, формируются 2 симметричных рога, которые обычно соединяются на уровне перешейка, формируя двурогую матку с нормальной шейкой матки. В зависимости от степени разделения тела матки выделяют седловидную, неполную и полную формы. При выраженных формах рога матки разведены более чем на 4 см, между ними визуализируется глубокая щель, превышающая более чем на 50% толщину стенки матки [7]. Двурогая матка обычно бессимптомна, однако имеется высокий риск акушерских осложнений [11, 17]. МРТ позволяет неинвазивно оценить наружный контур на уровне дна матки, широко разведенные рога матки и наличие между ними вдавления/углубления (более чем на 50% толщины стенки матки). Кроме того, хорошо прослеживается зональная анатомия обоих рогов матки. В отличие от удвоения матки при двурогой матке с двумя шейками всегда присутствует связь между рогами (рис. 5).

Седловидная матка является частным проявлением двурогой матки (рис. 6). При этой мальформации на наружной поверхности дна органа визуализируется небольшое вогнутое углубление в виде седла, никогда не превышающее 50% толщины стенки матки, либо 1/5 длины тела матки. Многие авторы считают седловидную матку нормальным вариантом развития [5]. Большинство женщин не предъявляют жалоб и имеют нормальные акушерские исходы. По новой классификации ESHRE/ESGE, седловидная матка относится к группе U0, то есть к нормальным вариантам развития [7].
По классификации ESHRE/ESGE в класс U1 входит так называемая Т-образная матка. В эту группу включены все случаи с заметно узкой полостью матки. Развитие Т-образной матки связано с применением диэтилстильбэстрола, синтетического эстрогена, который широко использовался ранее для лечения преждевременных родов. Поскольку использование этого препарата в 1971 г. приостановлено, на данный момент Т-образная матка в клинической практике практически не встречается [13], поэтому в основную классификацию, рассматриваемую в данной главе, эта категория не включена.
Ключевые признаки: как и при удвоении матки, при двурогой матке отсутствует нормальная слегка выпуклая форма наружного контура дна матки. Вместо нее визуализируется глубокая щель между рогами. Зональная анатомия стенок каждой из симметричных маток сохранена. В отличие от удвоения матки, при полной форме двурогой матки между рогами вместо жировой клетчатки (может отсутствовать) визуализируется ткань миометрия или соединительная ткань [10].
V класс. Внутриматочная перегородка
Среди мальформаций женских половых путей внутриматочная перегородка встречается наиболее часто и является наиболее частой причиной акушерских осложнений [5, 11, 13, 18]. Эта аномалия является результатом отсутствия резорбции (полного или частичного) срединной сагиттальной перегородки. Перегородка берет свое начало на уровне центральных отделов дна матки широким или узким основанием и состоит преимущественно из мышечной и фиброзной тканей. При полной форме внутриматочная перегородка распространяется до внутреннего зева или даже на влагалище [7]. Наружный контур дна матки может быть обычным, плоским или незначительно вогнутым, без выраженного углубления и существенного расхождения рогов матки. МРТ позволяет четко визуализировать внутриматочную перегородку, обеспечивает точную информацию о степени мальформации, толщине перегородки, соотношении мышечной и фиброзной тканей, что очень важно при планировании хирургического вмешательства [12, 13]. Кроме того, МРТ позволяет четко дифференцировать данную аномалию от двурогой матки (рис. 7).
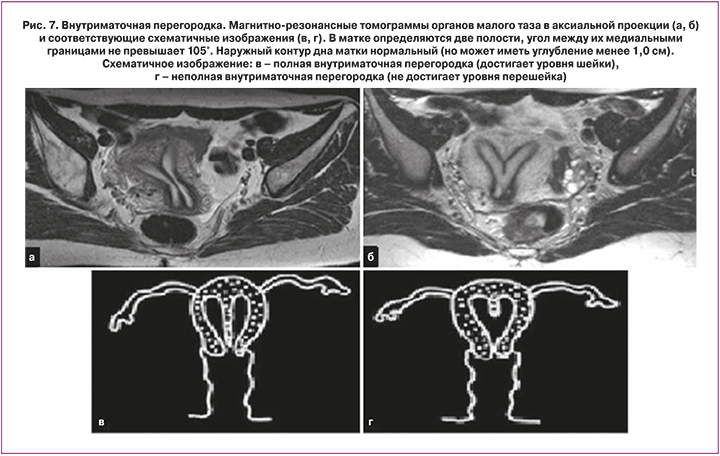
Ключевые признаки: при наличии внутриматочной перегородки матка имеет обычные размеры. Наружный контур дна матки, в отличие от аномалий слияния мюллеровых протоков, имеет, как правило, нормальный слегка выпуклый контур. Оценка наружного контура дна матки является ключевым моментом в дифференциальной диагностике аномалий слияния парамезонефральных протоков от аномалий резорбции срединной сагиттальной перегородки. Дифференциальная диагностика внутриматочной перегородки от двурогой матки крайне важна во избежание излишних хирургических вмешательств, например, гистероскопической септопластики у женщин с двурогой маткой.
Интенсивность МР-сигнала от внутриматочной перегородки на Т2 ВИ зависит от соотношения в ней фиброзной и мышечной ткани. При преобладании фиброзной ткани, перегородка выглядит более гипоинтенсивной к миометрию, при преобладании мышечной ткани – изоинтенсивной. Преобладание мышечной или фиброзной ткани имеет очень большое значение в планировании хирургического вмешательства. При внутриматочной перегородке с преобладанием фиброзной ткани проводится гистероскопическая септопластика, в то время как внутриматочная перегородка с преобладанием мышечной ткани при отсутствии репродуктивных потерь зачастую не требует хирургической коррекции [19].
Состояния, имитирующие врожденные пороки развития женских половых путей
Синдром нечувствительности к андрогенам
Синдром нечувствительности к андрогенам (синдром тестикулярной феминизации) – заболевание, обусловленное отсутствием чувствительности тканей к андрогенам. Завершенный синдром нечувствительности к андрогенам (синдром Морриса) может симулировать МР-картину врожденных пороков женских половых путей.
Завершенный синдром нечувствительности к андрогенам – расстройство полового развития, вызванное мутацией гена, отвечающего за рецепторы к андрогенам у лиц с мужским генотипом (46 XY) [20]. По разным данным, синдром Морриса возникает крайне редко – от 1 на 20 400 до 1 на 99 000 случаев [21]. Пациент с завершенным синдромом обладает женским фенотипом с нормальными женскими наружными половыми органами вследствие отсутствия эффектов андрогенов на ткани [22]. Ввиду повышенного риска малигнизации гонад (0,8–16%) у таких пациентов проводится гонадэктомия с последующей заместительной гормональной терапией [21, 23].
Тем не менее, на данный момент существует тенденция к отсроченной гонадэктомии и, как следствие, повышенной потребности в динамическом МР-наблюдении (любых изменений сохранившихся гонад) [20, 24]. Чаще всего диагноз устанавливается в детском возрасте путем пальпирования опухолеподобного образования в паховой области, что соответствует неопустившимся яичкам [22]. Однако часто встречаются ошибки в диагностике, которые связаны с определением «паховых грыж». У других пациентов диагноз устанавливается во взрослом возрасте при обследовании по поводу первичной аменореи (рис. 8).

Ключевые признаки: на МРТ неопустившиеся семенники визуализируются как гетерогенной интенсивности мягкотканные образования, чаще локализованные в малом тазу, реже — на уровне паховых каналов [20]. При обнаружении в малом тазу семенники похожи на мышечные валики, которые визуализируются при МРКХ-синдроме. Кроме того, между семенниками формируется тяжистая структура, аналогичная той, что наблюдается при МРКХ-синдроме, которая сходится срединно над куполом мочевого пузыря. Несмотря на схожую МР-картину, отсутствие нормальных яичников у лиц с синдромом Морриса помогает дифференцировать это состояние от МРКХ-синдрома. Неопустившиеся семенники часто окружены гипоинтенсивным ободком, что, по-видимому, соответствует tunica albuginea (белочная оболочка яичника, являющаяся соединительнотканной капсулой). В 74% случаев выявляются простые паратестикулярные кисты. Зачастую рядом с одним из полюсов семенников встречаются треугольной формы гипоинтенсивные включения, представляющее собой фибромускулярную ткань лозовидного сплетения [20].
Поперечная перегородка влагалища
 Наличие поперечной перегородки, как правило, приводит к развитию гематометры и гематокольпоса, существенно увеличивая риск развития эндометриоза [5, 13]. Частота возникновения поперечной перегородки влагалища варьирует от 1 на 2 100 до 1 на 72 000 случаев [25]. Чаще поперечная перегородка встречается при удвоении матки и влагалища. У пациенток с поперечной перегородкой и обструкцией одного из гемивлагалищ часто встречается сочетанная агенезия ипсилатеральной почки [5, 26]. Поперечная перегородка может визуализироваться в любых отделах влагалища, но чаще встречается на уровне верхней трети (46%) [14]. Поперечная перегородка может быть разной толщины, но в основном менее 1 см. Некоторые авторы считают, что дистальная атрезия влагалища представляет собой утолщенную поперечную перегородку влагалища, другие рассматривают их как различные заболевания с различным патогенезом [27].
Наличие поперечной перегородки, как правило, приводит к развитию гематометры и гематокольпоса, существенно увеличивая риск развития эндометриоза [5, 13]. Частота возникновения поперечной перегородки влагалища варьирует от 1 на 2 100 до 1 на 72 000 случаев [25]. Чаще поперечная перегородка встречается при удвоении матки и влагалища. У пациенток с поперечной перегородкой и обструкцией одного из гемивлагалищ часто встречается сочетанная агенезия ипсилатеральной почки [5, 26]. Поперечная перегородка может визуализироваться в любых отделах влагалища, но чаще встречается на уровне верхней трети (46%) [14]. Поперечная перегородка может быть разной толщины, но в основном менее 1 см. Некоторые авторы считают, что дистальная атрезия влагалища представляет собой утолщенную поперечную перегородку влагалища, другие рассматривают их как различные заболевания с различным патогенезом [27].
Ключевые признаки: при полной обструкции влагалища диагноз устанавливается, как правило, во время менархе с клинической картиной первичной аменореи, абдоминальными болями, пальпируемым образованием брюшной полости (гематометра) (рис. 9). При частичной обструкции женщины предъявляют жалобы на циклические боли внизу живота, болезненный половой акт. Дистальная атрезия влагалища и низко расположенная поперечная перегородка влагалища имеют схожие клинические проявления и, как правило, не связаны с иными мочеполовыми пороками развития [27].
Атрезия девственной плевы
Атрезия гимена является результатом сбоя реканализации влагалища на 5-м месяце эмбрионального развития. Обычно является изолированной находкой и встречается приблизительно в 0,1% случаев [28]. В большинстве случаев наблюдается полная обструкция влагалища с клинической картиной аменореи и циклических тазовых болей. Кроме того, при формировании гематокольпоса со значительной дилатацией стенок могут возникать болезненные мочеиспускание и дефекация. Диагноз чаще устанавливают при обычном гинекологическом осмотре или ректальном обследовании. В ряде случаев данную патологию выявляют у девочек грудного возраста при наличии выбухания тканей промежности в области расположения девственной плевы в результате образования мукокольпоса.
МРТ позволяет детально оценить уровень обструкции и, как следствие, пролабирования, помогая дифференцировать незаращение гимена, дистальную атрезию влагалища и низко расположенную поперечную перегородку влагалища [27].
Систематизированный подход к дифференциальной диагностике на основе МРТ
В ходе обследования по поводу врожденных пороков развития женской половой системы, как правило, УЗИ предшествует МРТ. Несмотря на то, что проведение УЗИ зачастую достаточно для выявления аномалий развития матки или влагалища, для дальнейшего уточнения типа порока требуется проведение МРТ. Аномалии слияния мюллеровых протоков, такие как удвоение матки и двурогая матка, легко дифференцируются друг от друга при проведении МРТ. Кроме того, МРТ позволяет четко определить все анатомические особенности рудиментарного рога при однорогой матке.
Первым шагом в диагностике врожденных аномалий женских половых путей является оценка аплазии либо гипоплазии производных мюллеровых протоков (т.е. матки, шейки матки, верхних отделов влагалища). Если гипоплазия частичная или ограничена одним из мюллеровых протоков, случай может быть диагностирован как однорогая матка. Если гипоплазия полная, следующим шагом является оценка яичников. При наличии нормальных яичников следует заподозрить МРКХ-синдром. При наличии мягкотканных образований в полости малого таза или в проекции паховых каналов в сочетании с аплазией яичников необходимо предположить наличие синдрома нечувствительности к андрогенам (с дальнейшим клинико-лабораторным обследованием, включая кариотипирование).
Если производные гипоплазии мюллеровых протоков не наблюдаются, следует внимательно оценить наружный контур на уровне дна матки. Если наружный контур дна матки имеет нормальную слегка выпуклую форму, а в полости матки визуализируется продольная перегородка, случай может быть отнесен к мальформациям резорбции срединной сагиттальной перегородки (различные формы внутриматочной перегородки). Если вместо нормального выпуклого контура наблюдается глубокая щель (более 1 см или более 50% толщины стенки), случай относится к аномалиям слияния мюллеровых протоков (удвоение матки или двурогая матка). Следующим этапом является оценка пространства между симметричными рогами матки — если между ними жировая ткань (может отсутствовать), следует думать об удвоении матки, если между ними ткань, идентичная по МР-характеристикам ткани миометрия или соединительной ткани, имеет место двурогая матка (рис. 10).

Заключение
Врожденные мальформации женских половых путей являются результатом дефектов трансформации парамезонефральных (мюллеровых) протоков на разных стадиях развития и представляют собой любые отклонения от нормальной анатомии. Обструктивные пороки манифестируют, как правило, во время менархе с клинической картиной первичной аменореи и абдоминальными болями. Основными осложнениями обструктивных пороков являются гематокольпос, гематометра, гематосальпинкс, эндометриоз, спаечная болезнь и формирование свищевых ходов. В отличие от обструктивных пороков, симметричные аномалии (удвоение матки, двурогая матка, внутриматочная перегородка) встречаются чаще и зачастую не являются показанием к хирургической коррекции. Первичным методом диагностики пороков развития женской репродуктивной системы является УЗИ. После установления предварительного диагноза с целью точного определения типа врожденной аномалии и наличия сопутствующей патологии требуется проведение МРТ для определения тактики ведения пациента и возможного хирургического вмешательства. Данные, полученные при выполнении МРТ, целесообразно анализировать в комплексе с клиническими данными, а также с данными иных методов диагностики, используя классификацию, отражающую в полной мере клинико-морфологические особенности мальформаций матки и влагалища.



