По определению ВОЗ, ожирением считается «ненормальное или чрезмерное скопление жира, которое может негативно повлиять на здоровье» [1].
Ожирение является одним из самых распространенных в мире хронических заболеваний не только взрослых, но и детей и подростков. Всемирная организация здравоохранения (ВОЗ) еще в 1997 г. объявила эту патологию глобальной эпидемией, которая и на сегодняшний день остается одной из наиболее значимых проблем медицины.
Так, по оценкам экспертов этой международной организации, в 2016 году более 1,9 миллиарда взрослых людей старше 18 лет имели избыточный вес. Из них более 650 миллионов страдали ожирением.
По данным 2016 года 39 % взрослых старше 18 лет (39% мужчин и 40% женщин) имели избыточный вес и около 13% взрослого населения планеты (11% мужчин и 15% женщин) страдали ожирением.
С 1975 г по 2016 г число людей, страдающих ожирением, во всем мире выросло более чем втрое [1, 2], при этом лидирующее положение среди стран с высокой заболеваемостью сохраняли США, где 34% населения имели избыточную массу тела, а 27% – ожирение [3].
В Европе распространенность ожирения достигает 10–25% среди мужчин и 10–30% – среди женщин. За прошедшие 10 лет в большинстве европейских стран распространенность ожирения возросла на 10–40%. В большинстве стран Европы более 50% населения имеют лишний вес или страдают ожирением [1, 4].
В Российской Федерации на 2016 г доля лиц с избыточной массой тела составила 62%, с ожирением – 26,2% [2]. По прогнозам, в 2020 г. 31% мужчин и 26% женщин будут страдать ожирением. К 2030 г. модель предсказывает, что 33% мужчин и 26% женщин будут страдать ожирением [5].
Ожирение негативно влияет на качество жизни и все сферы деятельности человека, зачастую приводя к развитию тяжелых сопутствующих заболеваний, потере трудоспособности и инвалидности. Большинство людей с избыточной массой тела и ожирением испытывают объективные трудности вследствие наличия серьезных отклонений в состоянии здоровья, физических ограничений и психологических проблем.
Избыточный вес и ожирение являются риском развития серьезных заболеваний сердечно-сосудистой системы (в первую очередь, гипертонии и ишемической болезни сердца), эндокринных расстройств (сахарный диабет второго типа, нарушения репродуктивной функции), поражений опорно-двигательного аппарата (протрузии и грыжи межпозвонковых дисков, повреждение суставов нижних конечностей), а также онкологических заболеваний и психологических расстройств [6–9].
Хронические заболевания сердечно-сосудистой системы, онкологические заболевания, ожирение и сахарный диабет относятся к неинфекционным заболеваниям с высокой смертностью [10, 11].
Избыточный вес и ожирение связаны с более высокой смертностью во всем мире, чем недостаток веса. 65% населения мира проживает в странах, где избыточный вес и ожирение убивают больше людей, чем недостаточный вес. Эта статистика включает в себя все страны с высокими и средними уровнями доходов. По крайней мере, 2,8 миллиона взрослых людей умирают каждый год в результате состояний и заболеваний, связанных с избыточным весом или ожирением [6].
По данным ряда авторов известно, что отмечается тенденция к дальнейшему увеличению в общей смертности доли сопутствующих ожирению заболеваний – от 59–60% в настоящее время до 69% к 2030 г. Ведущей причиной этого негативного явления, помимо курения и злоупотребления алкоголем, являются малоподвижный образ жизни и несбалансированное питание, особенно среди детей и подростков, что предсказуемо приведет к дальнейшему увеличению доли взрослого населения с избыточной массой тела и ожирением [12].
Еще одной распространенной медицинской проблемой, имеющей доказанную ассоциацию с метаболическими расстройствами, сахарным диабетом 2-го типа, сердечно-сосудистыми заболеваниями и нарушением репродуктивной функции является синдром гиперандрогении [13].
Синдром гиперандрогении — патологическое состояние, обусловленное избыточной продукцией андрогенов яичниками и/или надпочечниками или повышением локальной тканевой чувствительности к циркулирующим андрогенам.
Это наиболее частая эндокринопатия у женщин. Распространенность гиперандрогении среди женщин составляет 10–20 %.
Важность своевременной диагностики гиперандрогенных состояний обусловлена их последствиями: нарушениями менструального цикла, эндокринным бесплодием, повышением риска невынашивания беременности, преждевременных родов, гестационного диабета [14].
Согласно классификации выделяют следующие формы гиперандрогенных состояний [15]:
- Неопухолевые (функциональные) формы истинной гиперандрогении;
- Опухолевые формы истинной гиперандрогении;
- Транспортные формы гиперандрогении (в результате снижения продукции в печени глобулина, связывающего половые стероиды);
- Рецепторная форма гиперандрогении (обусловлена повышением активности 5a-редуктазы в клетках-мишенях).
В связи с широким распространением ожирения и гиперандрогении, а также в связи с их высокой социальной значимостью, актуальным является более углубленное изучение патогенетических механизмов развития представленных нозологий с целью их дальнейшей коррекции.
Любой адаптационный или патологический процесс протекает на фоне интенсификации свободно-радикального окисления биосубстратов [16]. Данные процессы являются центральным звеном метаболических процессов клеток. Окислительный стресс (ОС), дисбаланс между окислительными и антиоксидантными системами клеток и тканей, являются результатом производства окислительных свободных радикалов и активных форм кислорода. Одним из следствий повышенного уровня активных форм кислорода является изменение структуры и, соответственно, функций клеточных белков [17]. Белки широко представлены в биоматериале и высоко чувствительны к действию свободных радикалов, вследствие чего признаны основными мишенями для последних [18]. Кроме того, они ответственны за большинство клеточных функций, поэтому изучение окислительной модификации белков (ОМБ) является одним из актуальных направлений в современной экспериментальной биохимии [19–23].
В настоящее время доказана роль свободно радикальных процессов в патогенезе многих различных заболеваний, известны работы и по оценке ОМБ у пациенток с гинекологическими заболеваниями: к примеру, с раком яичников [24, 25].
Цель исследования: изучить процессы ОМБ у пациенток с гиперандрогенией и ожирением.
Материал и методы исследования
Материалом для исследования служила плазма крови пациенток, обратившихся на гинекологический осмотр в ООО «Медлайн Рязань» с ожирением (10 человек) и пациенток с гиперандрогенией (10 человек). Контрольную группу составили 10 практически здоровых доноров, сопоставимых с испытуемыми по возрасту и полу, не имеющих сопутствующих патологий, для которых доказано повышение ОМБ.
Забор крови у пациенток производился однократно до начала лечения утром в одно и то же время из локтевой вены натощак в количестве 15 мл. В качестве антикоагулянта использовали раствор ЭДТА, приготовленный из расчета 1,5 мг антикоагулянта на 1 мл крови.
Оценка интенсивности окислительной модификации белков в тканях проводилась по методу R.L. Levine [26] в модификации Е.Е. Дубининой [27]: метод основан на реакции взаимодействия карбонильных групп и иминогрупп окисленных аминокислотных остатков с 2,4-динитрофенилгидразином (2,4-ДНФГ) с образованием 2,4-динитрофенилгидразонов, обладающих специфическим спектром поглощения в ультрафиолетовой и видимой областях спектра.
Комплексная оценка содержания ОМБ проводилась по авторскому патенту на изобретение № 2524667 (Фомина М.А., Абаленихина Ю.В., Фомина Н.В., Терентьев А.А.), разработанному на кафедре биологической химии с курсом КЛД ФДПО ГБОУ ВПО РязГМУ Минздрава России [28].
Статистическая обработка полученных данных проводилась методами непараметрической статистики с использованием пакетов прикладных программ Statistica 6.0. Для определения статистической значимости различий непрерывных величин, в зависимости от параметров распределения, использовался U-критерий Манна-Уитни. Непрерывные переменные представлены в виде M±s (среднее ± стандартное отклонение). Для всех проведенных анализов различия считались статистически значимыми при двустороннем уровне значимости р≤0,05.
Результаты исследования и обсуждение
Изучение свободно радикальных процессов при патологии, приводящей к развитию метаболических нарушений (ожирение, сахарный диабет, метаболический синдром), имеет важное значение, в связи с тем, что они рассматриваются как основные факторы развития сердечно-сосудистых заболеваний, а у женщин репродуктивного возраста могут явиться причиной бесплодия.
Последовательное электронное восстановление (O2) приводит к образованию реактивных форм кислорода (reactive oxygen species – ROS). Один электрон молекулярного кислорода (e-) приводит к образованию супероксид-аниона (O2-), два электрона вызывают образование перекиси водорода (H2O2) и три электрона приводят к образованию гидроксид-радикалов (HO˙).
Свободные радикалы вызывают карбонилирование белков – образование стабильных продуктов, которые образуются при участии аминокислотных остатков пролина, аргинина, лизина, треонина. Также карбониловые производные белков могут образовываться при участии аминокислотных остатков лизина, цистеина и гистидина с продуктами перекисного окисления липидов. Это приводит к нарушению выполняемых белками функций и развитию различного рода патологий, требующих коррекции.
Необходимо отметить, что определение ОМБ все чаще находит применение в клинической практике [29].
В настоящее время проводится изучение ОМБ при ожирении, так как окисление белка апо-А в составе липопротеидов высокой плотности может приводить к нарушению его функций, нарушению функций фермента лецитин-холестеринацилтрансферазы, участвующей в эстерификации холестерина и его обратном транспорте в печень, что приводит к нарушению последнего и накоплению холестерина в крови.
 Отдельно проводится определение первичных и вторичных маркеров окислительного стресса: альдегиддинитрофенилгидразонов (АДНФГ) и кетондинитрофенилгидразонов (КДНФГ) соответственно. Принято считать, что преобладание первичных маркеров повреждения белков может указывать на начальные стадии ОС и возможную обратимость процесса [30].
Отдельно проводится определение первичных и вторичных маркеров окислительного стресса: альдегиддинитрофенилгидразонов (АДНФГ) и кетондинитрофенилгидразонов (КДНФГ) соответственно. Принято считать, что преобладание первичных маркеров повреждения белков может указывать на начальные стадии ОС и возможную обратимость процесса [30].
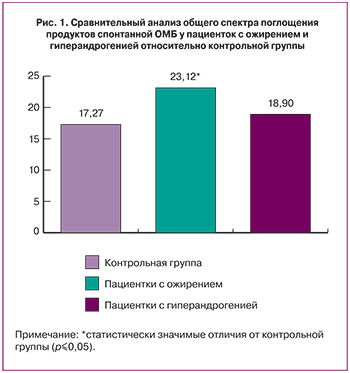
Результаты представленного исследования показали, что у пациенток с гиперандрогенией отмечалось лишь незначительное повышение уровня ОМБ, по сравнению со значениями контрольной группы, которое не явилось статистически значимым (рис.1).
У пациенток с ожирением отмечалось статистически значимое увеличение суммарного содержания продуктов спонтанной ОМБ по сравнению с контрольной группой.
При анализе первичных и вторичных маркеров карбонильного стресса мы отметили, что их доля у представительниц контрольной группы и пациенток с ожирением практически не отличалась, несмотря на более высокие суммарные значения общего количества карбонилированных производных белков у последних (рис.2).
Доля АДНФГ составила 83,8 и 83,5% соответственно. Эти значения могут свидетельствовать об обратимости процессов ОМБ, и предположительно о более высоких адаптационных возможностях организма при данной патологии.
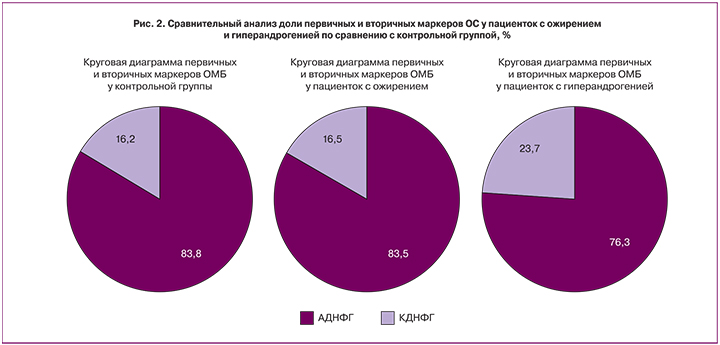
Доля АДНФГ у пациенток с гиперандрогенией была ниже, по сравнению с контрольной группой. Доля же КДНФГ нарастала и соответствовала значению 23,7, по сравнению с 16,2% у пациенток контрольной группы, что явилось статистически значимым. Эти данные могут свидетельствовать об усугублении ОС и переходе его в более позднюю стадию, а также о возможной необратимости процесса.
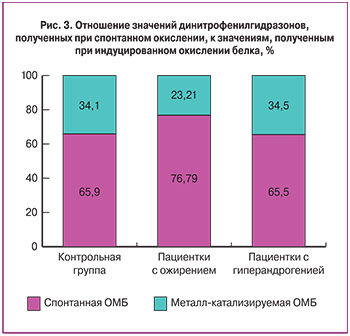 В настоящее время известны методики, позволяющие определять уровень спонтанного окисления белка, характеризующего общее физиологическое состояние организма, и металл-катализируемого, являющегося показателем резервно-адаптационных возможностей организма [31]. В настоящем исследовании металл-катализируемое окисление белка осуществлялось по реакции Фентона (индуцировалось в присутствии ионов железа и перекиси водорода) и проводился сравнительный анализ резервно-адаптационного потенциала (РАП) для испытуемых групп по сравнению с контролем (рис.3).
В настоящее время известны методики, позволяющие определять уровень спонтанного окисления белка, характеризующего общее физиологическое состояние организма, и металл-катализируемого, являющегося показателем резервно-адаптационных возможностей организма [31]. В настоящем исследовании металл-катализируемое окисление белка осуществлялось по реакции Фентона (индуцировалось в присутствии ионов железа и перекиси водорода) и проводился сравнительный анализ резервно-адаптационного потенциала (РАП) для испытуемых групп по сравнению с контролем (рис.3).
Отмечалось снижение уровня общего РАП у пациенток с ожирением по сравнению с контрольной группой, но данное снижение не явилось статистически значимым. Полученные результаты могут свидетельствовать о более высокой чувствительности к окислению белков у пациенток с данной патологией.
Уровень общего РАП у пациенток с гиперандрогенией не отличался от такового для группы контроля.
Выводы
- Ожирение у женщин с гинекологической патологией протекает на фоне статистически значимого повышения общего спектра поглощения продуктов спонтанной ОМБ. При этом соотношение первичных и вторичных маркеров не меняется по сравнению с контролем, но значения РАП снижаются.
- Гиперандрогения у женщин с гинекологической патологией протекает без изменения общего уровня карбонилированных белков и РАП. Однако, отмечается нарастание вторичных маркеров ОМБ, что может свидетельствовать об усугублении ОС.



