Проблема невынашивания беременности (НБ) вышла за рамки акушерства и гинекологии, требуя глубоких знаний в других областях медицины, эндокринологии в частности. Недостаточными знаниями этиопатогенеза НБ объясняют трудности его прогнозирования, профилактики, несвоевременность диагностики, неудачи лечения. Потенциальным предшественником преждевременных родов признана истмико-цервикальная недостаточность (ИЦН) [1–5], выявляемая в 0,5% общей акушерской популяции [6], составляющая 1% числа всех беременностей [7], 8% [2] или 20% спонтанных потерь беременности во II триместре [6, 7]. Одним из риск-факторов НБ признана гиперандрогения (ГА) [8].
Вопреки тому, что ИЦН и ГА – два состояния, прямая связь между которыми в России ранее не была глубоко исследована, существует несколько механизмов их взаимодействия. Во-первых, андрогены могут воздействовать на метаболизм коллагена в соединительной ткани, что может влиять на устойчивость шейки матки к растяжению [2]. Во-вторых, известно, что ГА может индуцировать воспалительную реакцию, которая может оказывать воздействие на функцию и структуру шейки матки [4]. Кроме того, ГА часто связана с синдромом поликистозных яичников, что может косвенно влиять на риск развития ИЦН [5]. Наконец, гормональные нарушения, вызванные ГА, могут также влиять на функцию шейки матки.
При этом с целью диагностики ГА более десятка лет исследуется стероидный профиль мочи женщин [9]. Еще в 2008 г. [10] было показано, что клинические проявления ГА сочетаются с преобладанием в стероидном профиле мочи метаболитов андрогенов яичникового происхождения над метаболитами андрогенов надпочечникового происхождения, отсутствием изолированной надпочечниковой ГА. Оценка стероидного профиля мочи по информативности конкурирует с малой дексаметазоновой пробой.
В 2009 г. [11] была убедительно доказана значимость эндокринно-гормональных нарушений в патогенезе рефрактерных форм угревой болезни у женщин, основанных на анализе стероидного профиля мочи (андростерона (An), этиохоланолона (Et), дегидроэпиандростерона (DHEA), 11-кетоандростерона (11-Keto-An), 11-кетоэтиохоланолона (11-Keto-Et), 11-β-кетогидроксиандростерона (11-OH-Keto-An), 11-13-Гидроксиэтиохоланолона (11-OH-Keto-Et), холестерина (Ch), их соотношения), более информативного, чем оценка гормонов крови.
Принимая во внимание то, что особенности метаболизма стероидных гормонов в репродуктивном возрасте у женщин с ГА (неклассической формой врожденной дисфункции коры надпочечников с дефектом 21‑гидроксилазы, синдромом поликистозных яичников, синдромом ГА при наличии ожирения, идиопатической ГА) достаточно изучены [12], эта тема остается востребованной [13, 14]. Бессимптомность ИЦН, несвоевременная диагностика объясняют отсрочку профилактических и лечебных мероприятий. Оценка стероидного профиля мочи представляется информативным методом ранней дифференциальной диагностики генеза ГА при беременности, необходимой для выбора эффективных мер профилактики ИЦН и своевременной коррекции.
Цель настоящего исследования: оценить особенности стероидного профиля и количественного определения стероидов мочи у беременных с ИЦН и ГА.
Материалы и методы
Выполнено проспективное когортное контролируемое исследование. Период исследования: 2014–2019 гг. Клиническая база: родильный дом № 1, филиал ГКБ №67 им. Л.А. Ворохобова (Москва). Включены 98 женщин с одноплодной беременностью: 63 с ИЦН (основная группа), 35 – без ИЦН (группа контроля). ГА оценена методом высокоэффективной жидкостной хроматографии на основании стероидного профиля и количественного определения стероидов мочи (газовый хроматограф Agilent 6850, Agilent Technologies, США).
Статистический анализ
Статистическую обработку и анализ данных выполняли с применением программ Microsoft Excel 2007, Statistica (версия 12.0; StatSoft; TIBCO Software). Количественные данные, с учетом нормальности распределения признака, описывались с использованием среднего арифметического (М) и стандартного отклонения (SD). Качественные показатели представляли в абсолютных (n) и в относительных (%) величинах.
Значимость различий (p) оценивали: при наличии нормальности распределения признаков и однородности дисперсий по t-критерию Стьюдента, при ненормальности – U-критерию Манна–Уитни. За критическую принимали величину уровня значимости (р) менее 0,05. Значимость различий исходов вследствие изучаемого фактора оценивали по критерию хи-квадрат (χ2), при численности участников исследования менее 10 – χ2 с поправкой Йейтса. Тесноту связи изучаемого исхода и фактора воздействия оценивали при помощи отношения шансов (ОШ) с 95% доверительным интервалом (95% ДИ).
Для решения задачи бинарной классификации (разделения данных на два класса) использовали логистическую регрессию – это алгоритм машинного обучения для прогнозирования вероятности принадлежности объекта к одному из классов. Оценивали свободный член (B0), стандартную ошибку, критерий Вальда и его значимость (р-значение). Отношение несогласия вычисляется как отношение произведения чисел правильно расклассифицированных наблюдений к произведению чисел неправильно расклассифицированных. Отношение несогласия больше 1 показывает, что построенная классификация лучше, чем если проводить классификацию наугад. Оценку качества полученных моделей основывали на построении ROC-кривой, определения AUC (Area Under Curve, площадь под ROC-кривой). Качество модели отражал численный показатель AUC: его значения от 8,0 и выше свидетельствовали об очень хорошем качестве математической модели.
Результаты
Стероидный профиль мочи соответствовал ГА у 32/63 (50,79%) женщин с ИЦН (из них: у 26/31 (81,25%) – смешанного генеза, у 6/31 (18,75%) – яичникового) и у 22,86% женщин группы контроля (из них: у 7/8 (87,5%) – смешанного генеза, у 1/27 (12,5%) – яичникового).
Отмечено, что у части женщин без ГА как с ИЦН, так и группы контроля уровень андрогенов, соответствуя норме, достигал верхних ее границ, а у женщин с ИЦН отмечен сниженный уровень экскреции прегнандиола и других стероидов беременности, отражая угрозу невынашивания (рис. 1).
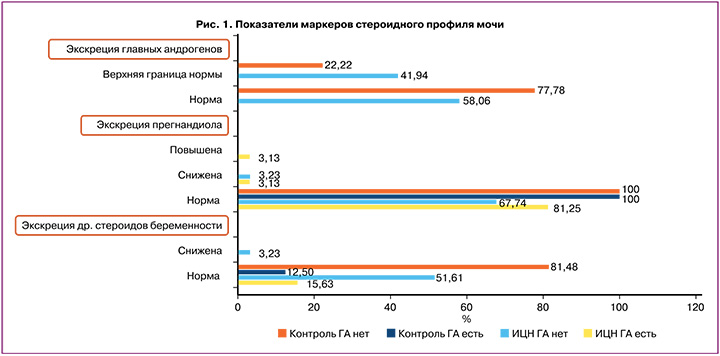
При отсутствии ИЦН у 6/35 (17,14%) женщин показатели главных андрогенов соответствовали верхним границам нормы. При сравнении всех 22 маркеров стероидного профиля мочи установлены значимые в дифференцировке женщин с ИЦН и без нее (группы контроля), независимо от наличия или отсутствия у них ГА (табл. 1).
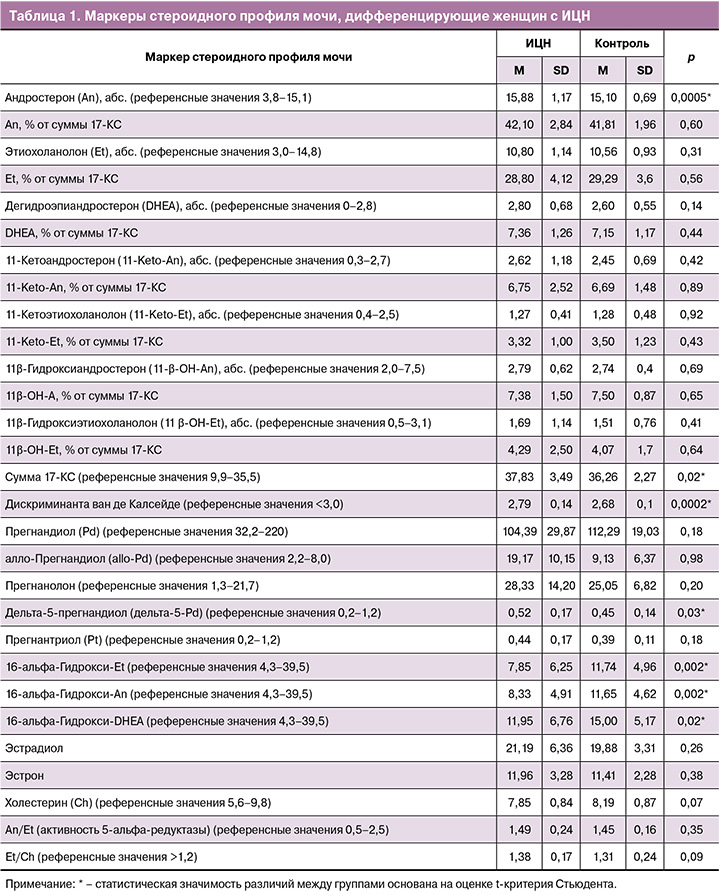
Женщин с ИЦН от группы контроля отличали: более высокий уровень андростерона (абс.) (р<0,001), суммы 17-КС (р=0,02), дискриминанты ван де Калсейде (р<0,001), дельта-5-прегнандиола (р=0,03), но более низкий уровень 16-альфа-Гидрокси-Et (р<0,001), 16-альфа-Гидрокси-An (р<0,001) и 16-альфа-Гидрокси-DHEA (р=0,02) (рис. 2).
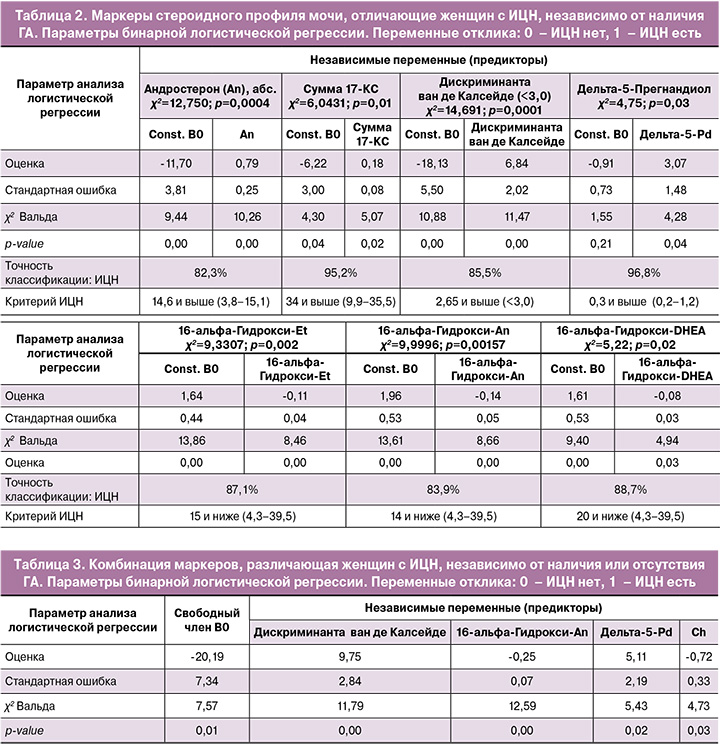
Особенностями стероидного профиля мочи женщин с ИЦН, независимо от наличия или отсутствия ГА, явились: 1) повышение андрогенных маркеров как преимущественно яичникового, так и смешанного генеза (андростерон (абс.), сумма 17-КС, дискриминанта ван де Калсейде [величина, показывающая вероятность наличия синдрома поликистозных яичников, вычисляется по формуле 0,09×(An+Et+11-OH-An+An/Et)]); 2) повышение уровня дельта-5-Прегнандиола – метаболита прогестинов, что, вероятно, отражает компенсаторных механизмов организма женщины, направленные на сохранение беременности; 3) снижение уровня метаболитов андрогенов, как яичникового, так и смешанного генеза (16-альфа-Гидрокси-Et, 16-альфа-Гидрокси-An, 16-альфа-Гидрокси-DHEA) (табл. 2).
Из таблицы 2 следует, что установленные значения маркеров стероидного профиля мочи различались с точностью более 80% женщин с ИЦН и группы контроля, независимо от наличия или отсутствия ГА. Следует особо отметить, что все пороговые значения маркеров соответствовали средним значениям нормального диапазона, находились не только вне критериев ГА, но не приближались к верхним границам.
Установлена также комбинация маркеров стероидного профиля мочи, различающая женщин с ИЦН, независимо от наличия или отсутствия ГА (табл. 3).
Маркеры, вошедшие в данную комбинацию, частично отличались от мономаркеров, представленных выше. Также комбинацию сформировали маркеры, уровни которых могли значимо различаться у женщин с ИЦН и группы контроля (дискриминанта ван де Калсейде, 16-альфа-Гидрокси-An, алло-Прегнандиол (allo-Pd)), но и быть сопоставимыми между группами (холестерин и эстрон).
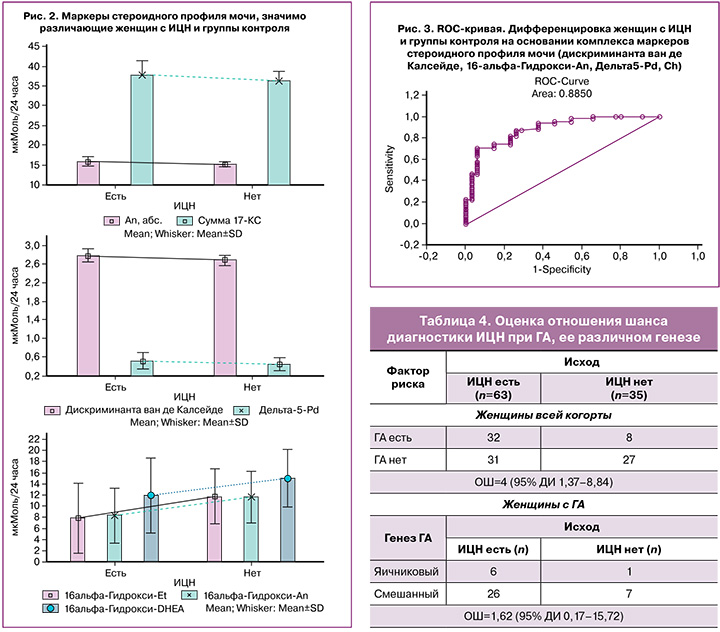
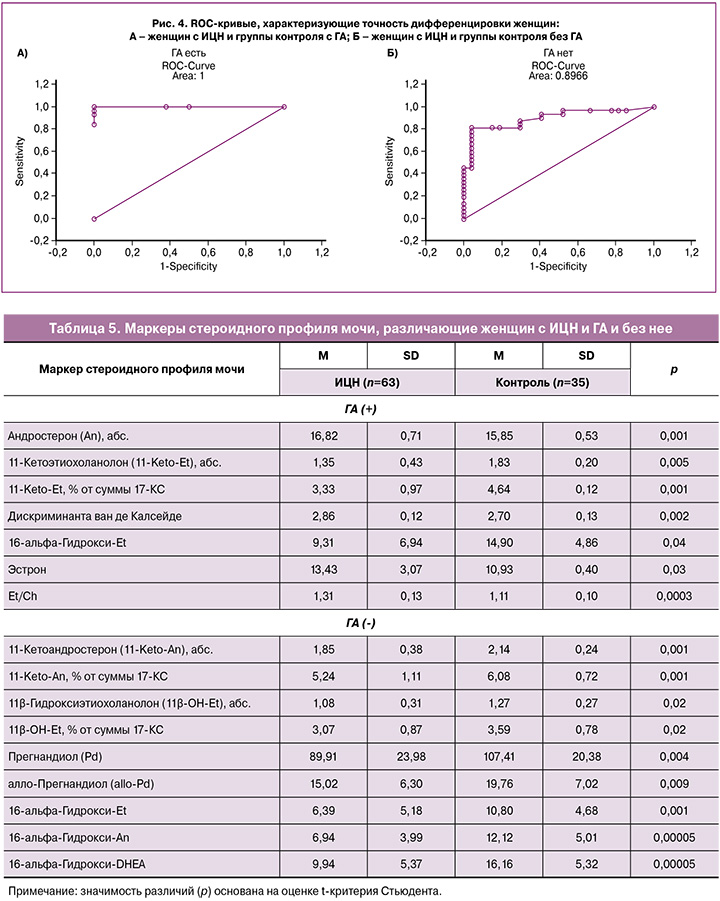
Общая точность прогноза дифференцировки женщин с наличием или отсутствием ИЦН на основании комплекса маркеров стероидного профиля мочи составила 82,47% (ОШ=19,5; Log-ОШ=2,97): наличия ИЦН – 87,1%, отсутствия – 74,29%. ROC-кривая, характеризующая точность дифференцировки, представлена на рисунке 3.
Таким образом, стероидный профиль мочи на основании моно- или комплекса маркеров явился объективным методом диагностики ИЦН, независимо от наличия или отсутствия ГА.
Представилось возможным установить связь ИЦН с ГА (χ2=6,159, р=0,014; ОШ=3,48, 95% ДИ 1,37–8,84) (табл. 4).
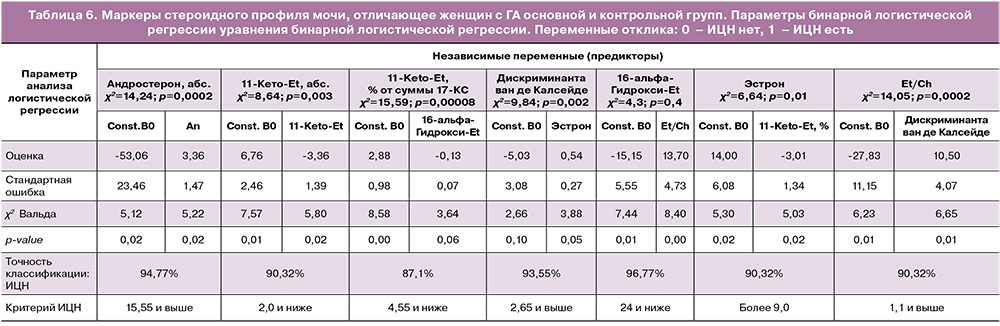
Несмотря на то что количество женщин с ИЦН и ГА различного генеза было сопоставимо (χ2=0,011, р=0,92), яичниковый генез ГА оказался более сопряженным с ИЦН. Нами были выделены маркеры, значимо различающие женщин с ИЦН, ассоциированной с ГА или нет (табл. 5).
Значимость различий женщин с ИЦН от группы контроля определяли практически только андрогены (6 из 7), несмотря на широкий спектр 29 маркеров стероидного профиля мочи: при ГА(+) дифференцировку определяли более высокие (р<0,05) показатели An, дискриминанты ван де Калсейде, Et/Ch и эстрона и более низкие – 11-Keto-Et, абс. и % от суммы 17-КС, 16-альфа-Гидрокси-Et. При ГА(-) из 9 маркеров 7 являлись андрогенами, женщин с ИЦН от группы контроля отличали (р<0,05) значительно более низкий уровень 11-Keto-An, абс. и % от суммы 17-КС, 11β-ОН-Et, абс. и % от суммы 17-КС, 16-альфа-Гидрокси-Et, 16-альфа-Гидрокси-An и 16-альфа-Гидрокси-DHEA. Следует подчеркнуть, что только у женщин без ГА ИЦН сопровождалась значительно более низкими показателями Pd (89,91±23,98 и 107,41±20,38 мкМоль/24 ч, р=0,004) и allo-Pd (15,02±6,30 и 19,76±7,02 мкМоль/24 ч, р=0,009), отражающими угрозу невынашивания беременности. У женщин с ГА при ИЦН и в группе контроля уровень Pd (118,87±28,39 и 117,53±17,91 мкМоль/24 ч, р=0,9) и allo-Pd (23,32±11,60 и 17,01±2,72 мкМоль/24 ч, р=0,14) были сопоставимы.
Учитывая сопряженность ГА с ИЦН, были рассчитаны значения каждого маркера (мономаркера) стероидного профиля мочи, различающие женщин с ГА основной и контрольной групп (табл. 6).
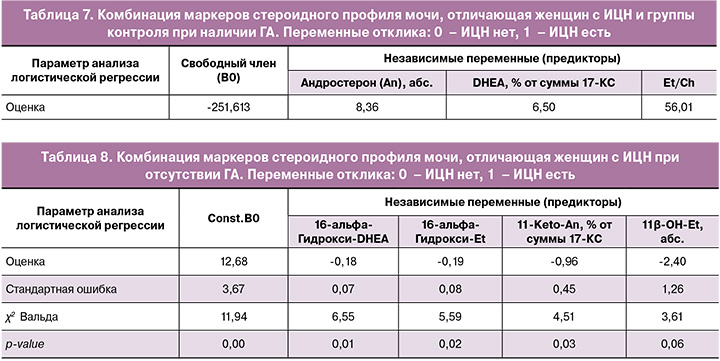
Установлена комбинация маркеров стероидного профиля мочи, различающая женщин с ГА или без ГА в основной и контрольной группах. При ГА(+) дифференцировку женщин с ИЦН и группы контроля определяла комбинация только «андрогенных» маркеров (табл. 7): An абс., DHEA (% от суммы 17-КС) и Et/Ch (точность для ИЦН составила 96,77, для контроля – 100% (χ2=35,329, p<0,001)).
При отсутствии ГА дифференцировку женщин с ИЦН определяла иная комбинация маркеров – метаболитов андрогенов: 16-альфа-Гидрокси-DHEA, 11-Keto-An, % от суммы 17-КС, абс. значения 16-альфа-Гидрокси-Et и 11β-ОН-Et; точность для ИЦН – 80,65%, для контроля – 85,19% (χ2=33,75, p<0,001; ОШ=23,96; Log-ОШ=3,18) (табл. 8).
Дифференцировка женщин с ИЦН, ассоциированной или не ассоциированной с ГА, основанная на комплексе маркеров стероидного профиля мочи, подтверждена ROC-кривыми, представленными на рисунке 4.
Таким образом, оценка стероидного профиля мочи показана методом дифференциальной диагностики ИЦН, ассоциированной с ГА или нет.
Обсуждение
Современные меры по прогнозированию преждевременных родов и патогенетические подходы к коррекции ИЦН не всегда учитывают ГА и тем более ее генез, что обосновало выполнение настоящего исследования.
Анализ стероидного профиля мочи представляет информативный метод диагностики генеза ГА при беременности в дополнение к стандартным методикам своевременной профилактики и лечения ИЦН. Современные способы коррекции ИЦН [15, 16] подразумевают 3 пути: консервативный, медикаментозный и хирургический; но наличие ГА не учитывается, как и при лечении НБ в целом. Имеются отдельные исследования, где указывается необходимость назначения прогестерона при сопряженной с ГА ИЦН [17]. Применение вагинального прогестерона по эффективности не уступает наложению серкляжа в предотвращении преждевременных родов и улучшении перинатальных исходов у женщин с одноплодной беременностью, спонтанными преждевременными родами в анамнезе и сонографическими маркерами укорочения шейки матки во II триместре беременности [18].
Оценка особенностей стероидного профиля и количественного определения стероидов мочи выявила ГА как у женщин с ИЦН (50,79%), так и в группе контроля (22,86%). Преимущественным оказался смешанный генез ГА (соответственно 81,25 и 87,5%). Нами установлено, что для ИЦН, независимо от наличия или отсутствия ГА, характерны как отдельные (моно) маркеры стероидного профиля мочи (более высокий уровень андростерона (абс.), суммы 17-КС, дискриминанты ван де Калсейде, дельты-5-Прегнандиола, но более низкий уровень 16-альфа-Гидрокси-Et, 16-альфа-Гидрокси-An и 16-альфа-Гидрокси-DHEA), так и их комбинация (дискриминанта ван де Калсейде, 16-альфа-Гидрокси-An, allo-Pd, холестерин и эстрон).
Женщин с ИЦН, ассоциированной с ГА, отличают более высокие показатели An абс., дискриминанты ван де Калсейде, Et/Ch и эстрона, но более низкие уровни 11-Keto-Et, абс. и % от суммы 17-КС, 16-альфа-Гидрокси-Et. Следует отметить, что дифференцирующие уровни маркеров соответствуют диапазону не ГА, а верхним границам нормы. Отмечено, что значимо более низкие уровни Pd и allo-Pd явились объективным диагностическим критерием угрозы НБ при ИЦН только у женщин без ГА, но не при наличии ГА.
Заключение
ГА может привести к изменениям в метаболических процессах, проявляющимся в стероидном профиле мочи, так как моча является отражением общего метаболического состояния и содержит в себе метаболиты. Основываясь на данных стратификации, можно выявить определенные метаболические образцы, которые свидетельствуют о связи между ГА и потенциальным риском развития ИЦН.
Изучение стероидного профиля мочи в сочетании со стратификацией метаболитов представляет собой важный инструмент для определения связи между ГА и риском ИЦН, а также дает понимание метаболических процессов, лежащих в основе этой связи.



