Синдром поликистозных яичников (СПКЯ) – эндокринно-метаболическое заболевание, распространенность которого, достигая 22,5% [1], варьирует в зависимости от критериев диагностики. Как известно, СПКЯ характеризуется инсулинорезистентностью (ИР) и избытком жировой ткани, которые предрасполагают к развитию сахарного диабета (СД) 2-го типа, сердечно-сосудистых заболеваний, а также гестационных осложнений [2)]. С внедрением в клиническую практику методов оценки композиционного состава тела появились данные о наличии избыточного количества жировой ткани, в том числе наиболее метаболически активной – висцеральной ткани, не только при ожирении и избыточной массе тела, но и у пациенток с СПКЯ, имеющих нормальный индекс массы тела (ИМТ) [3]. Стоит отметить, что у 20–30% таких пациенток присутствует метаболическая дисфункция в виде нарушения толерантности к глюкозе (НТГ), дислипидемии (ДЛП) и ИР, провоцирующей компенсаторную гиперинсулинемию (ГИ) и гиперандрогению [4].
В последние годы появились данные о косвенных признаках хронического субклинического воспаления у пациенток с СПКЯ в виде умеренного повышения уровней провоспалительных цитокинов и С-реактивного белка (СРБ) [5, 6]. Сообщается также о положительной корреляции СРБ и ИР с массой жировой ткани [5–7]. Неясно, связано ли хроническое субклиническое воспаление с СПКЯ или в большей степени с ИР и ожирением. Также дискуссионным остается вопрос о повышении уровня интерлейкина (IL)-6, который является наиболее активным индуктором продукции СРБ в печени у пациенток с СПКЯ. Так, результаты метаанализа Escobar-Morreale et al. не выявили различий в сывороточных уровнях IL-6 между пациентками с СПКЯ и здоровыми женщинами, в то время как в нескольких других исследованиях было продемонстрировано значимое повышение его уровня [6, 8–10].
Потенциальная связь СПКЯ с повышением уровня фактора некроза опухоли альфа (TNF-α) также вызывает интерес, поскольку, являясь важным медиатором ИР, он связан с такими компонентами метаболического синдрома, как НТГ, артериальная гипертензия и ДЛП [11]. Результаты исследований уровня TNF-α при СПКЯ разноречивы. Наряду с данными о повышении уровня TNF-α по сравнению с контрольной группой даже при нормальном ИМТ [12, 13], имеются данные об отсутствии различий между группами [7, 10].
Некоторые исследования продемонстрировали взаимосвязь воспаления, возникающего в жировой ткани, с метаболической дисфункцией [14–16]; однако если взаимосвязь воспаления с ожирением подтверждена данными литературы, то повышение провоспалительных маркеров у пациенток с СПКЯ, особенно при нормальной массе тела, остается предметом дискуссий.
Цель данного исследования: изучить уровни провоспалительных маркеров в сыворотке крови пациенток с СПКЯ и их связь с композиционным составом тела и метаболическими параметрами.
Материалы и методы
Проведено одноцентровое одномоментное исследование. СПКЯ диагностировался согласно Роттердамским критериям (2003 г.): биохимические и/или клинические признаки гиперандрогении; аменорея, ановуляция или олигоменорея; ультразвуковые данные поликистозных яичников. Критериями исключения из исследования послужили тяжелые соматические заболевания, системные аутоиммунные заболевания и прием гормональной терапии менее чем за 3 месяца до включения в исследование (рис. 1).
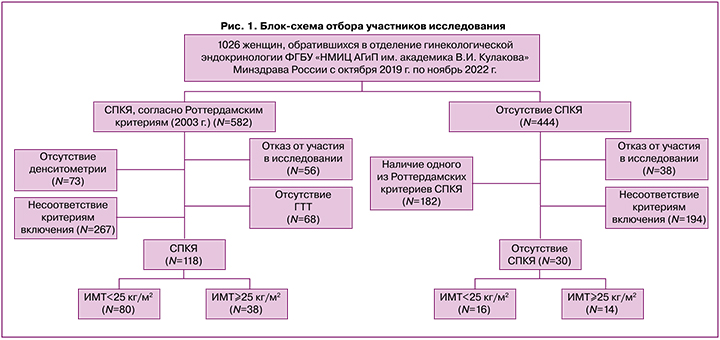
Всего в исследовании приняли участие 148 женщин в возрасте от 18 до 40 лет. Основную группу составили 118 женщин с СПКЯ (средний возраст 25,1 (5,5) года, ИМТ – 24,1 (5,1) кг/м2); группу сравнения – 14 женщин с избыточной массой тела и ожирением при отсутствии СПКЯ (средний возраст 26,0 (7,4) года, ИМТ – 29,1 (3,4) кг/м2); контрольную группу – 16 соматически здоровых женщин (средний возраст 25,3 (5,1) года, ИМТ – 20,4 (1,7) кг/м2). Статистически значимых различий по возрасту среди групп не было (p>0,05). Основная группа пациенток была разделена на подгруппы по ИМТ: 1-я включала 80 пациенток с ИМТ<25 кг/м2, 2-я – 38 пациенток с ИМТ≥25 кг/м2 (вследствие малочисленности было решено объединить пациенток с избыточной массой тела и ожирением в одну подгруппу).
В соответствии с клиническими рекомендациями для диагностики СПКЯ на 2–3-й день спонтанного или индуцированного прогестероном менструального цикла было произведено исследование гормонального профиля, на 5–7-й день цикла – ультразвуковое исследование (УЗИ) органов малого таза [17].
Определение содержания IL-1β, IL-6 и TNF-α в образцах сывороток периферической крови выполняли методом твердофазного иммуноферментного анализа с использованием тест-систем АО «Вектор-Бест» (Россия). Учет результатов производили на планшетном спектрофотометре Infiniti F50 TECAN. Определение уровней лептина и адипонектина проводили твердофазным иммуноферментным методом с помощью коммерческих наборов Leptin ELISA (DBC, Канада) и Human Adiponectin ELISA (BioVendor, Чехия).
Определение СРБ и липидного спектра крови производили фотометрическими и турбидиметрическими методами на автоматических анализаторах BA-400 (Biosystems, Испания). Нарушения углеводного обмена и ГИ диагностировали на основе результатов перорального 2-часового глюкозотолерантного теста с нагрузкой глюкозой 75 г. Уровни глюкозы и иммунореактивного инсулина (ИРИ) определяли натощак, а также каждые 60 минут в течение 2 ч исследования. Была рассчитана модель оценки чувствительности к инсулину (HOMA-IR): глюкоза натощак (ммоль/л) × ИРИ натощак (мкЕД/мл)/22,5. Индекс НОМА больше 2,7 рассматривался как критерий ИР [18]. НТГ диагностировалось на основании уровня глюкозы через 2 ч после нагрузки более 7,8 ммоль/л или уровня глюкозы натощак выше 6,1 и ниже 7,0 ммоль/л [19].
Композиционный состав тела оценивали методом двухэнергетической рентгеновской абсорбциометрии (денситометрии) на аппарате Lunar model 8743; GE Medical Systems (Madison, WI USA). Были проанализированы следующие параметры: процент общей жировой ткани (ОЖТ), масса жировой ткани всего тела и области туловища, андроидная и гиноидная жировая ткань. Доля ОЖТ ≥30% трактовалась как избыток жировой ткани или «скрытое ожирение» [20–22]. С помощью программы CoreScan определялись объем и масса висцеральной жировой ткани (ВЖТ), ее избыток диагностировался при массе более 235 г [23].
Статистический анализ
Статистический анализ проводили с использованием программы SPSS (IBM Statistical Package for the Social Sciences, 21 версия). Для количественных показателей были рассчитаны: среднее значение (М), среднеквадратическое отклонение (SD), медиана (Ме), интерквартильный размах (Q1; Q3). Для качественных и порядковых показателей – частоты (%). При нормальном распределении числовые параметры представлены в формате М (SD), в ином случае – в формате Ме (Q1; Q3). Для нахождения различий между группами пациентов для нормально распределенных числовых показателей использовали критерий ANOVA (для нескольких групп) и затем применяли попарное сравнение групп с помощью t-критерия Стьюдента для двух независимых выборок. В ином случае для сравнения количественных данных применяли непараметрические методы Краскела–Уоллиса (для нескольких групп) и затем осуществляли попарное сравнение групп с помощью метода U-критерия Манна–Уитни для несвязанных совокупностей. При множественных сравнениях применяли поправку Бонферрони.
Для сравнения дихотомических показателей между независимыми выборками и установления достоверных различий между ними использовали метод Хи-квадрат (χ2) с поправкой Йейтса на непрерывность, при попарном сравнении групп использовали точный критерий Фишера для небольших выборок.
Корреляционный анализ проводили с помощью метода Пирсона (для нормально распределенных параметров) или непараметрического критерия Спирмена. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Исследование было одобрено этическим комитетом, проводилось на базе отделения гинекологической эндокринологии Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. академика В.И. Кулакова МЗ РФ, все участницы подписали информированное согласие.
Результаты
В группе пациенток с СПКЯ у 19/118 (16,1%) была диагностирована избыточная масса тела (ИМТ 25–29,9 кг/м2), у 19/118 (16,1%) – ожирение (ИМТ ≥30 кг/м2). Клинические признаки андрогенизации в виде гирсутизма, акне были выявлены у 67/118 (56,8%) пациенток, биохимическая гиперандрогения – у 94/118 (79,7%). У всех пациенток отмечались нарушения менструального цикла: в 81,5% случаев – олигоменорея, в 18,5% — первичная или вторичная аменорея.
Проведенный анализ показал, что средние уровни IL-6, TNF-α и СРБ в сыворотке крови пациенток с СПКЯ были значительно выше, чем в контрольной группе, p<0,05 (табл. 1). Повышение уровней СРБ и IL-6 наблюдалось у 39,8 и 37,2% пациенток с СПКЯ и ни в одном случае в группе контроля. Повышения уровней TNF-α ни в одной группе обнаружено не было. Статистически значимых различий по уровням IL-1, лептина и адипонектина между этими группами не установлено. Ни один из средних показателей исследуемых параметров, кроме адипонектина, в группе сравнения существенно не отличался от группы с СПКЯ, однако уровни СРБ и IL-6 были выше, чем в контрольной (р=0,002 и р=0,03 соответственно). Повышения уровней СРБ в группе сравнения не выявлено, уровень IL-6 превышал нормальные значения в 21% случаев, то есть почти в 2 раза реже, чем при СПКЯ.
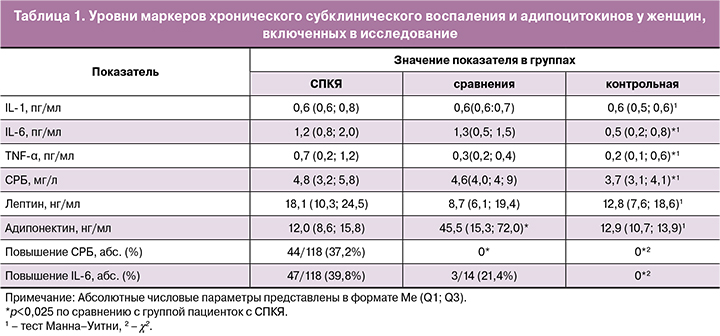
Результаты анализа уровней маркеров хронического субклинического воспаления с учетом ИМТ, представленные на рисунке 1, указывают на отсутствие различий по средним показателям IL-6, TNF-α и СРБ между группой сравнения (женщины без СПКЯ, ИМТ≥25 кг/м2) и 1-й подгруппой (СПКЯ, ИМТ<25 кг/м2). Во 2-й подгруппе (СПКЯ при ИМТ≥25 кг/м2) их значения были статистически значимо выше, чем во всех остальных (рис. 2).
Частота повышения уровня СРБ в подгруппе 2 составила 22/38 (60,5%), что в 2 раза выше, чем в подгруппе 1 – 20/80 (25%) (р<0,001). Повышение уровня IL-6 встречалось в подгруппе 2 в 27/38 (71,1%) случаях, что более чем в 3 раза чаще (р=0,002), чем в 1-й подгруппе и группе сравнения, где его частота составила 14/80 (17,5%) и 3/14 (21,0%) соответственно (p>0,05).
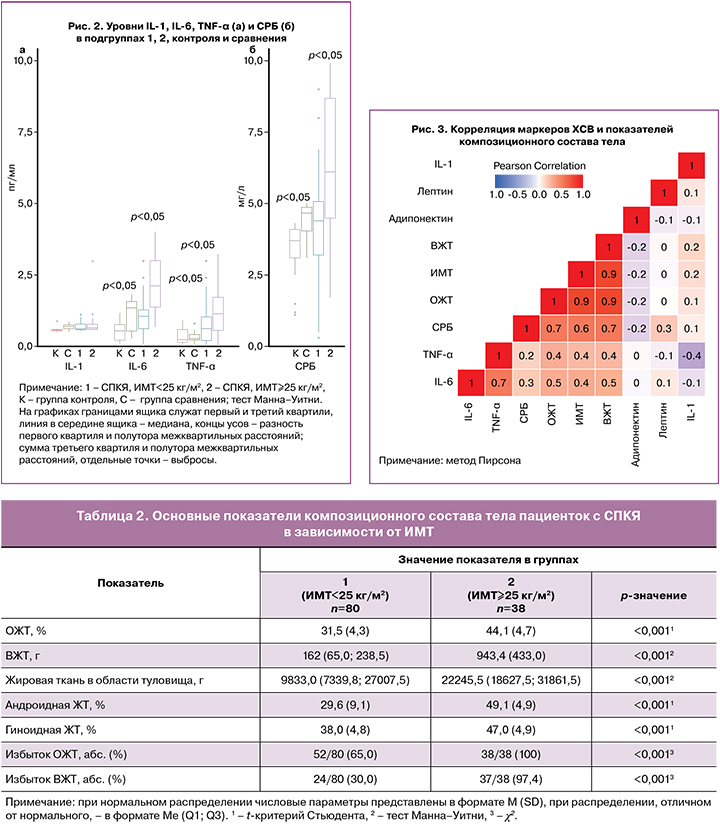
Результаты денситометрии свидетельствуют о том, что, несмотря на нормальный ИМТ, у 65,0% пациенток подгруппы 1 (ИМТ<25 кг/м2) было выявлено «скрытое» ожирение в виде избытка ОЖТ, в 46,2% (24/52) случаев проявляющееся избытком ВЖТ (табл. 2).
Данные корреляционного анализа, представленные на рисунке 3, свидетельствуют о наличии прямой взаимосвязи уровней IL-6 и СРБ с показателями композиционного состава тела. Наиболее сильная корреляция этих показателей была обнаружена с ОЖТ (r=0,5; p<0,001 и r=0,7; p<0,001), а также с массой ВЖТ (r=0,5; p<0,001 и r=0,7; p<0,001). Корреляция СРБ с лептином и адипонектином была более слабой (0,3 и -0,2 соответственно, р<0,05). Корреляции уровней цитокинов с андрогенным профилем обнаружено не было.
Учитывая корреляцию между провоспалительными маркерами и жировой тканью, а также наличие у 65,0% пациенток с СПКЯ при ИМТ<25 кг/м2 избытка жировой ткани, было проведено сравнение показателей композиционного состава тела и цитокинов пациенток со «скрытым ожирением» и без него (табл. 3).
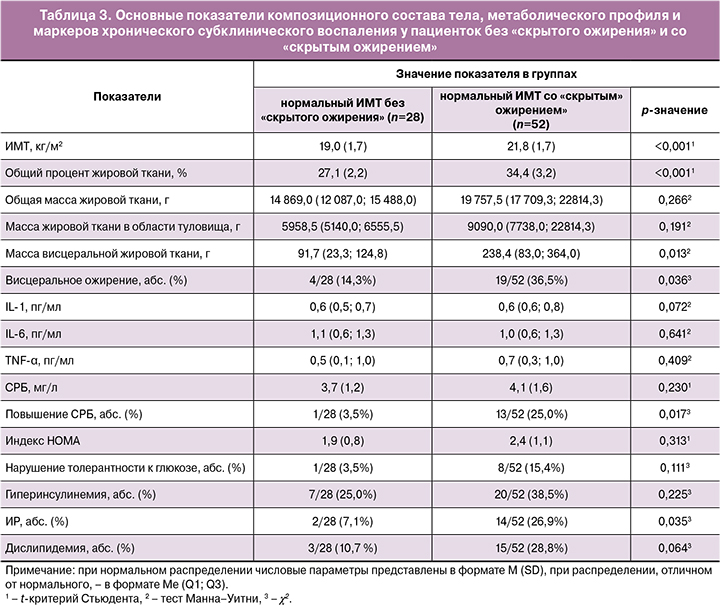
Не было обнаружено статистически значимых различий по средним значениям провоспалительных цитокинов. Однако в группе пациенток со «скрытым ожирением» в 7 раз чаще выявлялось повышение уровня СРБ (25,0%) и почти в 4 раза – индекса ИР (26,9%), чем у пациенток с нормальным процентом ОЖТ (3,5% и 7,1% соответственно, р=0,017).
Обсуждение
В последние годы СПКЯ рассматривается не только как основная причина ановуляторного бесплодия и гиперандрогении, но и как метаболический репродуктивный синдром, ассоциированный с хроническим субклиническим воспалением [6]. Известно, что СПКЯ рассматривается как фактор риска сердечно-сосудистых заболеваний и гестационных осложнений (артериальной гипертензии, преэклампсии, гестационного сахарного диабета, задержки роста плода), приводящих к увеличению перинатальной заболеваемости и смертности, за счет ИР, дислипидемии и избытка жировой ткани [24]. Однако причинно-следственная связь между СПКЯ, ожирением и повышенными уровнями провоспалительных цитокинов четко не определена [25].
В данном исследовании была проведена оценка основных провоспалительных цитокинов и СРБ у пациенток с СПКЯ с учетом ИМТ и композиционного состава тела. Выявлено повышение уровней IL-6, TNF-α и СРБ по сравнению с контрольной группой. Эти данные сопоставимы с результатами метаанализа 31 клинического исследования, проведенного Escobar-Moralle et al. (2011), в котором авторы пришли к выводу, что уровень СРБ у пациенток с СПКЯ статистически значимо выше, чем у здоровых женщин, что может отражать взаимосвязь СПКЯ и хронического субклинического воспаления [6]. Корреляции СПКЯ с уровнями IL-6 и TNF-α обнаружено не было. Вместе с тем существует немало данных об их повышении у пациенток с СПКЯ [6, 8–10, 12,13].
При разделении пациенток на группы по ИМТ было обнаружено, что уровни провоспалительных цитокинов и СРБ, а также частота повышения IL-6 у пациенток с СПКЯ без ожирения статистически значимо не отличались от таковых у группы женщин без СПКЯ с ожирением и избыточной массой тела. Несмотря на нормальный ИМТ, у каждой 4-й пациентки с СПКЯ отмечалось повышение СРБ, у каждой 5-й – повышение IL-6. Это может объясняться тем, что по последним данным ИМТ нельзя считать достаточно информативным показателем, отражающим количество жировой ткани [4, 26]. В связи с этим пациенткам была произведена денситометрия, которая выявила у 65% пациенток с СПКЯ и нормальным ИМТ «скрытое» ожирение, ассоциированное с семикратным увеличением частоты повышения уровня СРБ и четырехкратным – ИР, в сравнении с группой без «скрытого ожирения». Наличие избытка ОЖТ у всех пациенток с СПКЯ и ИМТ≥25 кг/м2 было ассоциировано с признаками хронического субклинического воспаления в 71,1% случаев. Существует такое понятие, как «метаболическое воспаление», которое возникает вследствие гипертрофии адипоцитов и накопления в жировой ткани иммунных клеток, секретирующих провоспалительные цитокины, у пациентов с избытком жировой ткани [27]. Это позволяет предположить, что именно жировая ткань является основным источником провоспалительных цитокинов, усугубляющих течение СПКЯ, что подтверждает целесообразность оценки композиционного состава тела методом денситометрии жировой ткани у таких пациенток. При невозможности ее проведения ИМТ ≥23 кг/м2 можно рассматривать как клинический маркер избытка жировой ткани, повышающий риск развития метаболических нарушений, ассоциированных с хроническим субклиническим воспалением [4].
Некоторые исследователи связывают наличие и степень воспаления у пациенток с СПКЯ с гиперандрогенией. В частности, этот вопрос обсуждается в метаанализе Aboeldalyl S. et al. в связи с тем, что уровни СРБ при неандрогенных фенотипах СПКЯ были сопоставимы с контрольной группой [27]. В проведенном исследовании не было получено данных о взаимосвязи андрогенов с маркерами хронического субклинического воспаления при СПКЯ; в то же время обнаружена корреляция провоспалительных цитокинов и СРБ с показателями композиционного состава тела, особенно с ВЖТ. Анализ адипоцитокинов оказался малоинформативным; по-видимому, в связи с тем, что в исследование были включены пациентки с относительно невысоким ИМТ.
Таким образом, избыток жировой ткани может усугублять хроническое субклиническое воспаление, связанное с СПКЯ, что приводит к образованию «порочного круга» патологических состояний, ведущих к метаболическим осложнениям и повышению сердечно-сосудистых рисков, так как у трети больных уже в молодом возрасте могут выявляться маркеры субклинического атеросклероза в виде эндотелиальной дисфункции, увеличения толщины интима-медиа, кальцификации сонных артерий [28]. Более того, известно, что СПКЯ в 3–4 раза повышает риск развития гестационных осложнений [24]. Некоторые авторы связывают это с усугублением ИР на фоне беременности и увеличением маркеров хронического субклинического воспаления [29]. Согласно полученным результатам, у каждой 3-й пациентки с СПКЯ присутствуют признаки хронического субклинического воспаления, которые при отсутствии коррекции могут привести к гестационным осложнениям.
В последние годы все больше данных свидетельствует о взаимосвязи хронического субклинического воспаления при СПКЯ с нарушением кишечной микробиоты. Предполагается, что изменение состава кишечной микробиоты в виде снижения колонизационных показателей бактерий, продуцирующих короткоцепочечные жирные кислоты и увеличения бактерий, продуцирующих липополисахарид, провоцируют хроническое субклиническое воспаление за счет проникновения липополисахарида в системный кровоток, что вызывает иммунный ответ в виде повышения провоспалительных цитокинов [30]. Это указывает на необходимость модификации образа жизни и нормализации состава кишечной микробиоты пациенткам с СПКЯ и избытком жировой ткани. Данный подход особенно важен при подготовке к беременности, учитывая неблагоприятный метаболический фон. Некоторые исследования указывают на положительное влияние метформина и пробиотиков не только на ИР, ГА, регуляцию ритма менструаций и снижение массы тела, но и на снижение уровней IL-6 и СРБ [31]. Таким образом, наличие признаков ХСВ является еще одним аргументом для оптимизации тактики ведения пациенток с СПКЯ.
Заключение
Результаты проведенного исследования указывают на наличие лабораторных признаков хронического субклинического воспаления в виде повышения уровней СРБ и/или IL-6 у каждой 3-й пациентки с СПКЯ. Избыток жировой ткани ассоциирован с более высокими уровнями провоспалительных маркеров не только у пациенток с ожирением, но и при нормальном ИМТ и «скрытом» ожирении, при котором в каждом 4-м случае выявлено повышение уровня СРБ. Полученные данные позволяют отнести эти категории пациенток к группе риска по развитию метаболического синдрома, гестационных осложнений и сердечно-сосудистых заболеваний и подтверждают целесообразность коррекции модифицируемых факторов риска путем изменения образа жизни, медикаментозной терапии и прегравидарной подготовки.



