Синдром поликистозных яичников (СПКЯ) – одно из наиболее распространенных эндокринных нарушений у женщин репродуктивного возраста, его частота колеблется от 6 до 19,9%. Помимо типичных нарушений в виде олиго- и ановуляции, гиперандрогении и поликистозной морфологии яичников, у каждой 2–3-й пациентки наблюдаются метаболические нарушения, которые усугубляются на фоне избыточной массы тела и ожирения [1, 2]. Некоторые исследования продемонстрировали повышенную частоту метаболической дисфункции у пациенток с СПКЯ без ожирения [1, 3, 4]. В метаанализе 2010 г. приведены данные о трехкратном увеличении риска нарушения толерантности к глюкозе (НТГ) и метаболического синдрома у пациенток с СПКЯ при нормальном индексе массы тела (ИМТ) по сравнению с группой здоровых женщин [1]. Схожие данные были представлены в метаанализе 2019 г., где указывается также на значительное повышение риска гиперинсулинемии и инсулинорезистентности (ИР) [5]. Вместе с тем, в ряде других исследований не было выявлено существенных различий в частоте встречаемости НТГ и сахарного диабета 2 типа между пациентками СПКЯ, имеющими нормальную массу тела и здоровыми женщинами контрольной группы [6, 7].
Вопрос о клинической значимости ИМТ в последние годы достаточно широко дискутируется на страницах научных журналов. Американская ассоциация клинических эндокринологов предлагает не рассматривать ИМТ в качестве ключевого критерия ожирения, которое можно диагностировать даже при ИМТ 25 кг/м2 и наличии хотя бы одного осложнения, заболевания или состояния, с ним ассоциированного [8]. Стоит отметить также, что ИМТ представляет собой простое уравнение, основанное на параметрах роста и массы тела, которая включает жировую, мышечную, костную ткань, а также воду в организме [9]. Результаты проведенных исследований показали, что ИМТ недостаточно информативен для оценки избытка или дефицита жировой ткани, тесно связанной с уровнем половых стероидных гормонов [10, 11]. Пациенты с нормальным ИМТ могут иметь НТГ, ИР и гиперинсулинемию, это трактуется как метаболическое ожирение при нормальном весе (metabolically obese normal weight) [12]. Хорошо известно о взаимосвязи избытка жировой ткани, особенно ее повышенного накопления в абдоминальной области, с развитием метаболической дисфункции [8, 13]. Информативным, достаточно простым и недорогим методом оценки композиционного состава тела, включающим количественный анализ и характер распределения жировой и безжировой массы тела, является двухэнергетическая рентгеновская абсорбциометрия (денситометрия). Однако в настоящее время данный метод не включен в алгоритм обследования пациенток с СПКЯ, что может приводить к недооценке кардио-метаболических рисков.
Цель данного исследования: провести сравнительный анализ диагностической значимости ИМТ и композиционного состава тела, их сопряженности с гормонально-метаболическим профилем пациенток с СПКЯ.
Материалы и методы
Проведено одноцентровое одномоментное исследование. Критериями включения явились: возраст от 18 до 40 лет, СПКЯ, диагностированный по Роттердамским критериям 2003 г., наличие подписанного информированного согласия. Критериями исключения служили: тяжелые соматические заболевания; системные аутоиммунные заболевания; прием гормональной терапии менее, чем за 3 месяца до включения в исследование.
Исследование было одобрено этическим комитетом, проводилось на базе отделения гинекологической эндокринологии Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. академика В. И. Кулакова Минздрава России.
В исследование были включены 129 женщин с СПКЯ, средний возраст составил 26,7 (5,4) года, ИМТ – 23,8 (4,8) кг/м2. У 29/129 (22,5%) пациенток была диагностирована избыточная масса тела (ИМТ 25–29,9 кг/м2), у 19/129 (14,7%) – ожирение (ИМТ ≥30 кг/м2), среди них у 15/19 (78,9%) – I степени, у 4/19 (21,1%) – II степени [14]. Клинические признаки андрогенизации в виде гирсутизма, акне или алопеции были выявлены у 78/129 (60,5%) пациенток, биохимическая гиперандрогения – у 99/129 (76,7%). У всех пациенток отмечались нарушения цикла: в 101/129 (78,3%) случаев – олигоменорея, в 28/129 (21,7%) – первичная или вторичная аменорея.
Всем участницам было проведено общее клинико-анамнестическое обследование с расчетом ИМТ (вес/рост2). Денситометрия производилась на аппарате Lunar model 8743; GE Medical Systems (Madison, WI USA), были проанализированы следующие параметры: процент общей жировой ткани, масса жировой ткани всего тела и области туловища. Процент общей жировой ткани ≥30 трактовался как избыток жировой ткани или «скрытое ожирение» [15–18]. С помощью программы CoreScan определялся объем и масса висцеральной жировой ткани, ее избыток диагностировался при массе висцеральной жировой ткани более 235 г [19].
С целью постановки диагноза проводилось УЗИ органов малого таза на 5–7-й день спонтанного или индуцированного прогестагенами менструального цикла на аппарате 2000 Toshiba SSA-240 (Япония) трансвагинальным конвексным датчиком частотой 7,5 Мгц, с определением количества фолликулов и объема яичников.
На 2–3-й день менструального цикла проводили исследование гормонального профиля. Определение уровня антимюллерова гормона, лютеинизирующего гормона, фолликулостимулирующего гормона, эстрадиола, общего тестостерона и инсулина выполнялось в сыворотке крови электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе Cobas е411 (Roche Diagnostics GmbH, Германия) с использованием коммерческих наборов данного производителя. Определение уровня андростендиона и глобулина, связывающего половые гормоны, выполнялось иммунохемилюминесцентным методом на автоматическом иммунохимическом анализаторе IMMULITE 2000 (Siemens, США). Определение 17-ОН-прогестерона и свободного тестостерона проводили твердофазным иммуноферментным методом с помощью коммерческих наборов «ДРГ 17-α-ОН-Прогестерон ИФА» (DRG Diagnostic, США) и Free Testosterone ELISA («Диагностикс Биохим Инк.», Канада).
Биохимические исследования производили фотометрическими и турбидиметрическими методами на автоматических анализаторах BA-400 (Biosystems, Испания). Определяли глюкозу, общий холестерин, триглицериды, холестерин липопротеидов высокой плотности, холестерин липопротеидов низкой плотности. Коэффициент атерогенности (КА) высчитывали по формуле: КА = (холестерин – липопротеиды высокой плотности)/ липопротеиды высокой плотности. Нарушения углеводного обмена и гиперинсулинемию диагностировали на основе результатов перорального 2-часового глюкозотолерантного теста с нагрузкой глюкозой 75 г. Уровни глюкозы и иммунореактивного инсулина определяли натощак, а также каждые 60 мин в течение 2 ч исследования. Была рассчитана модель оценки чувствительности к инсулину (индекс HOMA): глюкоза натощак (ммоль/л) × инсулин натощак (мкЕД/мл)/22,5. Индекс НОМА больше 2,7 рассматривался как критерий ИР [20].
Статистический анализ
Статистический анализ производили с использованием программы SPSS (IBM Statistical Package for the Social Sciences, 21 версия). Для количественных показателей были рассчитаны: среднее значение (М), среднеквадратическое отклонение (SD), 95% доверительный интервал, медиана (Ме), интерквартильный размах (Q25% ; Q75%). Для качественных и порядковых показателей – частоты (%). Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD), где М – среднее значение, SD – стандартное отклонение среднего значения. Параметры, имеющие распределение, отличное от нормального, представлены в формате Ме (Q 25%; Q 75%), где Мe – медиана, а Q 25%; и Q75% – верхний и нижний квартили. Для нахождения различий между группами пациентов для нормально распределенных числовых показателей использовали критерий ANOVA (для нескольких групп) и затем применяли попарное сравнение групп с помощью t-критерия Стъюдента для двух независимых выборок с поправкой Бонферрони на непрерывность. В случае не подтверждения гипотезы о нормальном распределении для сравнения количественных данных применяли непараметрические методы Краскела–Уоллиса (для нескольких групп) и затем осуществляли попарное сравнение групп с помощью метода U-критерия Манна–Уитни для несвязанных совокупностей. При множественных сравнениях применяли поправку Бонферрони. При проверке равенства дисперсий использовали критерий Левена (Levene test).
Для сравнения дихотомических показателей между независимыми выборками и установления достоверных различий между ними использовали метод χ2 с поправкой Йейтса на непрерывность, при попарном сравнении групп использовали точный критерий Фишера для небольших выборок.
Корреляционный анализ проводился с помощью метода Пирсона (для нормально распределенных параметров) или непараметрического критерия Спирмена. Для расчета порогового уровня показателей, их специфичности и чувствительности для выявления риска метаболических нарушений был проведен ROC-анализ. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
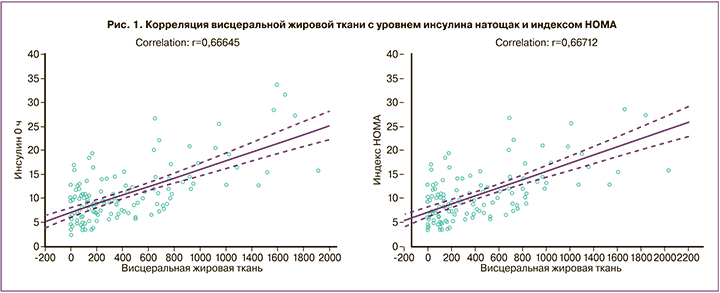
НТГ было выявлено у 20/129 (15,5%) пациенток, ИР и гиперинсулинемия соответственно у 45/129 (34,9%) и у 44/129 (34,1%), дислипидемия – у 50/129 (38,8%). По данным денситометрии избыток общей жировой ткани присутствовал у 95/129 (73,6%) пациенток, ее среднее значение составило 35,4 (6,9%), при ИМТ 23,8 (4,8) кг/м2. У 65/95 (68,4%) из них был выявлен избыток висцеральной жировой ткани, ее медиана составила 418,5 (199,5;735,5) г. Установлена прямая взаимосвязь количества висцеральной жировой ткани со всеми показателями углеводного и липидного обмена. Наибольшая корреляция наблюдалась с инсулином натощак (r=0,666, 95% ДИ=0,557–0,752, p<0,01) и индексом HOMA (r=0,667, ДИ=0,559–0,753, p<0,01) (рис. 1).
На следующем этапе было проведено сравнение метаболических параметров и композиционного состава тела пациенток с нормальным ИМТ, избыточной массой тела и ожирением. В группе с ожирением увеличение индекса ИР присутствовало у 17/19 (89,5%) пациенток, гиперинсулинемия – у 13/19 (68,4%), в группе с избыточной массой тела эти показатели составили 10/29 (34,5%) (p<0,001) и 11/29 (37,9%) (р=0,039) и статистически значимо не различались с показателями пациенток с нормальной массой тела – 16/81 (19,8%) (p=0,110) и 19/81 (23,5%) (p=0,134). При ожирении НГТ было диагностировано у 8/19 (42,1%) пациенток, при избыточной массе тела – у 6/29 (20,7%) (p=0,111), при нормальной массе тела – у 8/81 (9,9%) (в сравнении с избыточной массой тела р=0,134). Дислипидемия встречалась у 11/19 (57,9%) пациенток с ожирением, у 13/29 (44,8%) с избыточной массой тела (р=0,376) и у 21/81 (25,9%) пациенток с нормальным ИМТ (в сравнении с избыточной массой тела р=0,059).
Все пациентки с избыточной массой тела и ожирением имели избыток общей жировой ткани. Средний ее процент в данных группах составил 40,5 (3,7)% и 45,1 (3,2)% (p<0,001). В группе с нормальным ИМТ этот показатель составил 31,1 (4,6)%. При этом у некоторых пациенток он достигал уровня 42,8%. Это выше, чем среднее значение в группе с избыточной массой тела (40,5%), что вполне закономерно, поскольку у 46/81 (56,8%) пациенток с нормальным ИМТ было выявлено «скрытое ожирение», характеризующееся избытком жировой ткани, в 18/46 (39,1%) случаев представленное избытком висцеральной жировой ткани. Исходя из этого был проведен анализ показателей композиционного состава тела и метаболического профиля пациенток с нормальным ИМТ, имеющих «скрытое ожирение», и с его отсутствием (табл. 1).
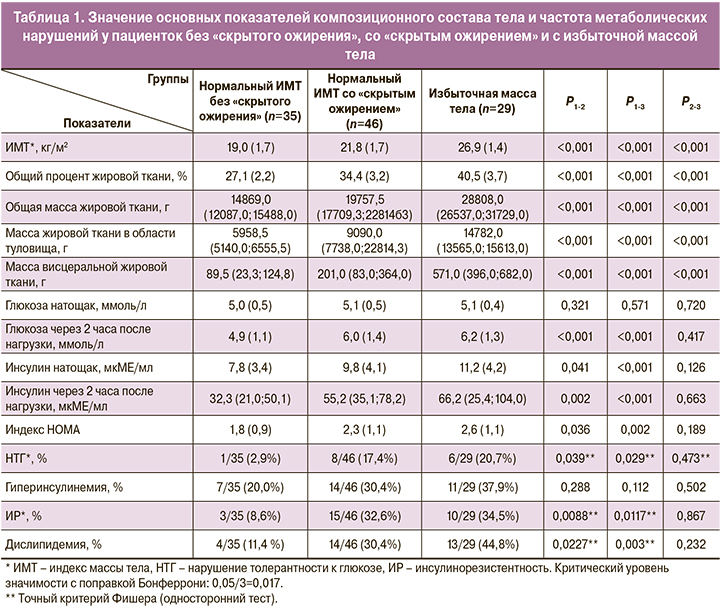
При «скрытом ожирении» средний ИМТ и процент общей жировой ткани были статистически значимо выше, чем у пациенток без него (р<0,001). Более выраженные различия касались висцеральной жировой ткани – при «скрытом ожирении» ее масса была в 3 раза больше, а масса жировой ткани области туловища – почти в 2 раза больше, чем в группе без «скрытого ожирения». Как видно из данных таблицы 1, при отсутствии существенных различий между группами по среднему уровню глюкозы натощак, средние показатели инсулина были выше при «скрытом ожирении». Частота метаболических нарушений также была в несколько раз выше в группе «скрытого ожирения», чем при его отсутствии. Показатели композиционного состава тела пациенток со «скрытым ожирением» были ниже, чем при избыточной массе тела, однако по частоте метаболических нарушений существенных различий между группами выявлено не было. В каждом 3-м случае диагностировалась гиперинсулинемия и ИР, в каждом 5-м – НТГ.
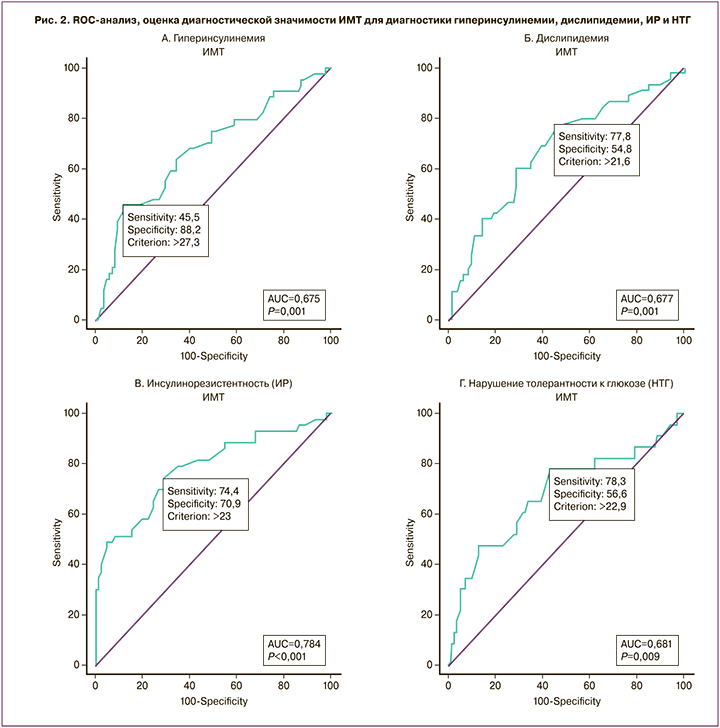
Учитывая ограниченную доступность для широкой клинической практики метода денситометрии с программой оценки композиционного состава тела и висцеральной жировой ткани, было решено определить пороговую величину ИМТ для выявления риска метаболических нарушений и избытка жировой ткани. Был проведен ROC-анализ для определения риска НТГ, ИР, гиперинсулинемии и дислипидемии, который показал наибольшую площадь под кривой для выявления ИР с помощью ИМТ (AUC=0,784 (0,046)). Пороговое значение ИМТ при проведении ROC-анализа составило 23 кг/м2 с чувствительностью 74,07% (95% ДИ 63,60–82,37) и специфичностью 70,0% (95% ДИ 56,25–80,90). Прогностическая ценность положительного результата – 80,0% (95% ДИ 69,59–87,49). Прогностическая ценность отрицательного результата 62,5% (95% ДИ=49,41–73,99). Диагностическая точность метода – 72,52% (95% ДИ 62,80–80,49) (рис. 2).
В дальнейшем, в зависимости от значений ИМТ, пациентки были разделены на 2 подгруппы: 1-я – с ИМТ менее 23 кг/м2, 2-я – с ИМТ от 23 до 24,9 кг/м2. Метаболический профиль пациенток 1-й подгруппы статистически значимо отличался от 2-й подгруппы по таким параметрам, как частота НТГ, гиперинсулинемии и ИР, что свидетельствует о значимости точки отсечения ИМТ 23 кг/м2 в оценке риска метаболических нарушений (табл. 2).
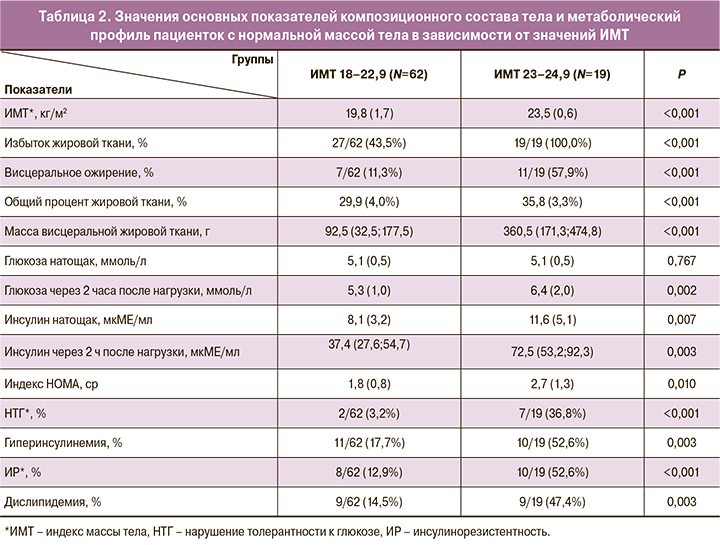
При ИМТ более 23 кг/м2 избыток жировой ткани присутствовал у 19/19 (100%) пациенток, в то время как при ИМТ<23 кг/м2 – у 27/62 (43,5%). Висцеральное ожирение было диагностировано у 7/62 (11,3%) пациенток 1-й подгруппы и у 11/19 (57,9%) 2-й подгруппы. У пациенток с ИМТ<23 кг/м2 НТГ отмечалось только в 2/62 (3,2%) случаев, при его значении ≥23 кг/м2 – в 11,5 раз чаще: 7/19 (36,8%). По сравнению с 1-й подгруппой, во 2-й подгруппе риск развития НТГ был более чем в 11 раз выше, ОР=11,42 (ДИ 2,59–50,43), риск ИР – в 4 раза выше, ОР=4,08 (ДИ 1,88–8,85), риск дислипидемии и гиперинсулинемии – в 3 раза выше, ОР 3,26 (ДИ=1,51–7,03) и ОР=2,97 (ДИ=1,5–5,88) соответственно. Это свидетельствует о значимости нового порога отсечки ИМТ.
Обсуждение
СПКЯ рассматривают не только как основную причину эндокринного бесплодия и клинической гиперандрогении, но и как метаболический репродуктивный синдром, в связи с чем в комплекс обследования входит оценка ИМТ и показателей липидного и углеводного обмена. Хорошо известно, что СПКЯ часто ассоциируется с ИР, гиперинсулинемией и повышенным риском НТГ и сахарного диабета 2 типа [21, 22]. В проведенном исследовании у каждой 3-й пациентки была выявлена ИР, гиперинсулинемия и дислипидемия, что согласуется с данными публикаций, где частота ожирения у пациенток была схожей [23].
Оценка композиционного состава тела пациенток с СПКЯ представлена лишь в небольшом числе научных публикаций, в которых использовались различные методы (УЗИ, биоимпедансный анализ, МРТ, денситометрия), что отразилось в неоднозначности полученных результатов. В некоторых исследованиях указывается на повышение процента общей жировой ткани, количества жировой ткани в абдоминальном регионе или увеличение соотношения жировой ткани области туловища и конечностей у пациенток с СПКЯ по сравнению с контрольной группой [24–28]. Тем не менее есть исследование, в котором денситометрия не позволила выявить различий композиционного состава тела [29].
Согласно данным проведенного исследования, избыточная масса тела и ожирение, рассчитанные по ИМТ, наблюдались только у 48/129 (37,2%) пациенток, тогда как избыток общей жировой ткани по денситометрии был диагностирован в 2 раза чаще – у 95/129 (73,6%) пациенток, из которых 65/95 (68,4%) имели висцеральное ожирение. Это свидетельствует о том, что расчет ИМТ недостаточно отражает избыток жировой ткани, который является основой для формирования и прогрессирования метаболических нарушений.
Изучение метаболического статуса пациенток показало, что пациентки с ИМТ<25 кг/м2 имели высокую частоту метаболических нарушений. Показатели частоты ИР и гиперинсулинемии при нормальном ИМТ составили 16/81 (19,8%) и 19/81 (23,5%,) и не отличались от таковых в группе с избыточной массой тела (10/29 (34,5%), p=0,110 и 11/29 (37,9%,), p=0,134). Частота НТГ также значимо не отличалась при нормальной и избыточной массе тела (8/81 (9,9%) и 6/29 (20,7%) соответственно, р=0,134).
Известно, что основным фактором риска развития ИР является избыток жировой ткани, который может наблюдаться и при нормальной массе тела [30, 31]. Еще в 1981 г. Ruderman et al. выявили когорту пациентов с обменными нарушениями при нормальном ИМТ и предложили термин «метаболическое ожирение при нормальном весе» (metabolically obese normal weight) [12]. Критериев диагностики данного состояния до настоящего времени нет, большинство таких пациентов имеют ИР и избыток жировой ткани [30].
По результатам денситометрии было выявлено, что избыток общей жировой ткани присутствовал у 46/81 (56,8%) пациенток с нормальным ИМТ. Средний показатель процента общей жировой ткани при этом составил 35,4 (6,9)% и был ниже, чем в исследовании Hestiantoro A. et al., где он достиг уровня 39,38%. Однако следует отметить, что в это исследование были включены пациентки с более высоким ИМТ по сравнению с данным (29,1 (5,1) кг/м2 и 23,8 (4,8) кг/м2) [32]. Полученные нами результаты согласуются с другими исследованиями, которые показали, что количество жировой ткани у пациентов с СПКЯ больше, чем среди здоровых женщин с такими же антропометрическими показателями [33, 34]. Однако в исследовании Carmina et al. не было обнаружено увеличения общей жировой ткани у пациенток с нормальной массой тела при СПКЯ, тогда как был диагностирован избыток жировой ткани области туловища, ассоциированный с ИР в 30% случаев [27]. Схожим образом в настоящем исследовании у пациенток со «скрытым ожирением» ИР была выявлена в 15/46 (32,6%) случаев, НТГ – в 8/46 (17,4%,) гиперинсулинемия и дислипидемия – в 14/46 (30,4%), что свидетельствует о негативном влиянии избытка жировой ткани на метаболический профиль. Стоит отметить, что эти показатели существенно не отличались от таковых у пациенток с избыточной массой тела, тогда как при отсутствии «скрытого ожирения» НТГ была выявлена лишь в 1 случае из 35 (2,9%), а ИР и дислипидемия встречались 3–4 раза реже. Это подтверждает большую значимость ОЖТ по сравнению с ИМТ для диагностики метаболических нарушений. Вместе с тем в клинических рекомендациях по СПКЯ указывается на необходимость проведения перорального глюкозотолерантного теста и оценки липидного профиля только у пациенток с ИМТ≥25 кг/м2 [35]. Наличие метаболических нарушений у каждой 3-й пациентки со «скрытым» ожирением дает основание для обсуждения и возможного пересмотра данной позиции с целью своевременного выявления этих состояний.
Учитывая ограниченные возможности использования денситометрии в широкой клинической практике в настоящее время, была проведена попытка определения пороговых значений ИМТ для оценки риска избытка жировой ткани и метаболических нарушений. При ИМТ>23 кг/м2 у всех больных наблюдался избыток ОЖТ. Гиперинсулинемия и дислипидемия встречались в 3 раза, а ИР – в 4 раза чаще, чем при ИМТ≤23 кг/м2, частота НТГ в первом случае была более чем в 11 раз выше, чем во втором. Следовательно, ИМТ 23 кг/м2 можно рассматривать в качестве порогового значения для диагностики избытка жировой ткани и ассоциированных с ним метаболических нарушений у пациенток с СПКЯ.
Заключение
Таким образом, каждая вторая пациентка с СПКЯ при ИМТ<25 кг/м2 имеет неблагоприятный метаболический фенотип, характеризующийся избытком жировой ткани, локализованной преимущественно в висцеральной области, который в каждом 3-м случае ассоциирован с ИР, гиперинсулинемией, дислипидемией и примерно в каждом 5-м – с НТГ. Это обосновывает включение в алгоритм обследования пациенток с СПКЯ проведение денситометрии с программами оценки композиционного состава тела и диагностики висцерального ожирения. В случае отсутствия такой возможности ИМТ более 23 кг/м2 может служить маркером избытка жировой ткани, высокого риска развития метаболических нарушений, своевременная диагностика которых является основой для модификации образа жизни и назначения терапии, направленной на снижение риска сахарного диабета 2 типа и сердечно-сосудистых заболеваний в долгосрочной перспективе.



