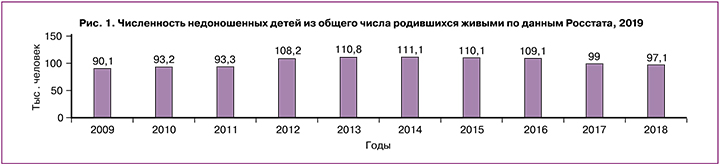
Проблема невынашивания беременности (НБ) превзошла формат акушерства, потребовав от репродуктологов, эндокринологов, гематологов, инфекционистов, генетиков и других специалистов совместных мер по сохранению фертильности женщины [1, 2]. Недостаточные знания этиопатогенеза НБ объясняют неудачи прогнозирования, профилактики, своевременной диагностики, лечения. Привычная потеря беременности, отягощая репродуктивный анамнез, многократно усугубляет проблему и препятствует реализации фертильности [3, 4]. Частота самопроизвольных выкидышей в мире при клинически верифицированной беременности достигает 20% [2], преждевременных родов (ПР) – 18% [5], в среднем составляет 10,6%, или 14,84 млн (12,65–16,73 млн) живорождений [6]. В России число недоношенных детей, родившихся живыми в период 2009–2018 гг., составило 90,1–111,1 тыс., но с 2014 г. отмечена тенденция к его снижению (рис. 1) [7].
Результатом ПР являются обусловленные недоношенностью неонатальная заболеваемость и смертность, риски долгосрочных тяжелых осложнений для ребенка (гипертония, сердечно-сосудистые и цереброваскулярные заболевания, сахарный диабет 2 типа, хроническое заболевание почек, астма и нарушения функции легких, нейрокогнитивные расстройства др.), которые остаются крайне актуальной междисциплинарной и социальной проблемой [8, 9]. Одна из целей развития тысячелетия ВОЗ – снижение на две трети уровня смертности детей в возрасте до 5 лет – во всем мире далека от реализации [10]. Несмотря на отмеченный в период 1990–2015 гг. прогресс в выживаемости детей, в 2015 г. 2,7 из 5,9 млн случаев смерти детей в возрасте до 5 лет произошли в период новорожденности, 1055 млн – вследствие осложнений ПР.
Непредотвратимость ПР зачастую обусловлена сложностью идентификации женщин с риском ПР [11]. Потенциальным предшественником ПР признана истмико-цервикальная недостаточность (ИЦН) – укорочение длины шейки матки (ШМ) менее 25 мм [12–18] и/или дилатация цервикального канала более 10 мм (на всем протяжении) [12] ранее 37 недель беременности без клинической картины ПР [12–18]. Дефиниции ИЦН не исключают укорочение ШМ менее 25 мм в сроке беременности ранее 27 недель, как единственный маркер ИЦН [15].
Единые эпидемиологические сведения о частоте ИЦН и, тем более, ее генезе, используемых методах коррекции, их эффективности в профилактике ПР отсутствуют. Согласно разрозненным сведениям, ИЦН выявляется в 0,5% общей акушерской популяции [19], составляет 1% числа всех беременностей [20], 8% [15] или 20% спонтанных потерь беременность во II триместре [19, 20]. Исследование популяционного масштаба, проведенное в 2004–2013 гг. в Австралии [21], выявило рост не только частоты ПР в сроке беременности 20–27 недель (коэффициент линейной регрессии R=0,68; p=0,03) и 28–31 недель (R=0,7; p=0,002) и особенно 35 лет и старше (R=0,99; p<0,005).
ИЦН, определенная как бессимптомное укорочение, размягчение ШМ, в клинических протоколах различных стран заявлена как предвестник ПР [12–18], подлежащий контролю. В рекомендациях Национального института здоровья и повышения квалификации в области здравоохранения Великобритании (2020) женщинам с НБ (ПР, самопроизвольным выкидышем в сроке беременности 16 недель и более) или при длине ШМ по данным трансвагинального ультразвукового исследования (УЗИ) 25 мм и менее в сроке беременности 16–24 недель показана профилактика ПР путем наложения швов на ШМ и вагинального назначения прогестерона [22]. Данная мера представлена как универсальная, и поправок на вероятные этиопатогенетические причины ПР нет.
Патогенез ИЦН, как и ПР в целом, окончательно не изучен [13], разнороден [12], не исключена идиопатическая ИЦН [15]. В современных клинических протоколах выделяют не конкретные причины ИЦН, а ее факторы риска. В зарубежных руководствах основными факторами риска ИЦН признаны привычная потеря беременности во II триместре [15, 18], преждевременный разрыв плодных оболочек в сроке беременности менее 27 недель [18] или 32 недель [15, 17] в анамнезе, травма ШМ, врожденные аномалии матки или аномалии развития соединительной ткани (например, синдром Элерса–Данлоса) [12–18], перенесенное внутриутробное воздействие диэтилстильбестрола [13, 15, 18], длина ШМ менее 25 мм до 27 недель беременности. Только в отечественном протоколе [12] выделено 7 групп факторов риска ИЦН (функциональные, анатомические, особенности настоящей беременности, генетические и врожденные, экстрагенитальные, особенности акушерско-гинекологического анамнеза, инфекционно-воспалительные и дисбиотические состояния), первостепенным из которых признана гиперандрогения (ГА) как яичникового (синдром поликистозных яичников (СПКЯ)), так и надпочечникового (адреногенитальный синдром) генеза. В отечественной балльной шкале оценки ИЦН [23] ГА во время беременности, наравне с данными трансвагинальной эхографии (расположение ШМ и предлежащей части плода, длина ШМ и раскрытие внутреннего зева) и анамнеза (перенесенный поздний самопроизвольный выкидыш/ИЦН), признана отдельным признаком, оцениваемым в 2 балла, когда сумма баллов 5–6 и более требует коррекции ИЦН. К сожалению, сведений о частоте ГА различного генеза у женщин с ИЦН, способах и эффективности ее коррекции в широком доступе не найдено. В зарубежных публикациях отражена роль андрогенов и ГА в развитии кардиоваскулярных заболеваний и бесплодия [24], особенностях течения беременности и родоразрешении [25], метаболизме матери, функции плаценты и росте плода [26], сосудистых и плацентарных изменениях, значимых в патогенезе преэклампсии [27], гипертензии и дисбактериозе кишечника [28], репродуктивных потерях [29].
В отечественных рекомендациях «СПКЯ в репродуктивном возрасте (современные подходы к диагностике и лечению)» (2015) [30] со ссылкой на «Консенсус по аспектам здоровья женщин при СПКЯ: 3-я консенсусная рабочая группа СПКЯ при поддержке ESHRE/ASRM в Амстердаме» [31] отмечено, что женщины с СПКЯ представляют собой группу риска по развитию неблагоприятных исходов беременности, и при наличии только клинической или биохимической ГА и олиго/ановуляции (критерии Национального Института здоровья, 1990) риск осложненного течения беременности выше. Тем не менее при СПКЯ отрицается увеличение частоты выкидышей при естественной концепции как при наличии, так и отсутствии ожирения, сопоставимой доле женщин с НБ после индукции овуляции с таковым при других формах бесплодия.
СПКЯ рассматривается как фактор риска НБ, обусловленного ГА в сочетании с инсулинорезистентностью [29], ПР; подчеркивается роль ГА в ремоделировании ШМ [25, 32]. Более того, ГА матери сопряжена не только с риском ПР и недоношенностью, но и с потенциальным ущербом программирования развития плода/ребенка в будущем (вирилизацией, задержкой и дефектами развития плода, формированием кардиоваскулярных дефектов, репродуктивной, метаболической дисфункцией, поведенческим дефицитом) (рис. 2) [33].
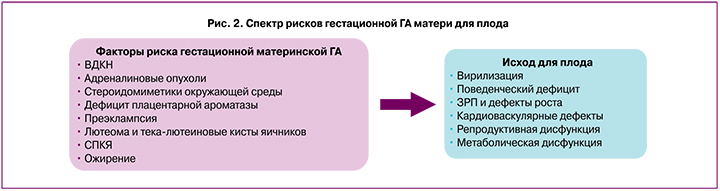
Основными потенциальными причинами ГА являются СПКЯ, врожденная дисфункция коры надпочечников (ВДКН), опухоли надпочечников и расовые особенности. Дополнительными гестационными причинами ГА являются лютеома и тека-лютеиновые кисты яичников, дефицит плацентарной ароматазы и плодовая ВДКН [33].
Различный генез обусловленных ГА внегестационных и гестационных нарушений в организме женщины определил разнонаправленные исследования во всем мире [28, 29, 32–35]. Данных, подтверждающих и обосновывающих роль ГА в генезе ИЦН крайне мало, и они акцентированы либо только на поликистозных яичниках [36], либо на ожирении [37, 38]. Только в Канадском клиническом протоколе по ИЦН поликистозные яичники рассматриваются как самостоятельный фактор риска, особенно у южноазиатских или чернокожих женщин [15].
Отдельного внимания в оценке рисков ИЦН заслуживает ожирение, роль которого неоднозначна. По аналогии с прогнозируемым для спонтанных ПР изменением уровня цитокинов в цервико-вагинальной жидкости у женщин с бессимптомным течением беременности во II триместре, связанным с воспалением, преобладанием анаэробов (Bacteroides, Fusobacterium, Mobiluncus) [39], Zaher Y.A. et al. (2019) [40] обнаружили положительную корреляцию между уровнем цервико-вагинальных цитокинов (фактора некроза опухолей-α (TNF-α) и интерлейкинов (IL) -6 и -10) и индексом массы тела (ИМТ) женщины (соответственно r=0,303, p=0,005; r=0,285, p=0,008; r=0,247, p=0,023), особенно при наличии ПР в анамнезе. Наложение швов на ШМ (по МакДональду) сопровождалось значительным снижением уровня цитокинов, демонстрируя дополнительную к механической иммунологическую составляющую предотвращения ПР.
Рассматривая ожирение и ИЦН как самостоятельные причины заболеваемости во время беременности, Venkatesh K.K. et al. (2017) [41] оценили взаимосвязь между ИМТ и длиной ШМ во II триместре беременности. Медиана длины ШМ составила 3,6 см, медиана ИМТ всей исследуемой когорты женщин – 24,8 кг/м2. Женщины с избыточным весом (скорректированное отношение шансов (ОШ)=2,18; 95% ДИ 1,20–3,96) и ожирением (скорректированное ОШ=2,83; 95% ДИ 1,47–5,43) в 2 раза чаще имели длину ШМ > 75-й перцентили, а увеличению ИМТ на 1,0 кг/м2 соответствовало увеличение длины ШМ на 0,25 мм. Таким образом, для ожирения оказалась характерна большая длина ШМ. Исследований, посвященных оценке длины ШМ, рискам развития ИЦН при ожирении, связанном с ГА в том числе, не найдено.
Связь между ожирением и связанными с ним рисками перенашивания беременности вносит разногласия в оценку эффективности хирургической коррекции ИЦН. Согласно обсервационному когортному исследованию Kandeel M.S. et al. (2014) [37], проведенному в Египте, включавшему первобеременных с одним плодом в сроке беременности 20–22 недель и более, ПР были характерны для женщин с дефицитом веса, а для женщин с избытком веса или ожирением – перенашивание беременности.
Prodromidou A., Frountzas M. в 2016 г. [38] представили систематический обзор литературных источников, обнаруженных с 1966 г. в базах данных Medline (1966–2015), Scopus (2004–2015), Popline (1974–2015) и Clinical Trials.gov (2008–2015). В анализ включались беременные с цервикальным серкляжем и ожирением (ИМТ>30 кг/м2, n=210) или морбидным ожирением (ИМТ>40 кг/м2, n=47). Не установлено связи между ожирением и сроком беременности при родоразрешении, значимого влияния на эффективность цервикального серкляжа.
Более детальный анализ эффективности хирургической коррекции ИЦН у женщин с ожирением (ИМТ≥30 кг/м2) и без него (контроль) представили Gill L. et al. (2018) [42]. Сравнивались два метода наложения швов на ШМ – по Широдкару и МакДональду. Значительного различия срока беременности при родоразрешении у женщин с ожирением и в группе контроля не выявлено (соответственно 33 и 34,33 недели, p=0,14). Ожирение не повышало риск ПР в сравнении с группой контроля, но наложение серкляжа по Широдкару было сопряжено с повышением риска ПР (ОШ=4,29; 95% ДИ 1,14–16,2), по методике МакДональда – нет.
Очевидно, что за последние десятилетия значительно модернизировались возможности наложения цервикального серкляжа вагинальным, лапароскопическим, лапаротомическим доступом при наличии условий и показаний [12, 43], в том числе при многоплодной беременности [44, 45], пролабировании плодного пузыря [46]. Для подбора безопасной и эффективной силы натяжения нити при наложении серкляжа, определения механических ограничений используется ресурс 3D-моделирования синтетической ШМ [47]. Данные исследования не учитывают нарушений в организме женщины, влияющих на качество и функцию соединительнотканных волокон ШМ. Хотя более 10 лет назад отечественные исследователи обнаружили связь между ГА различного генеза и особенностями коллагенообразования [48]. Установлено, что на состояние коллагеновых волокон, интенсивность синтеза фибробластов воздействуют наследственные, гормональные изменения. При СПКЯ сочетание ГА и гиперэстрогении благоприятствует метаболизму соединительной ткани. Тестостерон наравне с эстрогенами способствует повышенному коллагенообразованию, оказывает стимулирующее влияние на фибробласты. Отличием ГА надпочечникового генеза является повышение секреции андрогенов в сочетании с гипоэстрогенией, что сопряжено с преобладанием процессов разрушения коллагена. 17-оксипрогестерон, секретируемый надпочечниками, способен опосредованно через глюкокортикоидный эффект усиливать разрушение коллагена, что подтверждается угнетением пролиферации фибробластов и усиленным распадом коллагена при лечении ВДКН и назначении дексаметазона или метипреда. Иными словами, женщины с ГА надпочечникового генеза находятся в состоянии хронического коллагеноразрушения [48]. Известны также андрогензависимые дермопатии у женщин [49].
Данные сведения крайне актуальны при изучении ИЦН, так как в «Клинических рекомендациях Российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани (ДСТ)» (2016) [50] указано, что частота ИЦН в популяции не превышает 13,6%, а у пациенток с ДСТ ее признаки различной степени выраженности выявляются у 65–70% женщин. Современные исследования [51] расширили данные представления. Показано, что для женщин с признаками ДСТ при наличии клинических проявлений ГА особенно характерно повышение уровня IgE в 1,5 раза. Независимо от наличия ДСТ в репродуктивном возрасте на фоне гормональных нарушений, особенно при повышенном уровне 17-ОН-прогестерона, отмечается чрезмерный распад коллагена. Данные сведения созвучны с позицией Канадского общества акушеров-гинекологов, которые в клиническом протоколе «Цервикальная недостаточность и цервикальный серкляж № 373» (2019) [15] указали, что 85% сухого веса ШМ представлено коллагеном и что у женщин с ИЦН в анамнезе концентрация гидроксипролина в ШМ значительно ниже, чем у женщин без ИЦН. Несмотря на отсутствие знаний о причинах данного различия, оно рассматривается как ключевой фактор механизма ИЦН.
Сопряженность ИЦН с ДСТ, повышенным разрушением коллагена, усугубляемого ГА, преимущественно надпочечникового генеза, требует дифференцированных мер по ее прогнозированию, профилактике, диагностике и лечению.
Изучение триггерных механизмов ИЦН, ко-факторов, определяющих эффективность ее терапии, составляют платформу современных исследований. Влияние ГА, подразумевающей крайне разноплановый генез, ее сочетание с иными факторами (возрастом, этнической принадлежностью, весовыми характеристиками, наследственностью, местом проживания, приобретенными заболеваниями и нарушениями и т.д.), на исход беременности, риски развития ИЦН, индивидуальный подбор эффективной терапии остаются предметом востребованного изучения. Основополагающим этапом предотвращения ПР является своевременная диагностика ИЦН, которая крайне затруднительна. Если субъективное ощущение начала схваток возможно при очень ранних ПР только у 48,65% женщин, ранних ПР – у 60%, при ПР – у 78,95% [52], то асимптомность заложена в дефиницию ИЦН.
Диагностика истмико-цервикальной недостаточности
В современных клинических протоколах, определяющих тактику ведения беременности при ИЦН, указываются ультразвуковые критерии, определяющие профилактические или лечебные меры. Критериями ИЦН признаны: длина сомкнутых стенок цервикального канала менее 25 мм, дилатация цервикального канала более 10 мм на всем протяжении [12–14, 18] или 40% воронкообразное раскрытие внутреннего зева [18]. Несмотря на возможности трансабдоминального, трансвагинального и транслабиального УЗИ, наличие ультразвуковых аппаратов экспертного класса, точные знания о длине ШМ не гарантируют предотвращение ПР. В 2019 г. Berghella V. et al. [53] обнародовали в Кокрановской базе данных систематический обзор, посвященный оценке значимости УЗИ ШМ для предотвращения ПР, основанный на 7 рандомизированных контролируемых исследованиях (РКИ), включающих 923 женщины. Не установлено повышения риска ПР у женщин с известной и неизвестной длиной ШМ (по данным УЗИ) у женщин с двойней в сроке беременности ранее 34 недель при отсутствии симптомов ПР (относительный риск (ОР)=0,62; 95% ДИ 0,30–1,25; 1 РКИ), у женщин с одноплодной беременностью, сроком беременности ранее 37 недель при наличии симптомов ПР (ОР=0,59; 95% ДИ 0,26–1,32; два РКИ) и их отсутствии (ОР=1,27; 95% ДИ 0,61–2,6). Авторы отметили ограниченность сведений о значимости ультразвуковой оценки длины ШМ для предотвращения ПР. Оказалось, что знание о длине ШМ (трансвагинальное УЗИ) у женщин с одноплодной беременностью и симптомами ПР сопряжено с возможностью продления беременности примерно на 4 дня по сравнению с женщинами, где аналогичные сведения отсутствуют.
Такого же мнения придерживаются и другие исследователи [54], утверждающие, что рутинный скрининг длины ШМ спорен и нерационален. Рассматривая ПР как многофакторную комплексную проблему, подчеркивается значимость выявления в разных популяциях факторов риска ПР (ИМТ, увеличение массы тела во время беременности, социально-демографические факторы), позволяющих подобрать соответствующие профилактические меры.
Таким образом, ИЦН, обусловленная ГА, прежде всего как известный фактор риска ПР, требует аналогичных дифференцированных подходов по прогнозированию, профилактике и лечению, сведений о чем в широком доступе крайне недостаточно.
Принимая во внимание значимость не только длины ШМ, но и ее консистенции, для оценки ИЦН нашла применение эластография [55], позволяющая на основании качественной цветовой оценки определить плотность ШМ, эластичность ее тканей и рассчитать коэффициент деформации, составить представление о внутренней жесткости исследуемого участка ШМ, прогнозировать риск НБ в сроках до 22 недель.
Учитывая значимость ГА в рисках повышенного разрушения коллагена, генезе НБ, значимым объективным методом прогнозирования и диагностики ИЦН представляется исследование стероидного профиля мочи. В 2009 г. Горячкина М.В. [56] представила убедительные данные о значимости эндокринно-гормональных нарушений в патогенезе рефрактерных форм угревой болезни у женщин, основанные на анализе стероидного профиля мочи (андростерона (An), этиохоланолона (Et), дегидроэпиандростерона (DHIEA), 11 - кетоандростерона (11-Keto-An), 11-кетоэтиохоланолона (11-Keto-Et), 11-В-кетогидроксиандростерона (11-OH-Keto-An), 11-гидроксиэтиохоланолона (11-OH-Keto-Et), Pt, холестерина (Ch), их соотношения), более информативного, чем оценка гормонов крови. У 100% женщин исследуемой когорты обнаружено повышение уровня Аn, главного метаболита тестостерона, у 51,1% – Еt, DHIEA – у 45,5% пациенток, 11-Keto-An – у 6,7% и 11-OH-Keto-Et – у 18,9% женщин. Рагимова З.З. (2008) [57] при оценке клинических проявлений ГА отметила в стероидном профиле мочи преобладание метаболитов андрогенов яичникового происхождения над метаболитами андрогенов надпочечникового происхождения, отсутствие изолированной надпочечниковой ГА, только сочетание с яичниковой, доказывая вторичный характер яичниковой ГА. Оценка стероидного профиля мочи по информативности конкурировала с малой дексаметазоновой пробой.
Шафигуллина З.Р. и соавт. (2015) [58] представили результаты исследования стероидного профиля больных c синдромом Иценко–Кушинга, в которых были дифференцированы диагностические критерии: повышение свободного кортизола в слюне (>14 нмоль/л), уровней кортизола, кортикостерона и 11-дезоксикортизола в крови, экскреции с мочой свободного кортизола и кортизона, метаболитов глюкокортикоидных гормонов и соотношений свободный кортизол (UFF)/кортизон (UFE), тетрагидрокортизол (TНF)/тетрагидрокортизон (THE), (TНF+alloTHF)/ТНЕ, снижение соотношений alloTНF/TНF и гидроксикортизол (6β-ОНF)/UFF.
Ворохобина Н.В. и соавт. (2016) [59] представили особенности метаболизма стероидных гормонов в репродуктивном возрасте у женщин с ГА (неклассической формой ВДКН с дефектом 21-гидроксилазы (14,8%), СПКЯ (33,3%), синдромом ГА при наличии ожирения (31,5%), идиопатической ГА (20,4%), применяя методы газовой хромато-масс-спектрометрии и высокоэффективной жидкостной хроматографии. У женщин с неклассической формой ВДКН с дефектом 21-гидроксилазы установлено снижение соотношений кортизол/кортизон и кортикостерон/11-дегидрокортикостерон в крови, (THE+THF+allo-THF)/прегнантриолон (меньше 30) и (THE+THF+allo-THF)/прегнантриол (меньше 3,0), увеличение экскреции с мочой DHIEA, 16-кето-андростендиола, прегнантриолона, 21-дезокситетрагидрокортизола и неклассических 5-ен-прегненов. У женщин с СПКЯ отмечено уменьшение активности 11β-гидроксистеро-иддегидрогеназы 1 типа и увеличение активности 5α-редуктазы. Ожирение в сочетании с СПКЯ сопровождалось увеличением экскреции свободного кортизона и метаболитов Δ4-андростендиона с мочой, ожирение в сочетании с синдром ГА – свободного кортизола, свободного кортизона, метаболитов глюкокортикоидов и DHIEA. Следовательно, анализ стероидного профиля мочи представляется уникальным методом ранней дифференциальной диагностики генеза ГА при беременности, необходимой для выбора эффективных мер профилактики ИЦН и своевременной коррекции. Тем более что наличие ИЦН у женщин с ГА демонстрирует несвоевременную диагностику процессов, обусловивших ее, неудачу или отсутствие профилактических мер.
Несмотря на то что современные исследователи [16, 60], клинические протоколы всех стран [12–18] декларируют 3 пути коррекции ИЦН: консервативный, медикаментозный и хирургический, дифференцирующих подходов с учетом ГА нет, как и при ведении самопроизвольных выкидышей. Имеются отдельные исследования [61], где указывается необходимость назначения прогестерона при сопряженной с ГА ИЦН. Оптимальных сроков для назначения препаратов прогестерона для эффективной профилактики ИЦН вследствие ГА, тем более в зависимости от ее генеза, нет. А ведь назначение прогестерона по эффективности не уступает наложению серкляжа. По данным Conde-Agudelo A., Romero R. et al. (2018) [62], при одноплодной беременности вагинальное введение прогестерона в сравнении с плацебо значительно снижало частоту ПР в сроках беременности <35 и <32 недель, перинатальную заболеваемость/смертность, неонатальный сепсис, неонатальную заболеваемость, пребывание в отделении интенсивной терапии. Серкляж в сравнении с его отсутствием значительно снижал частоту ПР в сроках беременности <37, <35, <32 и <28 недель, перинатальную заболеваемость/смертность, рождение плодов с весом <1500 г. Применение вагинального прогестерона и серкляжа одинаково эффективно для предотвращения ПР и улучшения перинатальных исходов у женщин с одноплодной беременностью, спонтанными ПР в анамнезе и сонографическими маркерами укорочения ШМ во II триместре беременности [62]. Дополнительное назначение препаратов прогестерона у женщин с привычным НБ и ИЦН на 14–36-й неделе беременности, корригированной серкляжем, предотвращает сократительную активность матки, обеспечивая пролонгирование беременности, и предпочтительным путем введения препаратов прогестерона для коррекции ИЦН является вагинальный [12–18, 60]. Учитывая широкий спектр этиологически значимых инфекционных патогенов, приводящих к развитию воспалительных заболеваний органов малого таза [63], современные исследования не представили значимой связи между вагинальным введением прогестерона и «инфекционными рисками» для вагинальной микробиоты [64].
Заключение
ИЦН является потенциальной бессимптомной фазой ПР; трудности понимания ее генеза во всем мире затрудняют своевременную диагностику и целенаправленное лечение, оставляя проблему ПР нерешенной. Несмотря на то что предложены не только клинические рекомендации по диагностике и коррекции ИЦН, но и комбинированный подход по прогнозированию ПР и патогенетический подход к коррекции ИЦН, дифференцированный прогноз, профилактика, объективная диагностика, выбор метода коррекции ИЦН при ГА различного генеза остаются недостаточно изученными во всем мире, сохраняя риски НБ.



