Дыхательные нарушения являются одной из наиболее частых причин госпитализации новорожденных в отделение реанимации и интенсивной терапии (ОРИТН) вне зависимости от их гестационного возраста (ГВ). Выяснение генеза дыхательных нарушений у недоношенных новорожденных представляет значительные сложности ввиду неспецифического характера выявляемых симптомов, а также отсутствия надежных лабораторных маркеров синдрома системного воспалительного ответа у недоношенных детей с выраженной морфофункциональной зрелостью. В то же время от точности и своевременности диагностики причин дыхательных нарушений зависит эффективность лечения. Определение цитокинового статуса недоношенных новорожденных может быть полезным в плане дифференциальной диагностики причины выявляемых дыхательных нарушений.
Несмотря на то что изучению уровня цитокинов у новорожденных детей различного ГВ был посвящен ряд ранее опубликованных исследований [1–5], динамика их концентрации в раннем неонатальном периоде при различных перинатальных заболеваниях остается сравнительно мало изученной.
Цель исследования: оценка динамики уровня цитокинов в плазме крови недоношенных новорожденных с дыхательными нарушениями инфекционного и неинфекционного генеза в раннем неонатальном периоде.
Материалы и методы
В исследование были включены 105 новорожденных детей, родившихся в ФГБУ «НМИЦ АГП им. В.И. Кулакова Минздрава России» в период с января 2019 г. по ноябрь 2019 г. Основную группу, составили 92 недоношенных ребенка ГВ 32–36 недель, поступившие в 1-е сутки жизни для обследования и лечения в ОРИТН.
В зависимости от причины дыхательных расстройств дети основной группы были разделены на 3 подгруппы: РДС – дети с респираторным дистресс- синдромом (n=21), ТТН – дети с транзиторным тахипноэ новорожденных (n=28) и ВП – дети с врожденной пневмонией (n=43). Группу контроля составили 13 ранних здоровых доношенных детей ГВ 37 недель. Критериями исключения из исследования были: синдромальная форма наследственной патологии, наличие врожденных пороков, требующих экстренной хирургической коррекции, гемолитическая болезнь новорожденных.
Перед включением в исследование родителями новорожденных было подписано добровольное информированное согласие на участие детей в исследовании. Данное исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Всем новорожденным основной группы с целью выявления/исключения реализации врожденной инфекции проводилось стандартное клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса (НИ), контроль уровня белков острой фазы воспаления (С-реактивный белок, СРБ). По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни ребенка делалось заключение о наличии или отсутствии врожденной инфекции. Спектр инфекционной патологии был представлен исключительно ВП; иных очагов инфекции в изучаемой группе детей не было. Бактериальных, грибковых и вирусных возбудителей при исследовании стерильных локусов (кровь, аспират из трахеи) выявлено не было.
Дифференциальная диагностика между ВП, РДС и ТТН проводилась в соответствии с клиническими рекомендациями [6, 7].
Цитокиновый профиль плазмы периферической крови новорожденных указанных групп исследовался на 1-е и 7-е сутки жизни. Взятие образцов венозной крови (ВК) осуществлялось в пробирки с антикоагулянтом (ЭДТА) в 1-е сутки жизни одновременно с проведением обязательного клинико-лабораторного обследования при поступлении новорожденных в ОРИТН до начала специфической терапии и в динамике повторно на 7-е сутки жизни также одновременно с проведением стандартного клинико-лабораторного обследования. Взятие образцов ВК у детей контрольной группы осуществлялось в 1-е сутки жизни до начала энтерального питания.
Определение содержания цитокинов осуществлялось мультиплексным методом на анализаторе Bioplex 200 (Bio-Rad, США) с использованием коммерческого набора Bio-Plex ProHuman Cytokine 17-plex Assay (Bio-Rad, США). Оценивали содержание следующих цитокинов, которые принято подразделять на провоспалительные (интерферон гамма (IFN-γ), фактор некроза опухоли альфа (TNF-α), интерлейкины (IL-1β, IL-2, IL-5, IL-6, IL-12, IL-17)), противовоспалительные (IL-4, IL-10, IL-13), хемокины (IL-8, моноцитарный хемотаксический фактор-1 (MCP-1), макрофагальный белок воспаления 1β (MIP-1β)) и ростовые факторы (IL-7, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)). Согласно инструкции производителя тест-системы компании Bio-Rad, для приготовления образцов ЭДТА-плазмы применяли двукратное центрифугирование образцов периферической крови при 1000 g в течение 15 минут при 4°С и 10 000 g в течение 10 минут при 4°С для полного удаления тромбоцитов и осадков. Образцы плазмы замораживали и хранили до момента проведения анализа при температуре -80°С.
Статистический анализ
Статистическую обработку результатов исследования проводили стандартными методами с помощью пакета статистического анализа для Microsoft Office, Excel 2007, MedCalc12 для Windows 7, а также IBM SPSS Statistics version 23 (США). Проверку нормальности распределения оценивали с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса, Шапиро–Уилка, а также показателей эксцесса и асимметрии.
Во всех подгруппах отмечалось распределение, отличное от нормального, для выявления статистической значимости различий сначала использовали непараметрический критерий Краскела–Уоллиса, далее (при получении статистической значимости) – попарные сравнения нескольких групп (U-критерий Манна–Уитни с поправкой Бонферрони на множественные сравнения). Результаты представлены как медиана (Ме) и интерквартильный размах 25–75-й процентили (Q1–Q3). Принимая во внимание специфику групп пациентов (новорожденные дети в ОРИТН), в частности, значительные отличия массо-ростовых показателей, а также практическую направленность исследования, с целью более детальной клинической характеристики групп мы приводим минимальное (min) и максимальное (max) значения для каждого признака [min–max]. Различия считали статистически значимыми при уровне значимости p<0,05. При анализе номинальных переменных (частоты) применялись критерий χ2 Пирсона с поправкой Йейтса, и точный критерий Фишера при малом количестве наблюдений. Для оценки динамики показателей (сравнение связанных совокупностей с повторными измерениями на 1-е и 7-е сутки жизни) использовался критерий Уилкоксона.
Результаты и обсуждение
Клиническая характеристика обследованных новорожденных представлена в таблице 1.

Дети основной группы заведомо статистически значимо отличались от группы контроля по ГВ, массе тела при рождении и оценкам по шкале Апгар на 1-й и 5-й минутах. Распределение по полу в основных группах и подгруппах было одинаковым. Выявленные различия между подгруппами, приведенные в таблице 1, обусловлены общепопуляционными данными частоты встречаемости выделенных нозологий у детей различного гестационного возраста [8]. Значимых отличий между подгруппами, в том числе по частоте проведения антенатальной стероидной профилактики РДС, выявлено не было.
Все дети основной группы нуждались в проведении респираторной терапии. Неинвазивная респираторная терапия проводилась с помощью трех методик – СРАР (спонтанное дыхание с постоянным положительным давлением в дыхательных путях) с помощью аппарата Infant Flow и через высокопоточные канюли, неинвазивная искусственная вентиляция легких (ИВЛ). Неинвазивная респираторная терапия была абсолютно эффективна у всех детей из подгруппы ТТН, и им не потребовалось проведение традиционной или высокочастотной осцилляторной вентиляции (ВЧОВЛ). У новорожденных с диагнозом ВП по сравнению с детьми других подгрупп отмечалась наиболее высокая потребность в проведении интубации с последующей традиционной ИВЛ и/или ВЧОВЛ (28% и 42% соответственно, p=0,002).
Антибактериальная терапия при подозрении на реализацию инфекционно-воспалительных заболеваний (ИВЗ) проводилась 13/21 (62%) детям в подгруппе РДС и 8/28 (28,5%) – в подгруппе ТТН до момента уточнения клинического диагноза с последующей ее отменой; все новорожденные с диагнозом ВП получали антибактериальную терапию с рождения двумя препаратами широкого спектра действия (ампициллин и гентамицин) (р=0,002).
Основные осложнения неонатального периода у недоношенных новорожденных были представлены развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС), внутрижелудочковых кровоизлияний (ВЖК) различной степени тяжести. Частота ВЖК составила 9,5, 10,7 и 14% в подгруппах РДС, ТТН и ВП соответственно (р=0,85). Развитие ДВС-синдрома регистрировалось у новорожденных с ВП в 23% случаев (10/43) по сравнению с 9,5% (2/21) в подгруппе РДС и 3,5% (1/28) – в подгруппе ТТН (р=0,053). Летальный исход отмечен в одном случае у недоношенного ребенка ГВ 33 недели с тяжелым течением ВП.
В данной работе представлен анализ содержания только тех цитокинов из вышеприведенного списка, изменения в динамике наблюдения которых были выявлены: это провоспалительный цитокин IL-6, хемокины IL-8, МCP-1, МIР-1β и противовоспалительный цитокин IL-10. Сопоставление концентраций IFN-γ, TNF-α, IL-1β, IL-2, IL-5, IL-12, IL-17, IL-4, IL-13, IL-7, G-CSF, GM-CSF не выявило статистически значимых различий между группами.
Данные о концентрациях провоспалительных цитокинов (IL-6, IL-8, МCP-1, МIР-1β) и противовоспалительного IL-10 в периферической ВК недоношенных детей с РДС, ТТН и ВП в 1-е и 7-е сутки жизни представлены в таблицах 2 и 3.
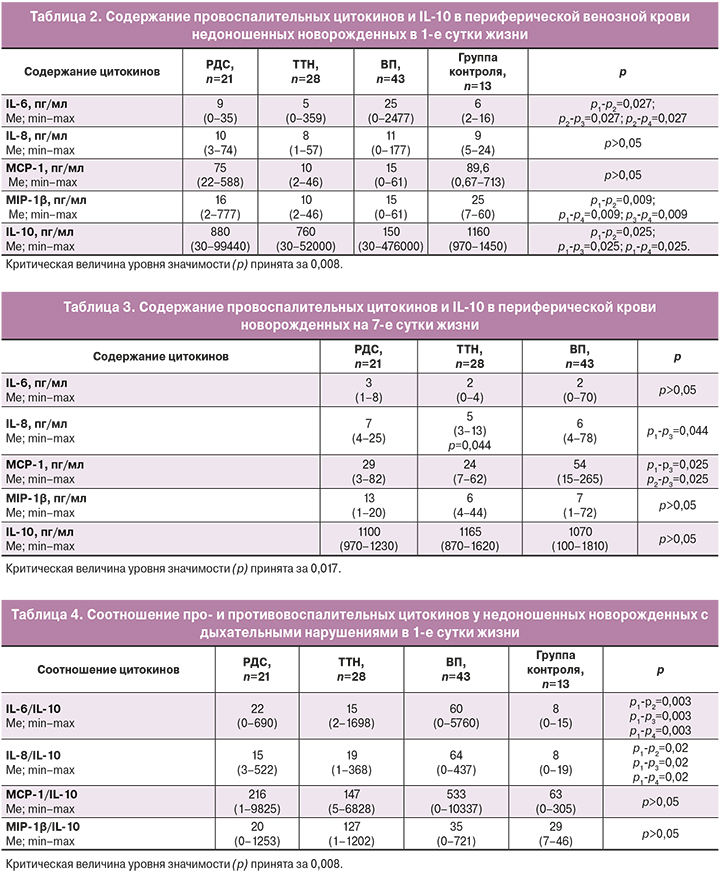
Содержание IL-6 в плазме крови детей с ВП в 1-е сутки жизни было значительно выше, чем у детей контрольной группы и недоношенных новорожденных без инфекционного диагноза (подгруппы РДС и ТТН). Далее этот показатель снижался, и к 7-м суткам различий в содержании IL-6 между группами установлено не было. Также отмечено более низкое содержание МIP-1β у недоношенных детей по сравнению с таковым у детей контрольной группы. Также были выявлены статистически значимые различия в содержании противовоспалительного IL-10, при этом максимальная разница цифровых значений отмечена между детьми с ВП и группой контроля на 1-е сутки жизни.
При оценке динамики уровня цитокинов и хемокинов в подгруппах недоношенных детей на 7-е сутки жизни основные различия были отмечены для IL-6, MCP-1, МIP-1β, IL-10 (табл. 3).
Цитокиновый профиль ВК у детей с ВП отличался от такового у детей с неинфекционным генезом дыхательных нарушений и характеризовался отчетливым снижением уровней IL-6, MCP-1 и повышением содержания IL-10 и МIP-1β на фоне проводимого лечения (рисунок). Следует отметить, что снижение IL-6 у детей с ВП происходило до тех же значений, что и при РДС, ТТН, однако уровень MCP-1 оставался более высоким и на 7-е сутки при ВП по сравнению с таковым в подгруппах неинфекционного генеза дыхательных нарушений (р=0,025).
К концу раннего неонатального периода на фоне проведения лечения статистически значимые различия уровня IL-10 между подгруппами нивелировались, что может косвенно характеризовать эффективность специфической терапии и восстановление баланса цитокинов.
Для оценки динамики уровня цитокинов внутри подгрупп (РДС, ТТН и ВП) проведено сравнение уровней цитокинов на 7-е сутки с их исходным уровнем на 1-е сутки жизни отдельно для каждой подгруппы. Статистическая значимость была выявлена только для IL-6 и MCP-1 у детей с ВП (p<0,001 и р=0,006 соответственно) и IL-6 у детей с РДС, который снижался на 7-е сутки жизни по сравнению с исходным (р=0,026).
IL-6, IL-8, IFN-γ, TNF-α, MCP-1 и MIP-1β являются маркерами провоспалительной направленности иммунных реакций организма. Чтобы оценить динамику баланса провоспалительных и противовоспалительных цитокинов в клинической практике, как правило, используется определение их соотношений с IL-10, которые представлены в таблицах 4 и 5.

При анализе данного показателя сохраняется преобладание провоспалительной направленности иммунных реакций у новорожденных с ВП по сравнению с детьми из подгрупп РДС и ТТН (медиана соотношения IL-6/IL-10=60, IL-8/IL-10=64 против IL-6/IL-10=22, IL-8/IL-10=15 против IL-6/IL-10=15, IL-8/IL-10=19 соответственно, р=0,003, р=0,002). При этом в возрасте 1-х суток жизни обращает на себя внимание повышение как концентрации IL-6, так и его соотношения с IL-10, что не регистрировалось на 7-е сутки жизни. Такая динамика, вероятнее всего, свидетельствует о восстановлении баланса между про- и противовоспалительными цитокинами. Однако статистически значимое различие в показателях IL-8/IL-10 между подгруппами детей с РДС и ВП сохраняется и на 7-е сутки.
Различий концентраций TNF-α, IFN-γ, а также соотношений TNF-α/IL-10 и IFN-γ/IL-10 между группами и подгруппами ни в 1-е, ни на 7-е сутки жизни обнаружено не было.
Обсуждение
Полученные нами результаты подтверждают данные ранее опубликованных исследований. Подавляющее большинство работ отмечает ценность IL-6 в диагностике ИВЗ у новорожденных детей. Данный цитокин вырабатывается различными типами клеток, включая фибробласты, кератиноциты, эндотелиальные клетки сосудов, тучные клетки, макрофаги, дендритные клетки, а также Т- и В-клетки [9] в ответ на повреждение тканей и/или воздействие инфекции [10]. После взаимодействия со специфическими рецепторами IL-6 запускает каскад сигнальных реакций, в основном связанных с путем активации JAK/STAT3 [11], который, в свою очередь, способствует транскрипции генов, запускающих различные сигнальные пути и в итоге продукцию других цитокинов с различными медиаторными функциями. IL-6 также контролирует синтез белков, участвующих в регуляции экспрессии генов иммунного ответа [12]. Такое масштабное взаимодействие с различными сигнальными молекулами и зависимость экспрессии нескольких генов от активности IL-6, по мнению многих авторов, обусловливает плейотропную природу этого IL. В результате продукции IL-6 происходит стимуляция как про-, так и противовоспалительных звеньев иммунного ответа [13], обеспечивая, таким образом, не только провоспалительное, но и регуляторное действие. IL-6 контролирует дифференцировку моноцитов в макрофаги, повышает продукцию B-клеточного IgG [14].
Было показано, что IL-6 является не менее значимым, а в ряде случаев и более ранним маркером неонатальной инфекции и сепсиса, чем СРБ [1, 15]. В исследовании Leal et al., включавшем 96 новорожденных различного ГВ (от 27 до 42 недель), было выявлено, что повышение IL-6 происходит как при раннем, так и при позднем неонатальном сепсисе [1].
Повышение провоспалительных цитокинов, в частности IL-6, описано и при повреждении легких неинфекционного генеза, РДС и бронхо-легочной дисплазии (БЛД) [2, 16]. Однако стоит отметить две основных особенности исследований цитокинового профиля при РДС: 1) большая их часть проведена в период 2000–2010 гг. и 2) основную группу чаще всего составляли глубоконедоношенные новорожденные. Цитокиновый ответ у этой когорты обусловлен асептическим воспалением, возникающим в результате воздействия нескольких повреждающих факторов на незрелые легкие: дефицитом сурфактанта, коллапсом и повреждением альвеол, пропотеванием белков плазмы крови в альвеолы и ИВЛ-ассоциированным повреждением легких при замещении дыхательной функции. Стремительное развитие перинатальных и неонатальных технологий за последнее десятилетие позволило снизить частоту тяжелого ИВЛ-индуцированного повреждения легких, и случаи тяжелого течения РДС все реже стали встречаться в рутинной неонатальной практике у детей, родившихся в сроке более 32 недель гестации. В наше исследование были включены дети ГВ 32–36 недель с более высокой степенью зрелости легких и, соответственно, менее выраженным повреждением альвеол, что, по-видимому, обусловило отсутствие явной цитокиновой реакции у детей с РДС.
В данной работе продемонстрировано статистически значимое снижение уровня IL-6 к 7-м суткам жизни по мере угасания воспалительного процесса на фоне проводимого лечения у новорожденных с ВП. Однонаправленные, но менее выраженные изменения были отмечены и при неинфекционном, асептическом воспалении, запускаемом в ходе развития РДС. При течении ТТН (задержке фетальной жидкости в альвеолах) дыхательная недостаточность в подавляющем большинстве случаев была выражена умеренно, регрессировала в течение первых часов жизни и не сопровождалась выраженными колебаниями уровня IL-6.
Хемокины (хемотаксические цитокины) играют центральную роль в регулировании воспаления при различных заболеваниях, способствуя привлечению моноцитов-макрофагов, лимфоцитов, эозинофилов и базофилов в очаг воспаления. MIP-1β являются одними из ключевых белков семейства СС [17].MCP-1 (или CCL2) являются хемотаксическими для Th1-лимфоцитов и играют важную роль в Th1-опосредованном иммунном ответе. Повышение MCP-1 наблюдается при различных острых и хронических заболеваниях легких у взрослых и детей. В исследовании под руководством Murch [18]изучалась динамика концентрации хемокинов в трахеобронхиальном аспирате у новорожденных детей с очень низкой массой тела. Концентрация хемокинов увеличивалась при остром повреждении легких у детей с очень низкой массой тела, находящихся на ИВЛ, и коррелировала с неблагоприятным исходом. Baier et al. также продемонстрировали, что концентрации MCP-1, MCP-2, MCP-3 и MIP-1β в трахеальном аспирате новорожденных с очень низкой массой тела с течением РДС увеличиваются в течение первой недели жизни, тогда как заметного повышения концентрации MIP-1α не происходит. Также было обнаружено, что повышение концентрации хемокинов в трахеальном аспирате ассоциировано с развитием БЛД [17]. Однако в более современном исследовании ассоциация БЛД именно с MCP-1 не подтвердилась [19]. Следует отметить, что MCP-1 может повышаться как при асептическом, так и при патоген-индуцированном воспалении [20]. Помимо этого, MCP-1 не является белком, специфичным исключительно для легочной ткани, его повышение описано при поражении других органов и тканей [21, 22]. В нашем исследовании зарегистрировано повышение MCP-1 в 1-е сутки жизни у новорожденных с инфекционным генезом дыхательных нарушений по сравнению с детьми группы контроля и недоношенными с РДС и ТТН (хотя различие показателей не достигло статистической значимости). Важно отметить, что MCP-1 оставался значительно повышенным и на 7-е сутки жизни, что, вероятнее всего, связано с выраженным повреждением и воспалительными изменениями в легочной ткани при ВП, которые не отмечались при течении РДС у детей, рожденных на 32–36-й неделях гестации. И в отличие от IL-6 динамика МСР-1 к 7-м суткам жизни была отчетливой и статистически значимой только при дыхательных нарушениях инфекционного генеза – ВП. Гипотеза о более выраженном инфекционном, патоген-индуцированном воспалении у детей ГВ 32–36 недель также подтверждается клиническими данными – в группе пациентов с ВП была выше потребность в проведении инвазивной ИВЛ, чем в подгруппах РДС и ТТН. Об этом же свидетельствуют результаты проведенного нами ранее исследования, в котором уровень МСР-1 был значительно более высоким у недоношенных детей с врожденной инфекцией вне зависимости от их ГВ [5].
IL-10 является противовоспалительным цитокином, подавляющим процессы воспаления в тканях организма. По полученным нами данным, содержание IL-10 в контрольной группе пациентов было наиболее высоким, наиболее низким – у новорожденных с ВП, что закономерно для активного системного воспаления.
Изучение соотношения уровней провоспалительных цитокинов и IL-10 продемонстрировало статистически значимо более высокие показатели IL-6/IL-10 и IL-8/IL-10 в 1-е сутки жизни у новорожденных из группы ВП по сравнению с детьми группы контроля и остальных подгрупп. В динамике к концу раннего неонатального периода происходило снижение IL-6/IL-10 у новорожденных с ВП до тех же цифр, что и у детей без инфекционного диагноза. Показатель IL-8/IL-10 в динамике также снижался, однако у детей с ВП сохранялось статистически значимо более высокое значение. Повышение уровня IL-8 и его соотношения с IL-10 к концу раннего неонатального периода может свидетельствовать о сохранении и/или об отсутствии купирования воспалительного процесса, несмотря на проводимую антибактериальную терапию. Несформированный адаптивный иммунитет (отсутствие изменений в содержании и динамике IFNγ, TNFα) в совокупности с перечисленными изменениями IL-8 свидетельствуют об общей незрелости иммунной системы и о провоспалительной направленности иммунных реакций.
Заключение
Выявленные изменения содержания цитокинов у детей гестационного возраста 32–36 недель в зависимости от генеза дыхательных нарушений (РДС, ТТН и ВП) свидетельствуют о различных механизмах реализации иммунных реакций при данных патологических состояниях.
Сопоставление уровней цитокинов у новорожденных с инфекционным и неинфекционным генезом на 1-е сутки жизни выявило статистически значимые различия по содержанию IL-6, MIP-1β, IL-10, а в возрасте 7 суток жизни – статистически значимое различие только по содержанию МСР-1. Сопоставление динамики изучаемых цитокинов продемонстрировало отчетливое снижение уровней IL-6, MCP-1 и повышение содержания IL-10 и МIP-1β у новорожденных с ВП по сравнению с детьми с РДС и ТТН.
В перспективе оценка соотношения IL-6/IL-10 и IL-8/IL-10 может иметь диагностическую и прогностическую значимость, поскольку в 1-е сутки жизни оба показателя у новорожденных с пневмонией были повышены по сравнению с другими подгруппами и группой контроля. При этом в динамике оба показателя снижались практически до тех же значений, что и у детей без инфекционного диагноза, что может косвенно свидетельствовать о снижении остроты воспалительного процесса.
Таким образом, наиболее показательным из исследованных маркеров оказался IL-6, определение которого доступно в рутинной клинической практике. Содержание IL-6 в сыворотке крови как в виде концентрации, так и в виде соотношения с IL-10 может использоваться для ранней диагностики ВП у недоношенных детей и оценки динамики течения воспалительного процесса.
Определение уровня цитокинов в 1-е сутки жизни может быть полезным в плане дифференциальной диагностики причины дыхательных нарушений у недоношенных новорожденных, а на 7-е сутки жизни – для объективной оценки эффективности проводимой терапии. Определение соотношения провоспалительных цитокинов к IL-10 может использоваться в качестве дополнительного критерия при решении вопроса об отмене или необходимости продолжения антибактериальной терапии недоношенных детей при подозрении на ВП.



