Вскоре после первой успешной беременности с использованием экстракорпорального оплодотворения (ЭКО) были разработаны различные системы классификации, основанные на морфологии эмбрионов и скорости их дробления. За последнее время удалось достичь значительных успехов в данной области, однако, несмотря на все достижения, частота наступления беременности с последующими родами остается все еще недостаточно высокой. Одной из ключевых проблем недостаточной эффективности вспомогательных репродуктивных технологий является отсутствие методов точной оценки репродуктивного потенциала отдельных эмбрионов, что ведет к низкой частоте имплантации.
Женщины с повторными неудачами имплантации составляют более 30% пациенток, проходящих лечение в программе ЭКО; при этом семейные пары часто подвергаются длительным, трудоемким схемам лечения, испытывая сложные психоэмоциональные и финансовые проблемы [1].
Как известно, преждевременные роды при многоплодной беременности являются одной из причин высокой перинатальной заболеваемости и смертности, показатели которых в 3–4 раза выше, чем при одноплодной беременности, и увеличиваются прямо пропорционально количеству плодов [2, 3]. Учитывая медицинские осложнения, связанные с многоплодной беременностью, некоторые страны ввели правовые ограничения на количество переносимых эмбрионов в циклах ЭКО.
Важной целью лечения бесплодия в современных условиях является уменьшение количества многоплодных беременностей и при этом сохранение или увеличение общего количества беременностей с помощью улучшения существующих методов оценки эмбрионов.
В настоящее время основным способом оценки качества получаемых эмбрионов является метод отбора по морфологическим критериям. Данный подход представляется простым и доступным, однако является недостаточным для прогнозирования последующей успешной имплантации [4].
В последнее десятилетие одним из современных и мощных инструментов улучшения эффективности циклов ЭКО является предимплантационное генетическое тестирование. Однако данный метод имеет ряд ограничений, основным из которых является потенциальное воздействие на эмбрион в момент проведения процедуры биопсии [5, 6]. Данные ограничения стимулировали исследователей на поиск различных вспомогательных неинвазивных методов оценки качества и жизнеспособности эмбрионов.
Метаболомика изучает уникальный состав низкомолекулярных химических соединений в клетках и биологических средах, формирующийся за счет многообразных метаболических процессов. В сравнении с транскриптомными и протеомными подходами, требующими в основном использования самого объекта исследования для анализа, метаболомное профилирование может дать ценную информацию о состоянии развивающегося эмбриона за счет анализа сред культивирования [7, 8]. Метаболизм эмбрионов человека можно изучать в основном по составу питательных сред, в которых происходит культивирование до момента переноса. Развитие инструментальных методов позволило проводить более комплексную оценку состава питательных сред с возможностью детектирования большого количества метаболитов.
Известно, что активность метаболизма меняется в зависимости от стадии развития, что является отражением морфофункционального состояния эмбриона. Также формирующийся метаболомный профиль на определенной стадии развития может использоваться в качестве информативной характеристики нормального или патологического фенотипа эмбриона [9], позволить оценить состояние и прогнозировать судьбу конкретного эмбриона [10]. Возможность применения данного подхода для оценки качества эмбриона и его имплантационного потенциала до сих пор остается малоизученной.
Для повышения эффективности культивирования эмбрионов в последние годы проводится разработка оптимальных питательных сред, наиболее подходящих для ранних этапов развития. В частности, одним из подходов является добавление в среду гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ, GM-CSF). Как было показано ранее, использование ГМ-КСФ способствует ускорению развития эмбриона, увеличению внутренней клеточной массы и снижению активности проапоптотических процессов [11–13]. Состав питательных сред от разных производителей в значительной степени варьирует: от сравнительно простых до многокомпонентных [14, 15]. Различия в составе, в свою очередь, могут отражаться на активности метаболических путей эмбриона и приводить к формированию специфических профилей метаболитов, соответствующих условиям культивирования. Важно отметить, что влияние состава среды на эмбриональный метаболом практически не изучалась.
Для выявления комбинаций метаболитов, которые потенциально могут служить маркерами успешной имплантации, а также облегчить выбор наиболее перспективного эмбриона, нами было проведено первичное исследование, целью которого явилось выявление отличий в профилях метаболитов эмбриональных питательных сред на 3-и и 5-е сутки культивирования в зависимости от вида питательной среды и исходов имплантации.
Материалы и методы
В ходе одномоментного исследования в параллельных группах были получены образцы сред культивирования эмбрионов различных морфологических групп. Нами были отобраны образцы питательных сред эмбрионов, относящихся к «отличной» категории, согласно морфологической классификации Гарднера, от 43 пациенток в возрасте от 24 до 37 лет, проходящих программу ЭКО (ИКСИ). Культивирование эмбрионов проводилось в индивидуальных каплях культуральных сред (Irvine CSC и Origio Embryogen) одинакового объема (30 мкл). На 3-и и 5-е сутки культивирования производилась морфологическая оценка полученных эмбрионов с последующим забором в равных объемах отработанных культуральных сред, которые были промаркированы и заморожены (-80°С).
Перед проведением высокоэффективной жидкостной хроматографии и масс-спектрометрии (ВЭЖХ-МС) проводили экстракцию метаболитов с помощью добавления трех объемов метанола к одному объему инкубационной среды. После перемешивания преципитат осаждали центрифугированием при 14 000 g, супернатант использовали для анализа.
Для ВЭЖХ-МС-анализа отбирали 18 мкл экстракта каждого образца, добавляли 2 мкл внутреннего стандарта с конечной концентрацией 25 мкМ, разделение проб проводили на колонке Zorbax SB C18 – 5 мкм, длина 15 см, внутренний диаметр 0,5 мм (Agilent, USA) при помощи хроматографической системы Ultimate 3000 Nano LC System (Thermo Scientific, USA).
Элюирование компонентов образцов проводили в изократическом растворе 5% подвижной фазы В (0,1% раствор муравьиной кислоты в ацетонитриле) в течение 15 минут, затем в градиенте 5–95% подвижной фазы в течение 10 минут при скорости потока 40 мкл/мин. Затем промывали 5 минут (95% раствора В), после чего в течение 1 минуты возвращалась исходная концентрация фазы B в 5%, и колонка 3 минуты уравновешивалась. Общее время хроматографии одного образца составило 34 минуты. Детекция метаболитов проводилась на гибридном квадруполь-времяпролетном масс-спектрометре Bruker MaXis Impact (Bruker Daltoniks, Germany) в двух измерениях на один образец. Масс-спектры получали при разрешении 50 000 в диапазоне 100–1500 m/z, в режиме положительно заряженных ионов.
Детектирование пиков, удаление шумовых сигналов, обработка и анализ данных проводились программным пакетом Progenesis QI 2.0 (Waters, Milford, США). Обработка и выравнивание масс-спектров были выполнены с параметрами: тип прибора – масс-спектрометр высокого разрешения; минимальная абсолютная интенсивность пика – 100 ед.; минимальная ширина пика – 0,02 мин. С помощью дискриминантного анализа методом частных наименьших квадратов (PLS-DA) определяли различия между сравниваемыми группами. Для поиска потенциальных метаболитов с соответствующими молекулярными массами использовали базу данных HMDB (www.hmdb.ca), кратность изменений этих метаболитов между группами образцов определялась с помощью программного пакета Progenesis. Для обогащения метаболических путей, протекающих с участием потенциальных метаболитов, использовали базу данных KEGG (www.kegg.jp).
Результаты
Для культивирования эмбрионов в данной работе было использовано два протокола со сменой питательной среды на 3-и сутки после оплодотворения. В одном случае группа эмбрионов (Гр 1) культивировалась до и после 3-х суток в питательной среде Irvine CSC. Другая группа эмбрионов (Гр 2) культивировалась до 3-х суток в среде Origio Embryogen (содержащей ГM-КСФ), после чего культивирование до 5-х суток проводили в среде Irvine CSC. Образцы сред обеих групп были разделены на подгруппы в соответствии со сроком культивирования (3-и и 5-е сутки) и исходами имплантации («+» и «-» – положительный и отрицательный исход соответственно): Гр 1–3+, Гр 1–3-, Гр 1–5+, Гр 1–5- и Гр 2–3+, Гр 2–3-, Гр 2–5+, Гр 2–5-. Было использовано 45 образцов сред 3-х суток культивирования и 42 образца сред 5-х суток культивирования.
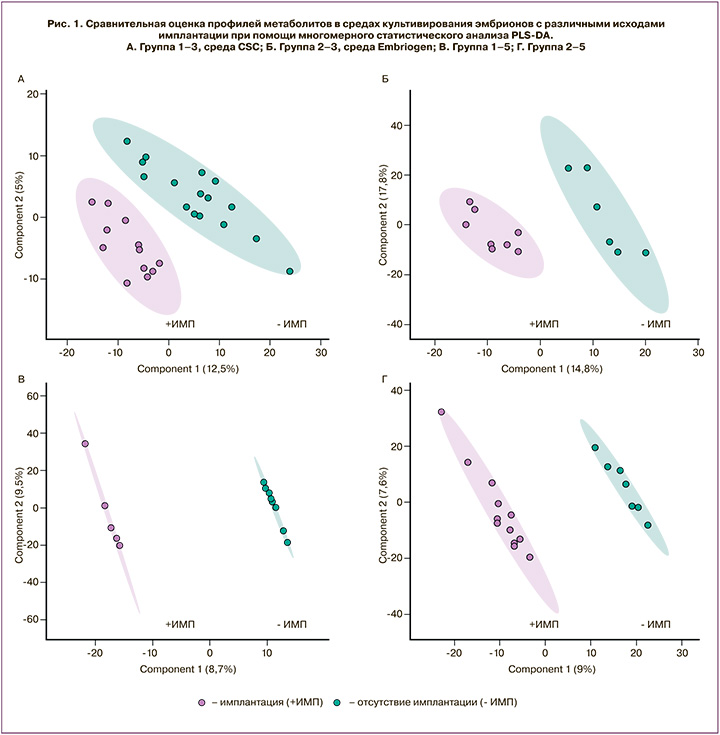
Метаболомное профилирование питательных сред проводили с использованием метода ВЭЖХ-МС, позволившего получить наборы данных хроматографического разделения и регистрации молекулярных ионов исследуемых образцов. После детекции хроматографических пиков и удаления шумовых сигналов для полученных данных был проведен статистический анализ PLS-DA, который позволил выявить возможные различия между исследуемыми группами. На рисунке 1 показаны результаты анализа для 4 проведенных сравнений 8 исследованных групп образцов. Было установлено, что во всех случаях происходит четкая кластеризация образцов групп имплантировавшихся и неимплантировавшихся эмбрионов при использовании обоих протоколов. При этом на 3-и сутки различия были более выражены, что отражается в больших различиях между группами при PLS-DA-анализе.
По результатам проведенного многомерного статистического анализа для каждой из 4 исследуемых групп были сформированы списки молекулярных ионов, которые в наибольшей степени обуславливали наблюдаемые различия между группами, с последующим проведением их первичной идентификации с использованием базы данных HMDB, которая позволяет определить соответствие массы молекулярного иона потенциальному метаболиту. В результате были получены списки потенциальных метаболитов с различным уровнем представленности в группах с успешной имплантацией и ее отсутствием (табл. 1, 2). Кратность изменений каждого метаболита определялась с помощью пакета Progenesis QI.
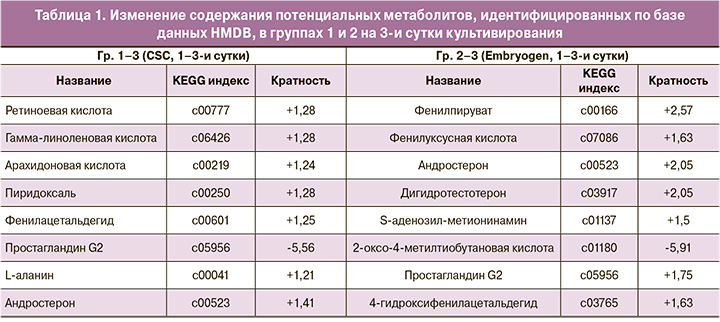
В Гр 1–3 на 3-и сутки культивирования в средах Irvine CSC у имплантировавшихся эмбрионов наблюдалось увеличение представленности потенциальных метаболитов: ретиноевой кислоты (кратность изменения – 1,28), арахидоновой кислоты (1,24), гамма-линоленовой кислоты (1,28), пиридоксаля (1,28), фенилацетальдегида (1,25), андростерона (1,41) L-аланина (1,21). При анализе Гр 2–3 на 3-и сутки культивирования в среде Origio Embryogen (содержащей ГМ-КСФ) у имплантировавшихся эмбрионов наблюдалось увеличение представленности таких потенциальных метаболитов, как фенилпируват (2,57), 2-фенилацетат (1,63), дигидротестостерон (2,05), андростерон (2,05), простагландин G2 (1,75), 4-гидроксифенилацетальдегид (1,63) (табл. 1).
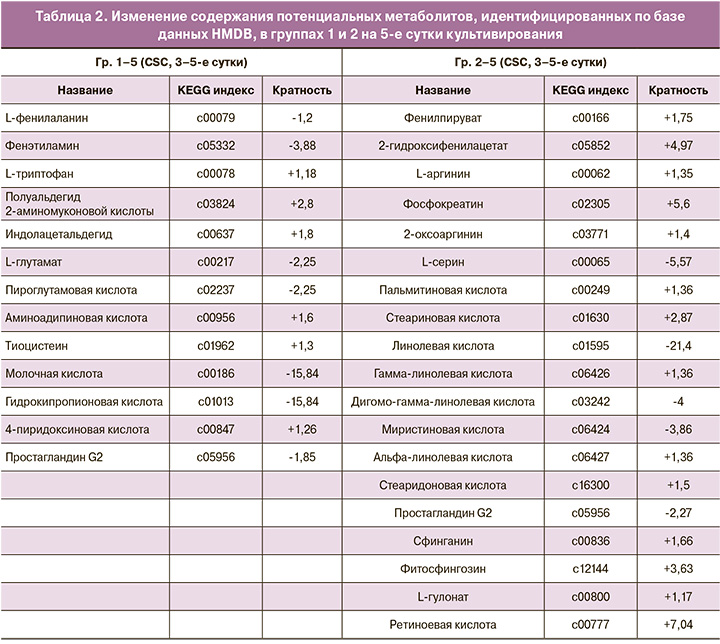
На 5-е сутки культивирования в Гр 1–5 были выявлены следующие изменения содержания кандидатных веществ у имплантировавшихся эмбрионов: снижение L-фенилаланина (1,2), фенэтиламина (3,88), L-глутамата (2,25), пироглутаминовой кислоты (2,25), гидроксипропионовой кислоты (15,84), простагландина G2 (1,85) и увеличение L-триптофана (1,18), семиальдегида 2-аминомуконовой кислоты (2,8), индолацетальдегида (1,8), тиоцистеина, 4-пиридоксата (1,26).
В Гр 2–5, где эмбрионы культивировались с 3-х по 5-е сутки в среде Irvine CSC, у имплантировавшихся эмбрионов отмечено увеличение представленности фенилпирувата (1,75), L-аргинина (1,35), гидроксифенилацетата (4,97), фосфокреатина (5,6), пальмитиновой (1,36), гамма-линолевой (1,36), стеариновой (2,87), стеаридоновой (1,5) жирных кислот, сфинганина (1,66), L-гулоната (1,17), фитосфингозина (3,63), ретиноевой кислоты (7,04) и снижение линолевой (21,4), дигомогамма-линоленовой (4), миристиновой (3,86) жирных кислот, L-серина (5,57), простагландина G2 (2,27), по сравнению со средами неимплантировавшихся эмбрионов.
При анализе метаболических путей, участниками которых могут быть выявленные метаболиты, с использованием базы данных KEGG было показано, что на 3-и сутки как в среде CSC Irvine, так и в среде Origio Embryogen могут быть задействованы сходные пути метаболизма: витамина B6, аланина, фенилаланина, глицина, серина, треонина, ретинола, стероидных гормонов и альфа-линолевой кислоты (рис. 2).
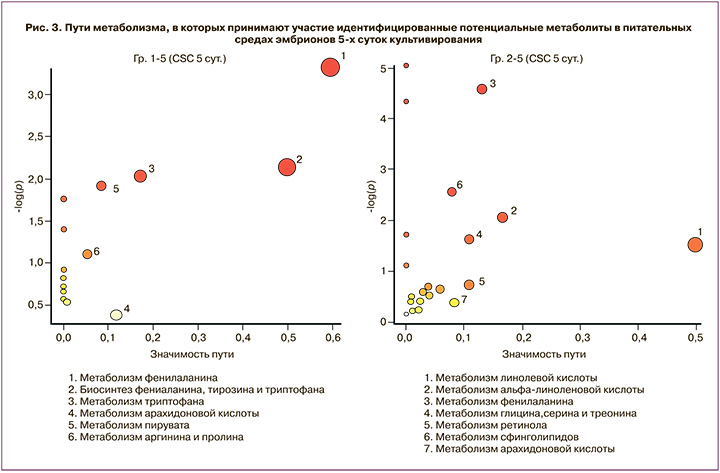
Как видно из данных, представленных на рисунке 3, на 5-е сутки в Гр 1 сохраняется присутствие путей, связанных с биосинтезом аминокислот, а в Гр 2 появляются пути биосинтеза жирных кислот (линолевой, линоленовой, арахидоновой) и сфинголипидов. На рисунках 2 и 3 по оси ординат отложены значения Log(p) – статистического параметра достоверности участия метаболитов в пути (чем выше значение, тем выше достоверность участия), по оси абсцисс – pathway impact, который зависит от количества выявленных метаболитов и их значимости в пути. Поскольку различные метаболиты могут входить в состав разнообразных сопряженных путей, данное представление позволяет оценить вероятное протекание превращения и вклад выявленных метаболитов в его реализацию (больший размер фигуры свидетельствует о более предпочтительной реализации соответствующего пути).
Обсуждение
Метаболомика относится к группе «омиксных» технологий, использующих комплексный подход, заключающийся в профилировании состава различных классов соединений в клетках и тканях организма. В отличие от геномики и протеомики, метаболомика имеет дело с низкомолекулярными соединениями, являющимися участниками метаболических путей превращения основных классов биологически значимых органических соединений. В большинстве ранее проводимых работ для метаболомного профилирования сред культивирования эмбрионов использовался метод ближней инфракрасной спектроскопии, который позволяет проводить измерения в небольших объемах (менее 15 мкл) и в относительно короткие сроки. Однако этот метод позволяет оценить наличие молекулярных функциональных групп, по которым можно произвести сравнение спектров поглощения образцов, и соотнести их с жизнеспособностью и имплантационным потенциалом, но без возможности идентификации различных метаболитов [16–18].
Спектроскопия протонного ядерного магнитного резонанса с высокой точностью анализирует различные метаболические профили, однако для этого требуются достаточно большие объемы образцов, а для исследования – дорогостоящее и сложное оборудование, а также длительная обработка образцов со сложным статистическим анализом для интерпретации полученных результатов; поэтому данный метод нецелесообразно использовать в клинических условиях [19].
Сочетание ВЭЖХ и МС (ВЭЖХ-МС) позволяет с высокой точностью определять их молекулярные массы, разделяя молекулярные компоненты в культуральной среде. Определение параметров хроматографической подвижности, площадей хроматографических пиков и значений молекулярных масс соединений дает возможность для первичной идентификации компонентов культуральных сред и их относительной представленности в сравниваемых группах. Данный метод может обеспечить высокую специфичность и чувствительность, всесторонне, качественно идентифицировать, а также дать количественную оценку метаболитам в широком диапазоне молекулярных масс.
В проведенном нами исследовании были использованы отработанные культуральные среды эмбрионов 3-го и 5-го дня культивирования, относящихся к «отличной» категории, согласно морфологической классификации Гарднера, у пациенток, включенных в исследование и проходящих программу ЭКО (ИКСИ).
Заслуживает внимания тот факт, что при проведении статистической обработки данных ВЭЖХ-МС методом PLS-DA нами получены данные, которые позволили выявить достоверные различия в профилях метаболитов между исследуемыми группами в зависимости от вида среды культивирования и исходов после переноса эмбриона в полость матки пациенток. Во всех случаях отмечалась четкая кластеризация образцов в зависимости от исходов имплантации, что свидетельствует о наличии в средах молекулярных компонентов, содержание которых значимо меняется в сравниваемых группах. Данные отличия наблюдались как при использовании среды, не содержащей ГМ-КСФ (Irvine CSC), так и при культивировании последовательно на среде, содержащей ГМ-КСФ (Origio Embryogen), а затем на среде Irvine CSC.
При помощи баз данных HMDB нами была произведена первичная идентификация потенциальных метаболитов, вносящих вклад в установленные различия между группами с положительным и отрицательным исходом имплантации. Также был проведен анализ метаболических путей, в которых могут принимать участие потенциальные метаболиты. Было выявлено изменение содержания некоторых аминокислот: аланина, метионина, триптофана, серина и аргинина и ряда их производных (табл. 1, 2). Ранее было показано характерное изменение содержания данных аминокислот в питательных средах эмбрионов человека на разных стадиях развития in vitro. По мнению авторов, оценка изменения содержания комбинации аминокислот может служить в качестве предиктора их способности достигнуть развития до стадии бластоцисты [7]. Обращало также на себя внимание изменение содержания аминокислоты фенилаланина и ее производных: фенилацетальдегида, 4-гидроксифенилацетальдегида, фенилуксусной кислоты и фенилпирувата в 1-й и 2-й группах как на 3-и, так и на 5-е сутки культивирования. Данное наблюдение может быть свидетельством важной роли метаболических превращений фенилаланина в эмбриональном развитии, поскольку эта аминокислота, помимо участия в синтезе белков, является предшественником для синтеза катехоламинов, косубстратом для интерконверсии других аминокислот и может участвовать в энергетическом обмене.
Анализ метаболических путей показал, что на 3-и сутки как при культивировании в среде Irvine, так в среде Origio Embryogen выявляются сходные метаболические превращения, связанные с метаболизмом витамина В6, ретинола, аланина, фенилаланина, линолевой кислоты и стероидов (рис. 1), что может свидетельствовать об их существенном вкладе в развитие эмбриона на данном сроке культивирования. Полученные данные подтверждаются результатами ряда работ, где было показано наличие ассоциации процессов обмена витаминов и аминокислот с нормальным фенотипом эмбрионов [20, 21].
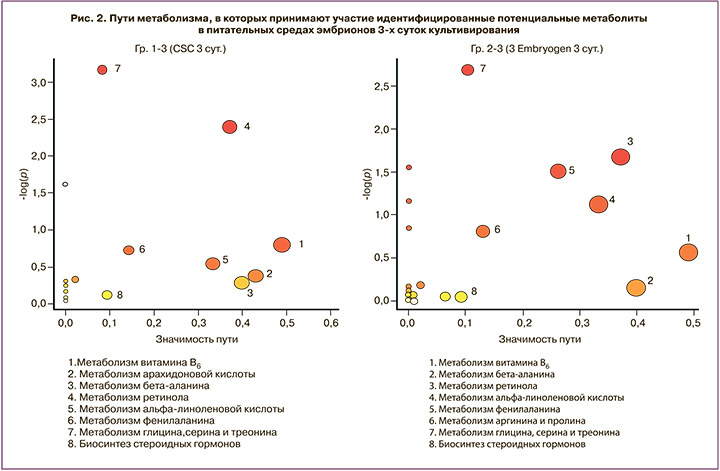
На 5-е сутки культивирования отмечалось смещение метаболической активности в сторону метаболизма моносахаров и аминокислот у эмбрионов, которые инкубировались первые 3 суток в культуральной среде Irvine CSC (Гр 1). Данное наблюдение, очевидно, связано с тем, что используемая среда содержит полный набор заменимых и незаменимых аминокислот, а также глюкозу. В Гр 2 (среда Origio Embryogen) также наблюдалось обогащение по путям превращения аминокислот, однако обращало на себя внимание обогащение по путям биотрансформации жирных кислот (рис. 2). Можно предположить, что культивирование эмбрионов первые 3 суток в среде с пониженным по составу и количеству содержанием аминокислот (Origio Embryogen), а также в присутствии ГМ-КСФ переключает метаболические пути на синтез и превращение жирных кислот, что может быть положительным фактором в судьбе эмбриона после переноса. Известно, что присутствие ГМ-КСФ в питательной среде стимулирует пролиферацию и приводит к увеличению количества клеток трофоэктодермы и внутренней клеточной массы, а также повышает вероятность развития эмбриона человека до стадии бластоцисты [22]. Тем не менее влияние данного цитокина на метаболизм эмбрионов человека остается практически не изученным. В клетках иммунной системы, в частности в макрофагах, ГМ-КСФ способен стимулировать гликолиз и липогенез за счет повышения активности транспортеров глюкозы и ферментов биосинтеза липидов, что, в свою очередь, является необходимым условием для развития провоспалительного фенотипа [23].
Жирные кислоты играют важную роль как структурные компоненты различных липидов, как субстраты для энергетического обмена, а также как предшественники различных медиаторов, в частности простагландинов, участвующих в процессах развития и дифференцировки. Недавно было показано, что ГМ-КСФ способствует дифференцировке Т-лимфоцитов за счет регуляции активности циклооксигеназы-2 и продукции простагландина Е2 [24].
В нашей работе наблюдалось преимущественное снижение содержания простагландина G. Снижение данного эйкозаноида может быть связано как со снижением его продукции, так и с усилением утилизации. Известно, что простагландин G после образования быстро конвертируется циклооксигеназами в простагландин H, который является предшественником большинства представителей семейства простагландинов. Таким образом, повышение содержания простагландина G может свидетельствовать о снижении активности циклооксигеназы и возможном снижении синтеза простагландинов. Ранее было показано, что простагландины синтезируются клетками бластоцисты, а также что нарушение продукции этих эйкозаноидов приводит к снижению способности к имплантации [25]. Таким образом, снижение утилизации общего предшественника простагландинов – простагландина G – и увеличение его содержания в питательных средах на стадии бластоцисты может быть одним из потенциальных маркеров исхода имплантации. В недавно проведенной работе A. Yagi et al. была также описана возможность анализа состава жирных кислот для оценки качества эмбриона. При помощи ВЭЖХ-МС был проведен анализ свободных жирных кислот в культуральных средах эмбрионов 5-х суток культивирования, относящихся к различным морфологическим группам. Авторы показали достоверное снижение содержания некоторых свободных жирных кислот в средах эмбрионов с лучшими морфологическими характеристиками. Однако в данной работе не проводилась оценка взаимосвязи между содержанием жирных кислот в питательной среде и имплантационным потенциалом культивируемых эмбрионов [26]. Таким образом, анализ жирных кислот и их метаболитов может быть информативным подходом для оценки качества и имплантационного потенциала.
Необходимо отметить, что списки идентифицированных метаболитов отличались в анализируемых группах, однако анализ метаболических путей показал значительное количество совпадающих биохимических процессов (рис. 2, 3), что свидетельствует о том, что идентифицированные метаболиты в группах эмбрионов, культивированных в разных питательных средах, входят в состав одних и тех же путей биохимических превращений. Это, в свою очередь, свидетельствует в пользу значимости данных путей в формировании эмбрионального фенотипа с повышенным имплантационным потенциалом. Полученный результат показывает, что для выявления списка специфических маркеров необходимо учитывать состав инкубационной среды, в которой проводилось культивирование. Тем не менее проведенное метаболомное профилирование указывает на то, что вне зависимости от использованных питательных сред имеются достоверные отличия в их молекулярном составе, позволяющие дифференцировать группы имплантированных и неимплантированных эмбрионов как на 3-и, так и на 5-е сутки культивирования. Данный результат указывает на то, что необходимо проводить дальнейшие исследования с целью точной структурной идентификации обнаруженных молекулярных ионов и определения количественных параметров изменения их содержания в отработанных питательных средах. Подобные исследования позволят составить список наиболее значимых метаболитов, изменение концентрации которых в соответствующих средах культивирования будет служить основанием для выбора эмбриона с положительным имплантационным потенциалом.
Заключение
Метаболомное профилирование может быть использовано для одновременного выявления большого количества биомаркеров с целью создания модели несубъективной системы оценки эмбрионов. Выявление определенного набора прогностических биомаркеров при помощи ВЭЖХ-МС на 3-и и 5-е сутки культивирования в перспективе может лечь в основу разработки простых, быстрых и более дешевых тест-систем, которые можно было бы использовать в циклах вспомогательных репродуктивных технологий вне зависимости от используемых сред культивирования. Анализ состава сред культивирования эмбрионов методом метаболомного профилирования может способствовать более точному отбору для селективного переноса одного эмбриона с целью снижения рисков, связанных с многоплодной беременностью.



