Гипертензивные расстройства являются наиболее частыми осложнениями беременности, оказывающими выраженное влияние на состояние здоровья матери, плода и новорожденного ребенка [1, 2]. Среди всех гипертензивных расстройств наиболее грозным патологическим состоянием является преэклампсия, частота которой во всем мире остается высокой и не имеет тенденции к снижению. По данным литературы, в Европе частота преэклампсии составляет 2–5%, в развивающихся странах – 12–15% [3–6]. В России, по данным Министерства здравоохранения, частота преэклампсии составляет 3–7%. При этом развитие данного осложнения ассоциируется с высокой частотой материнской заболеваемости и смертности, а также тяжелыми перинатальными и неонатальными исходами [7–10].
Вышеизложенное свидетельствует о том, что актуальным остается поиск различных биомаркеров преэклампсии, позволяющих не только прогнозировать сроки ее развития, тяжесть данного патологического состояния, но и оценивать их влияние на рост, развитие плода и здоровье новорожденного.
В последние годы широко внедряются новые методы неинвазивной диагностики, основанные на молекулярно-генетических исследованиях. Особое внимание исследователей направлено на изучение пептидома мочи беременных женщин как более доступного неинвазивного метода [11–13]. В качестве ранних маркеров преэклампсии были предложены цепи коллагена α-1 (I), цепи коллагена α-1 (III) и уромодулина, пептиды α1-антитрипсина (SERPINA1), последний из которых является одним из наиболее перспективных пептидных маркеров преэклампсии [7, 14–16] и может использоваться в качестве высокоспецифичного диагностического теста, коррелирующего с тяжестью преэклампсии.
N. Starodubtseva et al. [7] было отмечено, что обнаружение SERPINA1 в моче беременных ассоциируется со степенью повреждения ворсинчатого дерева плацентарной ишемии и гипоксии, обусловливающей задержку роста плода. Поэтому интерес представляет изучение взаимосвязи между выявлением специфического протеина мочи α1-антитрипсина (SERPINA1) у беременных и особенностей течения неонатального периода, что позволит прогнозировать развитие патологических состояний у новорожденных с целью оптимизации подходов к лечению, наблюдению и выхаживанию.
Цель исследования: выявление взаимосвязи между наличием пептидов α1-антитрипсина (SERPINA1) с тяжестью преэклампсии и перинатальными/неонатальными исходами.
Материалы и методы
Проведен анализ анамнеза, особенностей течения беременности, родов, послеродового периода, состояния плодов и новорожденных у 79 женщин, наблюдавшихся в ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России в период 2018–2019 гг. Все пациентки были разделены на 3 группы: группа 1 (основная) – 41 беременная с преэклампсией (ПЭ); группа 2 (сравнения) – 17 женщин с хронической артериальной гипертензией (ХАГ); группа 3 (сравнения) – 18 пациенток с физиологически протекающей беременностью. При определении пептидомного профиля мочи было отмечено, что основная группа неоднородна. В зависимости от выявления SERPINA1 в моче беременных в группе 1 были выделены подгруппы: 1а (n=23) – ПЭ, SERPINA1 положительный (ПЭ Ser+) и 1б (n=21) – ПЭ, SERPINA1 отрицательный (ПЭ Ser-).
Включение беременных в исследование проводилось по методу подбора пар. Критериями включения в исследование были: одноплодная беременность в сроке от 22 до 40 недель гестации, возраст беременных от 18 до 45 лет, наличие ПЭ (группа 1), ХАГ (группа 2). Критерии исключения: многоплодная беременность, тяжелые формы сахарного диабета, трансплантация внутренних органов, аутоиммунные и онкологические заболевания, хроническая болезнь почек, хромосомные аномалии и врожденные пороки развития плода.
После подписания добровольного информированного согласия, одобренного Этическим комитетом ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России, у всех пациенток были собраны образцы мочи на сроках до 34 недели гестации при их госпитализации в отделения Центра. Специфическую терапию, направленную на коррекцию патологических состояний беременности на момент забора анализа мочи, пациентки не получали.
После сбора образцы мочи центрифугировали в течение 10 минут с ускорением 2000 g при 4°C. Супернатант хранился при -80°C до проведения исследования. Пептидомный профиль мочи выделялся методом гель-фильтрации и анализировался ВЭЖХ-МС/МС в полном соответствии с разработанными авторами [13] ранее протоколами. Анализ пептидной фракции и градиентная хроматография проводились на нанопоточном хроматографе Agilent 1100 (Agilent Technologies, США) с гибридным масс-спектрометром 7-T LTQ-FT (Thermo Electron, Германия) с колонкой 75 мкм 12 см с фазой Reprosil-PurBasic C18, 3 мкм (Dr. Maisch HPLC GmbH, Германия). Данные МС и МС/МС были получены в зависимом от данных режиме с использованием программного обеспечения Xcalibur (Thermo Finnigan, Сан-Хосе, Калифорния, США). Спектры МС сканирования исходных ионов (диапазон m/z 300–1600 а.е.м.) получали в FTICR с разрешением R=50 000 при m/z 400 а.е.м. (количество накопленных ионов 5×106). Полученные данные анализа MС обрабатывали с использованием программного обеспечения PEAKS Studio.
Оценка состояния новорожденных включала в себя антропометрические данные после рождения, необходимость проведения интенсивной и реанимационной помощи, оценку состояния новорожденных по шкале Апгар на 1-й и 5-й минутах, а также длительность их пребывания в стационаре.
Статистический анализ
Полученные результаты вносились в специально разработанную тематическую карту и в электронные таблицы MS Excel. Статистическая обработка полученных результатов была проведена при помощи программного пакета SPSS 26.0 Statistics for Windows. Перед проведением сравнительного анализа качественных данных в исследуемых группах проверяли соответствие нормальному распределению (графический анализ данных, тест Колмогорова–Смирнова). Для описания количественных данных, имеющих нормальное распределение, использовались среднее арифметическое (М) и стандартное отклонение (SD). Для анализа признаков, не имеющих нормального распределения, применялись методы непараметрической статистики. Количественные признаки, не имеющие нормального распределения, представлены в виде медианы (Ме) и интерквартильного интервала (Q1;Q3). Сравнение трех и более независимых групп проводилось с использованием критериев Краскела–Уоллиса, попарные сравнения – по Манну–Уитни с поправкой на множественность Бонферрони, сравнение бинарных переменных – при помощи критерия χ2 Пирсона с построением таблиц «2×2», критерия Фишера (для небольших выборок). Оценка влияния факторов риска рассчитывалась с применением определения относительных шансов (ОШ) с 95% доверительным интервалом (95% ДИ). Различия считались статистически значимыми при р<0,05, при сравнении трех групп критическая величина уровня значимости (р) принята за 0,017, а при сравнении четырех групп – за 0,008.
Результаты
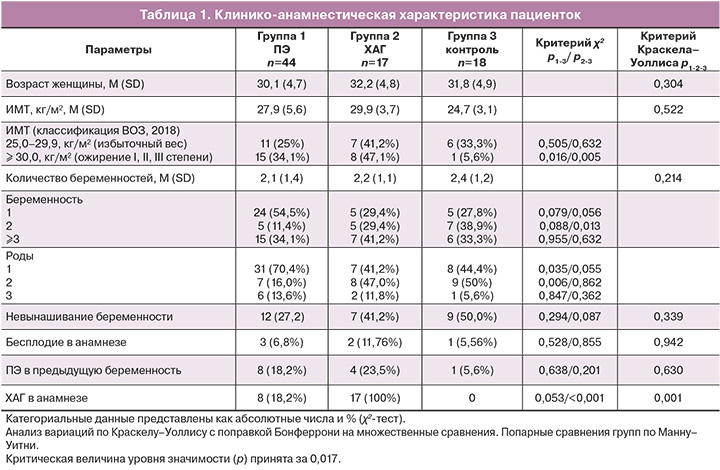
На первом этапе были проанализированы клинико-анамнестические данные включенных в исследование женщин (табл. 1).
Известно, что к предрасполагающим факторам развития преэклампсии относятся возраст матери менее 20 и старше 40 лет, первая беременность, индекс массы тела (ИМТ) >30 кг/м², длительный интергравидарный промежуток (более 10 лет), наличие ПЭ в предыдущую беременность, ХАГ, заболевания почек и мочевыводящих путей [4, 5].
Как видно из данных, представленных в таблице 1, пациентки не различались по возрасту (р>0,1). Статистически значимых отличий в ИМТ на момент наступления беременности не выявлено: ИМТ (M (SD)) в группе 1 составил 27,9 (5,6) кг/м², в группе 2 – 29,9 (3,7) кг/м², в группе 3 – 24,7 (3,1) кг/м², р1-2-3=0,522. Однако нарушение жирового обмена (ожирение I, II, III степени) отмечалось преимущественно у женщин с ХАГ и ПЭ по сравнению с группой контроля (15/44 (34,1%), 8/17 (47,1%) и 1/18 (5,6%) соответственно по группам, р1-3=0,016, р2-3=0,005).
Первородящие превалировали в группе 1 (ПЭ) – 31/44 (70,4%), их частота была выше, чем в группе 2 (ХАГ) – 7/17 (41,2%) (OШ1-2=3,4 (95% ДИ 1,1–10,9); p=0,035) и в группе 3 – 8/18 (44,4%) (OШ1-3=2,9 (95% ДИ 1,0–9,3); р=0,055), что соответствуют данным литературы [3, 4, 15].
Был проведен анализ течения беременности и родов. Значимые осложнения течения беременности, такие как гестационный сахарный диабет, задержка роста плода, патология околоплодных вод отмечались преимущественно в группе 1 (р1-2-3<0,05). Причем нарушение роста и развития плода отмечалось только в группе 1 – 10/44 (22,7%) и не отмечалось в группах 2 и 3 (р1-3=0,028, р1-2=0,032).
Показатели артериального давления были выше у пациенток группы 1, чем в группе с ХАГ, что, по-видимому, обусловлено плановой терапией гипертензивных нарушений у женщин группы 2 на этапе подготовки к беременности и коррекцией поддерживающей терапии с ранних сроков беременности.
На момент поступления пациентки в стационар цифры систолического артериального давления (M (SD)) в группе 1 – 154,8 (9,4) мм рт. ст., в группе 2 – 141,2 (8,6) мм рт. ст., в группе 3 – 114,0 (7,7) мм рт. ст. (р1-2-3<0,001). Диастолическое артериальное давление в группе 1 – 98,3 (5,7) мм рт. ст., в группе 2 – 93,6 (4,4) мм рт. ст., в группе 3 – 72,7 (6,6) мм рт. ст. (р1-2-3<0,001).
Гематологические нарушения (анемия и тромбоцитопения) отмечались преимущественно в III триместре беременности. Анемия встречалась чаще у пациенток группы 3 – 5/18 (27,8%) по сравнению с группой ХАГ – 1/17 (5,98%), ОШ2-3=6,2 (95% ДИ 0,6–59,5), р2-3=0,086, и с группой ПЭ – 2/44 (4,5%), ОШ1-2=8,1 (95% ДИ 1,4–46,7), р1-3=0,009. В то время как тромбоцитопения чаще встречалась у пациенток группы 1: 14/44 (31,8%), 1/17 (5,9%) и 2/17 (11,1%), ОШ1-2=7,5 (95% ДИ 0,9–62,1), р1-2=0,035, ОШ1-3=3,7 (95% ДИ 0,8–18,5), р1-3=0,091.
При изучении лабораторных данных уровень протеинурии был значительно выше в группе ПЭ по сравнению с группой контроля и ХАГ. Так, в группе 1 уровень протеинурии (M (SD)) составил 2,03 (1,79) г/л, в группе 2 – 0,039 (0,007) г/л, в группе 3 – 0,002 (0,001) г/л (р1-2-3<0,001).
Статистически значимых отличий в способе родоразрешения в группах выявлено не было. Частота операции кесарева сечения составила в группе 2 9/17 (52,9%), в группе 3 – 10/18 (55,6%), в группе 1 – 33/44 (75,0%); OШ1-2=2,7 (95% ДИ 0,8–8,6), р1-2=0,096, OШ1-3=2,4 (95% ДИ 0,7–7,6), р1-3=0,132.
Во всех исследуемых группах роды закончились рождением живого ребенка. Срок родоразрешения (M (SD)) был выше в группе контроля – 272,8 (7,66) дня по сравнению с группой ХАГ – 262,1 (24,6) дня и с группой ПЭ – 246,9 (45,2) дня (р1-2-3<0,001).
На втором этапе исследования был проведен пептидный анализ образцов мочи 79 женщин (1 группа (ПЭ) – n=44, 2 группа (ХАГ) – n=17, 3 группа (контроль) – n=18).
Всего было обнаружено 1552 пептида мочи. В пептидоме мочи пептиды SERPINA1 (n=50) занимали второе место после пептидов цепи коллаген-альфа-1. Эти пептиды, как было доказано в более ранних работах [11], ассоциировались с гипертензивными расстройствами во время беременности. Однако всего 7 из этих пептидов были специфичны для ПЭ и не выявлялись в контрольной группе и группе с ХАГ.
Было установлено, что специфические пептиды, ассоциированные с ПЭ, выявлялись не у всех пациенток группы 1. Исходя из этого, в зависимости от их выявления группа беременных с ПЭ была разделена на 2 подгруппы: 1а (n=23) – ПЭ, SERPINA1 положительный (ПЭ Ser+) и 1б (n=21) – ПЭ, SERPINA1 отрицательный (ПЭ Ser-). При этом было выявлено, что пациентки группы 1, которые развивали ПЭ на фоне ХАГ (ПЭ+ХАГ) были Ser- (подгруппа 1б).
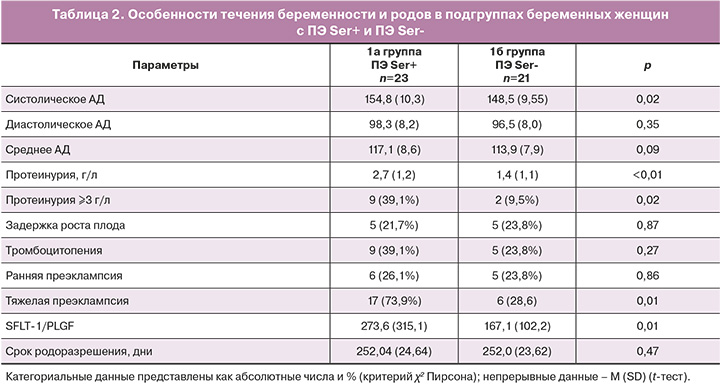
Полученные результаты пациенток с ПЭ имели различия по данным клинических проявлений и тяжести ПЭ, показателям артериального давления и SFLT-1/PLGF, уровня протеинурии, тромбоцитопении, а также срокам родоразрешения (табл. 2).
По данным литературы [3, 12], имеются сведения о более благоприятном течении ПЭ на фоне ХАГ. Однако провести дифференциальную диагностику между различными гипертензивными расстройствами во время беременности и/или их сочетанию не всегда представляется возможным. Отсутствие пептидов SERPINA1 в моче беременных может стать предиктором благоприятного исхода у беременной женщины с развитием ПЭ и, соответственно, позволит определить акушерскую тактику наблюдения за состоянием беременной женщины, возможность пролонгировать беременность и/или необходимость в досрочном родоразрешении.
Выявление SERPINA1 в моче беременных женщин в группах 1а (ПЭ Ser+) и 1б (ПЭ Ser-) ассоциировалось со степенью повышения артериального давления (154,8 (10,3) мм рт. ст. и 148,5 (9,55) мм рт. ст. по группам соответственно, р=0,02), протеинурии (2,7 (1,2) г/л и 1,4 (1,1) г/л, р<0,01), показателями SFLT-1/PLGF (273,6±315,1 и 167,1±102,2, р<0,01), а также тяжестью ПЭ (17/23 (73,9%) и 6/21 (28,6%), р<0,01). Таким образом, полученные данные показывают, что диагностический потенциал данного показателя (SERPINA1) в моче беременных для прогнозирования тяжести ПЭ у беременной женщины достаточно высок.
На третьем этапе мы провели сравнительный анализ состояния здоровья новорожденных детей у матерей исследуемых групп. Новорожденные у матерей групп 2 и 3 рождались преимущественно доношенными. Гестационный возраст в группе 2 – 37,4 (2,9) недели, в группе 3 – 38,96 (1,1) недели, в группе 1 гестационный возраст новорожденных был ниже – 36,0 (3,49), р1-2-3<0,001. Недоношенными были рождены 24/44 (54,5%) новорожденных у матерей с ПЭ, 2/17 (11,7%) в группе ХАГ – OШ1-2 =9,0 (95% ДИ 1,8–44,1), р=0,003, в группе 3 все новорожденные рождены при доношенном сроке беременности. В группе 1а – 14/23 (60,9%) новорожденных, в группе 1б – 10/21 (47,6%) детей, что обусловило необходимость проведения им интенсивной терапии и оказания первичной реанимационной помощи в родильном блоке. Статистически значимых различий между сроком родоразрешения в группах 1а и 1б выявлено не было – M (SD) 36,0 (3,5) недели и 36,0 (3,4) недели по группам соответственно, р=0,467. Однако рождение ребенка с низкой массой тела отмечалось преимущественно в группе у матерей с течением ПЭ Ser+.
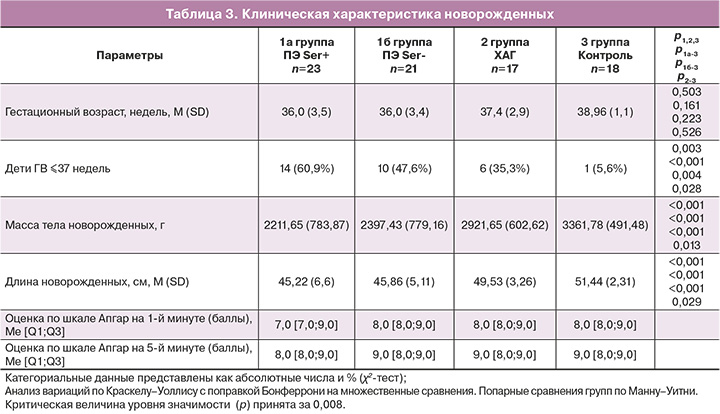
Как видно из данных, представленных в таблице 3, масса тела новорожденных в группе 1а составила 2211,65 (783,87) г, в группе 1б – 2397,43 (779,16) г, в группе 2 (ХАГ) – 2921,65 (602,62) г, в группе 3 – 3361,78 (491,48) г. Масса тела новорожденных была ниже в группе новорожденных у матерей с ПЭ по сравнению с группой 2 (р<0,001) и группой 3 (р<0,001), а также у новорожденных группы 2 по сравнению с группой 3 (р=0,014). Статистически значимых различий между группами 1а и 1б выявлено не было (р=0,378).
Асфиксия тяжелой и умеренной степени отмечалась только в группе новорожденных у матерей с ПЭ – 10/44 (22,7%). Несмотря на имеющиеся сведения о прогностически более легком течении ПЭ на фоне ХАГ [12], асфиксия тяжелой и умеренной степени у новорожденных отмечалась у новорожденных 1а и 1б групп примерно в одинаковом количестве случаев (1а группа – 5/23 (21,7%), 1б группа – 5/21 (23,8%); р=0,87).
Выявление пептидов SERPINA1 в моче беременных имело обратную зависимость с оценкой состояния по шкале Апгар на 1-й минуте: в ПЭ Ser+ группе –7,0 [7;9] балла, в ПЭ Ser- группе – 8,0 [8,0;9,0] балла, в группе ХАГ– 8,0 [8,0;9,0] балла, в группе сравнения – 8,0 [8,0;9,0] балла.
Неонатальная смерть на 13-е сутки жизни отмечалась в одном случае у новорожденного группы 1а, что составило 4,3%. Причиной явилось тяжелое течение раннего неонатального сепсиса, сопровождавшегося развитием ДВС-синдрома с полиорганной недостаточностью на фоне крайней недоношенности и экстремально низкой массы тела (ГВ новорожденного 28 недель, масса тела 745 г).
В структуре заболеваемости у новорожденных исследуемых групп отмечалось преобладание дыхательных нарушений, инфекционной патологии, гематологических и метаболических нарушений у новорожденных группы 1.
Из данных литературы известно, что предрасполагающими факторами риска при ПЭ, приводящими к рождению недоношенного ребенка и/или ребенка с задержкой внутриутробного развития, являются плацентарная ишемия и гипоперфузия плаценты [4, 13]. Было отмечено, что новорожденные группы ПЭ Ser+ в 11/23 (47,8%) родились маловесными к сроку гестации. Этот показатель был выше по сравнению с группой ПЭ Ser- – 3/21 (14,3%), ОШ1а-1б=5,5 (95% ДИ 1,3–23,9), р=0,018, с группой ХАГ – 1/17 (5,6%), ОШ 1а-2=14,7 (95% ДИ 1,7–129,7), р=0,002 и контрольной группой – 1/18 (5,6%), ОШ1а-3=15,6 (95% ДИ 1,8–137,4), р=0,003.
Дыхательные нарушения чаще отмечались у новорожденных в группе 1а (ПЭ Ser+) – 4/23 (17,4%), в группе 1б – 1/21 (4,8%), р=0,207, в группе 2 – 1/17 (5,9%), р=0,228, в группе контроля дыхательных нарушений, потребовавших проведения респираторной терапии в раннем неонатальном периоде, выявлено не было, р1а-3=0,063. Дыхательные нарушения, развившиеся у новорожденных исследуемых групп, носили преимущественно транзиторный характер.
Инфекционно-воспалительные заболевания преобладали в группе 1 – 17/44 (38,6%), значимых различий в частоте врожденной инфекции у новорожденных в группах 1а и 1б выявлено не было: (8/23 (34,8%) и 9/21 (42,9%) соответственно по подгруппам, р=0,583). Частота врожденной инфекционной патологии в группе 2 была ниже, чем в группе 1, и составила 2/17 (11,8%), ОШ1-2=3,9 (95% ДИ 0,8–19,2), р=0,082. У новорожденных от матерей с благополучно протекающей беременностью данных за течение инфекционного процесса не получено, р1-3=0,002, р2-3=0,134. Некротизирующий энтероколит встречался исключительно у новорожденных группы 1 примерно в равном проценте случаев: в группе 1а – 1/23 (4,4%), в группе 1б – 1/21 (4,8%), р1а-1б=0,948.
Патология центральной нервной системы у детей, рожденных у матерей с ПЭ, отмечалась в 13/44 (29,5%) случаев, что выше (ОШ1-2=3,1 (95% ДИ 0,6–15,7), р1-2=0,149), чем в группе ХАГ – 2/17 (11,8%) и в группе 3 – 1/18 (5,6%), ОШ1-3=7,1 (95% ДИ 1,1–59,2), р1-3=0,041. Следует обратить внимание, что значимые нарушения (внутрижелудочковые кровоизлияния 2–3 степени, внутричерепные кровоизлияния) отмечались лишь в группе 1а (у матерей с течением ПЭ Ser+) – 3/23 (13,0%) случаев, что, вероятнее всего, связано с развитием тромбоцитопении как одного из проявлений ПЭ.
Гипогликемия, развившаяся после рождения и потребовавшая парентеральной коррекции в первые часы жизни, отмечалась у 5/44 (11,4%) новорожденных группы 1. По данным литературы [14], метаболические нарушения, такие как гипогликемия, характерны для детей у матерей с ПЭ. Однако в нашем исследовании неонатальная гипогликемия развивалась только у новорожденных группы 1а и не отмечалась в группе 1б при появлении ПЭ на фоне ХАГ. В группе 2 (ХАГ) гипогликемия отмечалась в 1 случае (5,9%), ОШ1а-2=4,4 (95% ДИ 0,5–42,2), р1а-2=0,146. В группе контроля у новорожденных не отмечалось развития метаболических нарушений, р1-3=0,035.
Гематологические нарушения чаще отмечались в группе новорожденных у матерей ПЭ Ser+ – 14/23 (60,9%) по сравнению с группой ПЭ Ser- – 7/21 (33,3%), ОШ1а-1б=3,1 (95% ДИ 0,9–10,7), р1а-1б=0,068), группой ХАГ – 3/17 (17,6%), ОШ1а-2=7,3 (95% ДИ 1,6–32,6), р1а-2=0,007 и группой контроля – 1/18 (5,6%), ОШ1а-3=26,4 (95% ДИ 3,0–234,8), р1а-3<0,001.
Среди гематологических нарушений в исследуемых группах встречались: врожденная анемия (группа 1а – 2/23 (8,7%); группа 1б – 3/21 (14,3%); группа 2 – 2/17 (11,8%)), полицитемия новорожденных (группа 1а – 4/23 (17,4%); группа 1б – 2/21 (9,5%); группа 2 – 1/17 (5,9%)), тромбоцитопения (группа 1а – 6/23 (26,1%); группа 3 – 1/18 (5,6%)), нейтропения (группа 1а – 2/23 (8,7%); группа 1б – 2/21 (9,5%)). Преобладание анемии отмечалось в группах новорожденных у матерей с течением беременности на фоне ХАГ, в то время как у новорожденных от матерей с течением ПЭ Ser+ отмечалось повышение частоты развития полицитемии и тромбоцитопении, как видно из представленных данных.
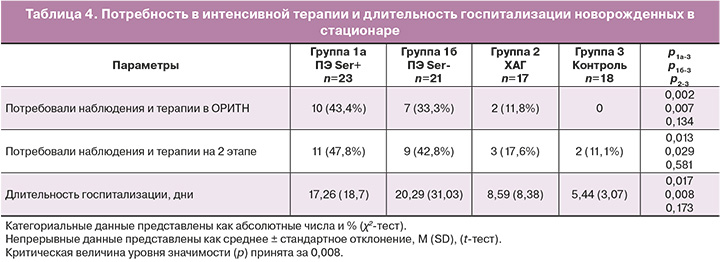
Как видно из данных, приведенных в таблице 3, длительность госпитализации была выше в группе новорожденных у матерей с ПЭ (р<0,01): в группе 1а – 17,26 (18,7) дня и в группе 1б – 20,29 (31,03) дня; в группе 2 – 8,59 (8,38) дня; в группе контроля – 5,44 (3,07) дня. Пребывание новорожденных в отделении физиологии новорожденных имело сопоставимые значения: в группе 1а – 3,71 (2,89) дня, группе 1б – 4,93 (1,6) дня; в группе 2 – 4,8 (1,42) дня, в группе 3 – 4,0 (1,2) дня. Новорожденные от матерей с ПЭ Ser+ имели более длительный период выхаживания и наблюдения в отделении патологии новорожденных, дети, рожденные у матерей с ПЭ Ser- требовали более длительного наблюдения в отделении интенсивной терапии.
Обсуждение
ПЭ до сих пор остается наиболее грозным патологическим состоянием, ассоциированным с беременностью, которое является основной причиной материнской заболеваемости и смертности [1–4]. Нарастание тяжести ПЭ значительно увеличивает риск неблагоприятных исходов беременности, ухудшения перинатальных и неонатальных исходов [4, 8, 15].
По данным ВОЗ [3], приоритетной задачей при ПЭ является пролонгирование беременности до более доношенного срока, что повышает шанс ребенка на выживание. Однако пролонгирование беременности, особенно при ранней форме ПЭ (на сроке до 34-й недели), часто сопряжено с риском быстрого прогрессирования патологических процессов в организме беременной женщины и развития грозных акушерских осложнений (эклампсия, HELLP-синдром, отек легких, острый жировой гепатоз, полиорганная недостаточность и др.) [2–4].
Единственным эффективным методом лечения ПЭ (особенно тяжелых форм), является родоразрешение. Однако риск рождения недоношенного ребенка и прогноз тяжелых перинатальных и неонатальных исходов диктуют необходимость поиска доступных и эффективных методов предикции развития ПЭ, тяжести этого состояния для принятия сложного решения по акушерской тактике ведения пациенток, а также критериев для определения показаний к срочному родоразрешению.
В качестве материала для исследований при ПЭ используются различные биологические среды, как, например, плазма или моча [6, 7, 16, 8–10]. В.Н Серов и соавт. [16] показали, что отношение SFLT1/PIGF в крови беременных является одним из высокочувствительных маркеров прогнозирования тяжести ПЭ.
В последние годы широко внедряются новые методы неинвазивной диагностики, основанные на молекулярно-генетических исследованиях. Особое внимание исследователей направлено на изучение пептидома мочи беременных женщин как более доступного неинвазивного метода диагностики [6–11].
В патогенезе ПЭ одними из ключевых моментов являются неполноценная инвазия трофобласта и неадекватное ремоделирование спиральных артерий, приводящие к плацентарной ишемии и интоксикации [4]. Физиологическим механизмом, участвующим в регуляции инвазии трофобласта, может быть экспрессия SERPINA1 (α-1-антитрипсина). При ПЭ, сопровождающейся гипоксией, происходит его трехкратное увеличение, особенно в цито- и синцитиотрофобласте, а также в децидуальной пластинке [6]. При этом параллельно значительно увеличивается количество депозитов плодного фибриноида, являющегося коагулятом белков плазмы крови, образующихся в ответ на повреждение, которые также накапливают SERPINA1 [6], что приводит к сокращению межворсинчатого пространства, структурному «блокированию» трофобласта, ограничению инвазии трофобласта в спиральные артерии матки. Это также способствует нарушению фето-плацентарного кровотока. Увеличение SERPINA1 рассматривается как защитный механизм при ПЭ в ответ на повреждение и плацентарную гипоксию за счет опосредованного участия в предотвращении распада коллагена [6, 7], системный воспалительный ответ [7, 13] за счет ингибирования продукции провоспалительных цитокинов. Доказанным фактом является апоптоз клеток трофобласта и стромы ворсин плаценты при ПЭ, что, вероятнее всего, приводит к высвобождению гранул SERPINA1 из плацентарных структур [7, 16]. N. Starodubtseva et al. [7] было установлено, что разрушение трофобласта и высвобождение протеинов SERPINA1 приводит к их увеличению в моче беременных, страдающих ПЭ, и ассоциируется с прогностически тяжелым течением.
Выявление пептидов SERPINA1 в моче, как показано и в нашем исследовании, ассоциируется с более тяжелым течением ПЭ и по сути разделяет ПЭ на 2 формы: истинная тяжелая ПЭ (или ПЭ с высоким риском тяжелого течения) и ПЭ на фоне ХАГ, которая характеризуется более легким течением и более благоприятными исходами для матери и ее новорожденного ребенка.
Мы установили, что у женщин ПЭ Ser+ отмечаются более высокие показатели артериального давления, выраженности протеинурии, соотношения SFLT1/PIGF. Развитие тяжелой ПЭ в 2,6 раза чаще отмечалось в группе 1а (ПЭ Ser+).
У женщин 1а группы в 1,3 раза чаще дети рождались недоношенными, чем в группе ПЭ Ser-, и имели более низкие показатели массы тела при рождении, что согласуется с данными литературы.
Более тяжелое течение ПЭ у новорожденных 1а группы в нашем исследовании приводило к рождению ребенка с более низкой оценкой по шкале Апгар, развитию гематологических нарушений (таких как тромбоцитопения и полицитемия), следствием которых явилось выявление тяжелых внутричерепных кровоизлияний у новорожденных, а также требующей парентеральной коррекции гипогликемии в раннем неонатальном периоде, что обусловливало необходимость оказания реанимационной помощи новорожденному в родильном зале, а также наблюдения в отделениях интенсивной терапии новорожденных и длительному выхаживанию в отделениях второго этапа.
По данным литературы [7, 16], при развитии тяжелой ПЭ происходит разрушение/апоптоз клеток трофобласта, при этом усиливается внутриутробная гипоксия плода и увеличивается попадание в кровоток плода высокотоксичных продуктов (продуктов перекисного окисления липидов, шиффовых оснований и диеновых конъюгатов и т.д.), которые, по-видимому, и приводят к гематологическим и метаболическим нарушениям в раннем неонатальном периоде. По данным литературы [15], тромбоцитопению у новорожденных связывают с явлениями внутриутробной гипоксии и подавлением гранулоцитарного колониестимулирующего фактора, хотя, безусловно, это утверждение нуждается в дополнительном изучении.
При ХАГ в плаценте мембрана трофобласта остается неповрежденной/интактной. Изменения структуры терминальных ворсин, дистрофические изменения, а также количество фибриноидных отложений менее выражены [7, 11]. И анемия у новорожденных, вероятнее всего, проявляется в ответ на проявления хронической внутриутробной гипоксии при ХАГ.
Выявление пептидов SERPINA1 в моче беременных женщин может рассматриваться как дополнительный диагностический критерий развития тяжелого течения ПЭ, а также как предиктор более тяжелых неонатальных исходов у новорожденных.
Заключение
Общепризнанно негативное влияние преэклампсии на состояние матери, плода и новорожденного. В связи с чем актуальным остается поиск диагностических маркеров, позволяющих прогнозировать развитие тяжелой преэклампсии, для своевременного начала терапии, коррекции патологических нарушений в организме беременной и профилактики неблагоприятных перинатальных/неонатальных исходов. Нами установлена взаимосвязь между выявлением пептидов SERPINA1 в моче беременных с более тяжелым течением преэклампсии. У SERPINA1-положительных беременных имеется высокий риск рождения недоношенного и маловесного к сроку гестации ребенка, с низкой оценкой состояния по шкале Апгар. Таким детям потребовалось оказание реанимационной помощи, длительное выхаживание в условиях отделения реанимации и патологии новорожденных. Развитие преэклампсии у матери, является фактором высоко риска развития гематологических, метаболических нарушений, развитию тяжелых внутричерепных кровоизлияний у новорожденного в течение раннего неонатального периода.
Таким образом, выявление пептидов SERPINA1 в моче беременных следует рассматривать как дополнительный диагностический критерий, предиктор рождения маловесного и/или недоношенного ребенка, с риском асфиксии при рождении, необходимость оказания реанимационных мероприятий в связи с асфиксией новорожденных, готовность проведения коррекции патологических нарушений (как, например, гипогликемия, полицитемия, тромбоцитопения) и необходимость наблюдения в специализированных отделениях реанимации, интенсивной терапии и патологии новорожденных.
В заключение хотелось бы отметить, что для подтверждения полученных результатов в данном исследовании необходимо продолжение исследований с остаточной статистической мощностью с большим размером выборки.



