Тактика лечения пациентов онкологического профиля в первую очередь определяется стадией заболевания. Для определения стадии рака молочной железы необходимо знать размеры опухоли в молочной железе, а также состояние регионарных лимфатических узлов, в том числе состояние парастернального лимфатического коллектора.
Информация о наличии или отсутствии метастазов во внутренних грудных лимфатических узлах является значимой в определении прогноза, а также в выборе тактики лечения, что в будущем сказывается на показателях выживаемости, продолжительности и качестве жизни больных. Так, согласно действующей восьмой классификации TNM [1], метастазы в парастернальных лимфатических узлах отнесены к уровню N2b, и при их изолированном метастатическом поражении клиническая стадия определяется как IIIА вне зависимости от размера опухоли. А стадия IIIА (за исключением T3, N1, M0) является первично неоперабельной (Inoperable Locally Advanced Breast Cancer) и, согласно рекомендациям NCCN от 2018 г., на первом этапе требует проведения химиотерапевтического лечения. В настоящее время отсутствует единый стандарт лучевой диагностики метастатического поражения парастернальных лимфатических узлов. В литературе встречаются описания успешного применения магнитно-резонансной (МРТ) и позитронно-эмиссионной компьютерной томографии (ПЭТ-КТ) в диагностике метастазов в парастернальных лимфатических узлах [2–8]. Задача данного исследования заключается в определении возможностей ультразвукового исследования в диагностике метастазов в парастернальных лимфатических узлах.
Материалы и методы
Материалом настоящего исследования послужил анализ комплексного обследования 55 женщин, наблюдавшихся в НМИЦ онкологии им. Н.Н. Блохина Минздрава России с диагнозом рак молочной железы, в период с 2017 по 2019 гг. В исследование были включены пациентки, проходившие обследование до начала лечения, а также больные, находившиеся на динамическом контроле после ранее проведенного комплексного лечения. Средний возраст пациенток составил 52,5 (3,2) года. Всем больным, находившимся на обследовании до лечения, проведено ультразвуковое исследование молочных желез и регионарных зон лимфатического оттока, включая парастернальный лимфатический коллектор. В группе динамического контроля проведено ультразвуковое исследование зоны послеоперационного рубца, контралатеральной молочной железы, а также регионарных зон, включая парастернальную зону лимфатического оттока. Ультразвуковое исследование выполнялось на аппарате экспертного класса Siemens Acuson S2000 высокочастотным линейным датчиком частотой 4–9 МГц и включало стандартный В-режим сканирования, эластометрию и эластографию сдвиговой волной. Исследование проводилось в положении пациента на спине, руки располагались вдоль тела. Датчик устанавливается параллельно межреберным промежуткам, медиальный край датчика – по краю грудины. Сканирование проводили начиная с I межреберья, далее двигаясь по межреберным промежуткам, вдоль края грудины до V межреберья. Вторым этапом датчик разворачивали на 90 градусов, располагая его поперечно межреберным промежуткам и параллельно грудине, повторяли сканирование от первого до пятого межреберья, осуществляя движения вдоль хрящевой части ребер от края грудины до места перехода хрящевой ткани в костную ткань ребер, в каждом из пяти межреберий. При исследовании оценивали контур плевры и наличие дополнительных объемных образований вдоль внутренних грудных сосудов, в межреберных промежутках и в позадиреберном пространстве. При анализе эластограмм светлые области соответствовали менее жесткой ткани, чем темные области (менее эластичные и более жесткие структуры). Эластография проводилось без компрессии, при задержке дыхания. Обязательным условием являлось установление окна-опроса не только в лимфатическом узле, но в окружающих тканях, для определения визуального различия жесткости тканей. Мы не использовали компрессионную эластографию, так как зона интереса находилась за ребрами и создать адекватную компрессию не представлялось возможным. С помощью точечной эластометрии сдвиговой волной измерялась скорость распространения сдвиговой волны (СРСВ) в лимфатическом узле и в окружающих тканях. Осмотр осуществлялся при положении датчика в межреберных промежутках параллельно проекции ребра и перпендикулярно поверхности кожи, без давления на поверхность кожных покровов, при задержке дыхания. Лимфатический узел помещался в центр окна-опроса, и проводилось измерение скорости сдвиговой волны. Полученные численные значения измерялись в метрах в секунду (м/с).
Статистический анализ
Статистический анализ полученных данных производился с помощью стандартных методов математико-статистической обработки с использованием программного обеспечения для ПК (MSOffice Excel, Statistica 10 и MedCalc (USA, 8.0 версия)). При характеристике выборок, удовлетворяющих критериям нормального распределения, использовали среднее значение и стандартное отклонение. Тест на нормальность распределения выполняли при помощи критерия W-критерия Шапиро–Уилка. Представленные в работе количественные данные имели нормальное распределение. Для оценки эффективности метода определения метастатически измененных лимфоузлов по данным предоперационной диагностики определяли чувствительность, специфичность и точность по формулам расчета статистических показателей. Чувствительность, специфичность, положительная и отрицательная прогностическая ценность, а также точность выражаются в процентах. Доверительные интервалы для чувствительности, специфичности и точности – это «точные» доверительные интервалы Клоппера–Пирсона. Различия между сравниваемыми величинами признавали статистически значимыми при уровне значимости р<0,05. Эффективность эластометрии оценивались при помощи ROC-анализа с подсчетом чувствительности (Se=а/(а+с)) и специфичности (Sp=d/(b+d)). Точки отсечки предложенной модели определялась при максимальной чувствительности и специфичности.
Результаты
По результатам морфологического исследования пациенты были разделены на две группы: первую группу (n=24) составили пациенты с метастатическим поражением, вторую группу (n=31) – пациенты с лимфоидной гиперплазией.
Для лимфатических узлов с лимфоидной гиперплазией средняя СРСВ в лимфатическом узле составила 2,14 (0,77) см/с, при метастатическом поражении – 3,13 (1,09) см/с, в окружающих тканях – 2,26 (0,71) см/с. Скорость распространения сдвиговой волны в метастазе была статистически выше (p<0,0001), чем в лимфатических узлах с гиперплазией и в окружающих тканях. При этом СРСВ в окружающих тканях и в лимфатических узлах с гиперплазией статистически не отличалась, и полученные данные были практически сопоставимы (p<0,0001).
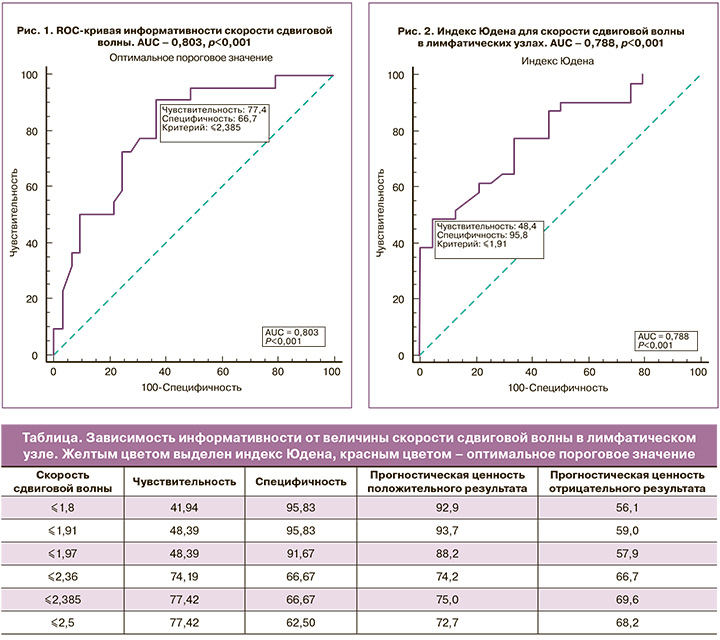
На рисунке 1 представлена ROC-кривая информативности скорости сдвиговой волны в лимфатических узлах, по которой было определено оптимальное пороговое значение СРСВ >2,385 м/с. Это позволило оптимально разграничить характер поражения лимфатического узла (доброкачественные изменения или метастатическое поражение). При данном пороговом значении СРСВ показатели информативности эластометрии составили: чувствительность – 77,4% (ДИ 95% 58,9–90,4), специфичность – 66,7% (ДИ 95% 44,7–84,4), прогностическая ценность положительного результата – 75,0%, прогностическая ценность отрицательного результата – 69,6%.
Также дополнительно вычислен индекс Юдена, показывающий вероятность принятия обоснованного решения, при котором пороговое значение СРСВ определено как >1,91 м/с (рис. 2), а показатели информативности для этого значения составили: чувствительность – 48,4% (ДИ 95% 30,2–66,9), специфичность – 95,8% (ДИ 95% 78,9–99,9), прогностическая ценность положительного результата – 93,7%, прогностическая ценность отрицательного результата – 59,0%.
Таким образом, при понижении порогового значения СРСВ до 1,91 см/с по сравнению с оптимальным значением, равным или большим 2,385 м/с, повышается специфичность методики, однако снижается ее чувствительность. Полученные данные отображены в таблице.
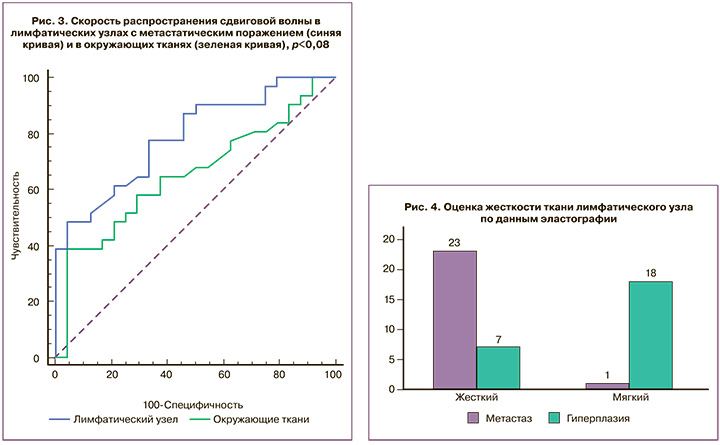
Сравнительный анализ СРСВ в окружающих тканях относительно СРСВ в парастернальных лимфатических узлах показал, что для лимфатических узлов с метастатическим поражением показатель СРСВ был выше в среднем на 1,01 (0,14) м/с. Полученные данные отображены на ROC-кривой (рис. 3).
При анализе результатов эластографии лимфатические узлы были разделены по консистенции на жесткие и мягкие (рис. 4). При метастатическом поражении жесткая консистенция определялась в 23 (95,8%) лимфатических узлах, и только в единичном случае (4,2%) лимфатический узел имел мягкую консистенцию. Для лимфатических узлов с гиперплазией в 7 (28,0%) случаях имел место жесткий тип эластограммы, а мягкая консистенция определялась в 18 (72,0%) случаях (p<0,05), показатели информативности эластографии для дифференциальной диагностики метастазов в парастернальных лимфатических узлах составили: чувствительность – 77,3%, специфичность – 69,7%, прогностическая ценность положительного результата – 63,0%, прогностическая ценность отрицательного результата – 82,1%.
Суммируя результаты применения всех методик, использованных в данном исследовании, необходимо отметить, что сочетание В-режима, эластометрии и эластографии сдвиговой волной имеют важное прогностическое значение. Информативность комплексного ультразвукового исследования имеет следующие показатели: чувствительность – 95,8%, специфичность – 92,6%, точность – 94,1%.
Обсуждение
Внедрение персонализированного подхода к лечению пациентов с раком молочной железы требует точных сведений о состоянии регионарных коллекторов. Это дает возможность оптимизировать лечение пациентов и в итоге повысить показатели безрецидивной выживаемости. Комплексное применение методик ультразвукового исследования позволяет оценить состояние регионарных лимфатических узлов парастернальной области. При анализе современных литературных данных зарубежных коллег, полученные в настоящем исследовании показатели СРСВ практически идентичны таковым в других исследованиях либо показатели близки к полученным в данном исследовании. Так, Takashi Fujiwara (2013) в исследовании 42 шейных лимфатических узлов (реактивные, n=22; метастатические, n=20) у 19 пациентов высчитал, что средняя СРСВ для реактивных лимфатических узлов составила 1,52 (0,48) м/с, для метастатических/злокачественных лимфатических узлов – 2,46 (0,75) м/с. Пороговое значение СРСВ >1,9 м/с может успешно применяться для классификации метастатических лимфатических узлов со специфичностью 95,0%, чувствительностью 81,8% и общей точностью 88,0% [9]. В другом аналогичном исследовании, проведенном Ghobad Azizi и соавт. (2016), включающем 270 лимфатических узлов у 236 пациентов, с помощью ROC-анализа определено пороговое значение СРСВ 2,93 м/с в качестве максимального значения СРСВ для прогнозирования злокачественности лимфатических узлов. Чувствительность и специфичность составили 92,59% и 75,46% соответственно, положительная прогностическая ценность (PPV) составила 48,54%, отрицательная прогностическая ценность (NPV) – 97,60% [10].
Заключение
Обобщая полученные данные, можно сделать вывод о том, что комплексное ультразвуковое исследование, включающее в себя эластографию и эластометрию сдвиговой волной, позволяет повысить информативность традиционного ультразвукового исследования и с высокой точностью дифференцировать метастатическое поражение парастернальных лимфатических узлов от неопухолевых изменений, что важно для определения последующей тактики лечения.



