В последние десятилетия частота врастания плаценты (placenta accreta) возросла в связи с эпидемией кесарева сечения [1–9]. Патологическое прикрепление плаценты к рубцовой ткани имеет клинико-морфологические характеристики, отличные от таковых при врастании в мышечную ткань [6, 7].
Еще в 1937 г. C. Irving и A.T. Hertig писали, что врастание плаценты в миометрий неоперированной матки наблюдается крайне редко [10].
Исходя из патоморфологической картины, принято выделять «placenta accrete» (ворсины прирастают непосредственно к миометрию ввиду частичного или полного отсутствия decidua basalis), «placenta increta» (ворсины проникают в миометрий), «placenta percreta» (затрагивается вся толща миометрия до серозной оболочки с возможным проникновением ворсин в соседние органы).
Термин «placenta accrete» многими авторами используется как для обозначения наличия патологически прикрепленной плаценты в целом (accreta, increta, percreta), так и для 1-го ее варианта. Врастание плаценты может быть тотальным (в патологический процесс вовлечена вся плацента), парциальным (затрагивающим один или несколько котиледонов) и фокальным (в пределах менее чем одного котиледона) [6, 7, 11].
В настоящее время акушерами пересматривается обобщающее понятие «placenta accreta». В современной литературе появляются новые термины, предлагаемые взамен старого, дабы избежать путаницы: «abnormally invasive placenta (AIP)» (F. Chantraine, J. Langhoff-Ross, 2013), «invasive placentation» (F. D’Antonio, C. Iacovella и соавт., 2013), «placental invasion» (K.M. Chalubinski, S. Pils и соавт.., 2013), «PACCRETA» (ACOG, 2013) [12–15]. В этих работах понятие «placenta accreta» употребляется только для отражения приращения плаценты к подлежащей ткани. Однако создается впечатление, что некоторыми авторами в рубрику «placenta accreta» включается и состояние, которое в классической отечественной литературе трактовали как «placenta adhаerens». F. Chantraine и соавт. (2013) указывали, что к placenta accretа относятся наблюдения, когда плацента с трудом, но может быть полностью удалена рукой либо путем кюретажа, как во время кесарева сечения, так и в III периоде родов. По мнению авторов, дальнейших хирургических манипуляций не требовалось [16].
Мы продолжаем применять термин «placenta accretа», когда попытка отделения плаценты приводит к профузному кровотечению, а при макроскопии ворсины прирастают к подлежащей ткани матки или рубца.
Несмотря на появившиеся возможности антенатальной диагностики placenta accreta и ее вариантов, «золотым стандартом» является патоморфологическое исследование, характеристики которого представлены в руководствах H. Fox и соавт. «Pathology of the Placenta» (2007) [7], K. Benirschke и соавт. «Pathology of the Human Placenta» (2012) [6].
Важные данные по изучению патогенеза врастания плаценты представили T.Y. Khong и соавт. (1987) и подтвердили P. Tantbirojn и соавт. (2008). При нормально формирующемся «диалоге» между плацентой и миометрием сосуды поверхностного слоя последнего подвергаются перестройке. Инвазия эндоваскулярного вневорсинчатого трофобласта в спиральные артериолы верхней трети миометрия превращает их в низкорезистентные высокоемкостные сосуды с расширенным просветом. Гиалинизированные стенки теряют мышечную оболочку и представлены эндоваскулярным трофобластом. При формировании placenta accreta ремоделирование затрагивает сосуды внешней части миометрия и прилежащие к серозной оболочке (радиально-аркуатной системы), что при попытке отделения плаценты является причиной массивного кровотечения, сложно поддающегося остановке [17, 18].
P. Tantbirojn и соавт. (2008) видели первостепенную роль патологии децидуальной оболочки в формировании врастания плаценты. Исследовав образцы placenta accreta/percreta в первом триместре, авторы обнаружили отсутствие decidua. Этот факт отвергает предположение об ее нормальном состоянии изначально и атрофии при прогрессировании беременности [18].
K. Benirschke и соавт. (2012) [6] отметили, что понятие «инвазия» должным образом не отражает сути патологического процесса, трактовать происходящее нужно следующим образом. После предшествующего кесарева сечения матка быстро подвергается инволюции, так что новые миоциты образоваться не успевают. Рассеченные или насильственно раздвинутые мышцы «заживают» путем формирования рубцовой ткани, а не за счет регенерации миометрия, как полагали раньше. При наступлении беременности и нидации плодного яйца вблизи или поверх тонкого фиброзного рубца последний «расползается», обеспечивая протрузию плаценты и ее прикрепление к брюшине. Таким образом, при наличии рубца на матке имитируется инвазия при placenta percreta.
Целью работы стало сопоставление клинической картины врастания плаценты с патоморфологической характеристикой у пациенток с рубцом на матке в сочетании с предлежанием плаценты.
Предполагается, что знание особенностей взаимоотношения плаценты и рубцовой ткани после кесарева сечения будет способствовать поиску вариантов органосохраняющих операций на матке.
Материал и методы исследования
В ретроспективное исследование вошли пациентки, родоразрешенные в Центре планирования семьи и репродукции Департамента здравоохранения г. Москвы, Перинатальном медицинском центре г. Москвы и Клиническом госпитале Лапино с 2010 по 2014 гг.
Критериями включения были: 1) рубец на матке после операции кесарева сечения; 2) предлежание плаценты, локализующейся на передней стенке матки и в области рубца; 3) подтверждение диагноза placenta accreta при патоморфологическом исследовании; 4) срок беременности ≥28 нед.
Из исследования исключались пациентки, у которых предлежащая плацента располагалась на задней стенке матки, и срок гестации на момент родов был менее 28 нед.
При патоморфологическом исследовании все плаценты, участки резецированного миометрия или удаленные матки изучались макроскопически, затем образцы тканей фиксировались 10% буферным раствором формалина не менее чем на 24 часа. По окончании 17-часовой классической проводки материала формировались стандартные парафиновые блоки, из которых получали срезы толщиной 5 μm. Срезы окрашивали гематоксилином и эозином и по van Gieson.
Результаты исследования представлены как средние или медианы для непрерывных и как проценты для дискретных величин.
Критериям включения соответствовали 104 пациентки.
Возраст обследованных составил 33,9±4,6 года (от 20 до 45 лет). Соматический анамнез отягощен артериальной гипертензией у 5 (4,8%), хроническим пиелонефритом у 8 (7,7%), варикозным расширением вен у 14 (13,5%). При анализе гинекологических заболеваний субсерозная миома матки встречалась у 11 (10,6%) пациенток.
Данная беременность наступила в результате использования вспомогательных репродуктивных технологий (ЭКО) у 3 (2,9%). Беременность двойней была у 2 (1,9%).
Все 104 пациентки в анамнезе имели кесарево сечение. Рубец после одной операции был у 51 (49%), после двух операций – у 36 (34,7%), после трех – у 15 (14,4%), после четырех – у 2 (1,9%) женщин. 59 (56,7%) пациенток имели в анамнезе от 1 до 8 артифициальных или самопроизвольных абортов.
Всем беременным проводилось ультразвуковое исследование с цветовым допплеровским картированием. Эхографическими признаками врастания плаценты считались: наличие плацентарных лакун, облитерация гипоэхогенной зоны между плацентой и миометрием, истончение миометрия менее 1 мм, отсутствие четкой границы между стенкой матки и мочевым пузырем.
61 (58,7%) пациентке выполнена магнитно-резонансная томография. У 41 (39,4%) обследованных выявлены МР-признаки врастания плаценты. К ним относят: наличие сосудов, идущих перпендикулярно стенке матки и/или выходящих за ее контур, сосудистые плацентарные лакуны, истончение миометрия.
1 пациентке с микрогематурией и подозрением на врастание плаценты в заднюю стенку мочевого пузыря произведена цистоскопия, при которой выявлены расширенные сосуды, выбухающие в просвет пузыря.
Срок беременности на момент родов составлял: 28–34 недель – у 15 (14,4%), 35–39 недель – у 89 (85,6%) пациенток. В плановом порядке родоразрешены 76 (73,1%) беременных, в связи с началом родовой деятельности – 13 (12,5%), в экстренном порядке, учитывая кровотечение, – 15 (14,4%).
Донный разрез на матке во время кесарева сечения произведен у 77 (74%) пациенток, в нижнем маточном сегменте – у 23 (22,1%), корпоральный – у 4 (3,9%).
После извлечения плода с целью гемостаза эмболизация маточных артерий (ЭМА) произведена у 45 (43,3%) пациенток, временная баллонная окклюзия общих подвздошных артерий – у 22 (21,2%), перевязка внутренних подвздошных артерий – у 2 (1,9%). При незначительной площади врастания плаценты хорошим гемостатическим эффектом обладали швы, накладываемые на плацентарное ложе со стороны полости матки – у 35 (33,6%).
Интраоперационная кровопотеря и варианты гемостаза представлены в таблице.
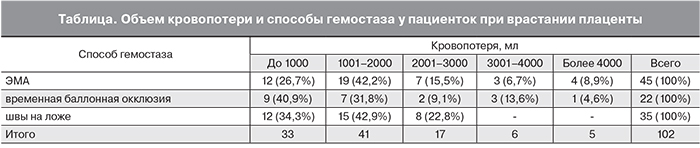
При ЭМА кровопотеря составила 1963±1304 (от 400 до 5500) мл, при временной баллонной окклюзии общих подвздошных артерий – 1718±1159 (от 400 до 4200) мл, при наложении швов на плацентарное ложе – 1605±661 (от 800 до 3000) мл. В таблицу не включены 2 пациентки с перевязкой внутренних подвздошных артерий, кровопотеря у которых была 700 и 2100 мл.
Как следует из данных таблицы, у 74 (72,5%) пациенток кровопотеря не превышала 2000 мл, у 91 (89,2%) – была не более 3000 мл. Кровопотеря свыше 3000 мл при временной баллонной окклюзии общих подвздошных артерий была связана с освоением метода.
Наименьшая кровопотеря зафиксирована при наложении швов на плацентарное ложе, что естественно, так как этот способ гемостаза используется только при небольшой площади врастания плаценты.
Аппаратная реинфузия аутоэритроцитов проводилась у 101 (97,1%) пациентки. Объем аутоэритровзвеси составил 250–4100 мл.
У 95 (91,3%) пациенток произведена метропластика, заключавшаяся в иссечении измененной ткани матки с приросшей плацентой в пределах здорового миометрия. У 12 (11,5%) пациенток потребовалась резекция мочевого пузыря из-за невозможности его отделения.
Материнской и перинатальной смертности не было.
Результаты исследования и обсуждение
У всех 104 пациенток врастание плаценты подтверждено патоморфологически. Основным гистологическим признаком врастания плаценты является истончение или полное отсутствие децидуальной ткани на участке аномального прикрепления ворсин. Плацентарное ложе может одновременно иметь участки с сохраненной decidua basalis, где происходит отделение плаценты, и зоны прирастания плаценты (рисунок a, см. на вклейке).
Мы не встретили ни у одной пациентки тотальную placenta accreta. У подавляющего большинства обследованных – 97 (93,3%) – выявлена парциальная placenta accreta, у 7 (6,7%) – фокальная.
Маточный рубец в зоне имплантации плодного яйца характеризуется разной морфологической картиной в зависимости от объема соединительной ткани, замещающей гладкомышечную. Во всех случаях базальная (децидуальная) пластина деформирована, имеет разную толщину с небольшими по протяженности участками ее замещения фибриноидом (слой Nitabuch), который как бы «приклеивает» ворсины материнской поверхности плаценты к стенке матки в зоне маточного рубца (рисунок b, см. на вклейке). Децидуальная пластина может отсутствовать вовсе, и ворсины непосредственно прилежат к миометрию, препятствуя их отделения в III периоде родов. Гистологически выявляется волнообразная граница в месте прилегания ворсин к области рубца на матке. Возможно, причиной является неадекватное сопоставление краев раны на матке при кесаревом сечении, в результате которого формируется грубая соединительная ткань. Эта зона со стороны полости матки имеет зубчатую поверхность, форму которой повторяет прилежащая плацента, иногда с глубокими нишами в толще рубца, имитируя placenta increta (рисунок c, см. на вклейке).
Деформация стенки матки в области рубца может быть столь значительной, что участки погружения плацентарной ткани в имеющиеся углубления создают впечатление глубокого врастания плаценты (рисунок d, см. на вклейке).
Placenta percreta, согласно классическому акушерству, диагностируется в ситуациях, когда ворсины полностью пенетрируют стенку матки, доходя до серозной оболочки и иногда проникая в смежные органы. По нашим данным при наличии несостоятельного рубца placenta accreta представлена выпячиванием стенки матки (аневризма), содержащим плаценту. Область рубца часто крайне истончена в результате его расхождения (до 0,2–0,3 мм), не содержит миометрия и представлена фиброзной тканью, покрытой брюшиной, к которой прикреплены ворсины хориона (рисунок e, см. на вклейке).
Дополнительным признаком врастания плаценты по вскрытии брюшной полости становятся резко расширенные полнокровные сосудистые коллекторы зоны плацентарного ложа. Подвергшиеся гестационной перестройке в результате эндоваскулярной инвазии хориального эпителия эти сосуды аномально выбухают на поверхности матки, деформируя ее стенку и серозную оболочку. Их полнокровие неизбежно для обеспечения адекватного маточно-плацентарного кровотока, а резистентность артериям создает фибриноид, который замещает мышечную оболочку стенок. Усугублением подобной ситуации является спаечный процесс между стенкой матки и мочевым пузырем, сосуды которого также подвергаются гестационной перестройке и содержат в стенках, а также в мышечной ткани элементы инвазивного хориального эпителия (не ворсины!). Такие расширенные полнокровные сосуды могут выбухать в сторону слизистой оболочки мочевого пузыря, создавая при цистоскопии эффект врастания плаценты. В случае иссечения такого участка гистологическая картина имеет трехслойный вид: плацента – маточный рубец – стенка мочевого пузыря (рисунок f, см. на вклейке).
Полученные нами данные в отношении placenta percreta подтверждают точку зрения ведущих патологов H. Fox, N.J. Sebire (2007), K. Benirschke и соавт. (2012) [6, 7] об отсутствии истинного проникновения плаценты в мочевой пузырь. Интраоперационно отделить мочевой пузырь от рубца на матке не удается и производится резекция его ткани (12 наблюдений).
Заключение
Врастание предлежащей плаценты в рубцовую ткань после кесарева сечения отличается от такового при врастании в мышцу матки и по частоте встречаемости, и по качеству взаимоотношения трофобласта с подлежащей тканью.
При проведенном патоморфологическом исследовании и использовании доступных нам методов окраски гистологических срезов установить врастание плаценты в стенку мочевого пузыря не представляется возможным. Затруднение отделения плаценты от мочевого пузыря является показанием к резекции его стенки.
Проведенный нами анализ свидетельствует о возможности и целесообразности органосохраняющих операций при патологическом прикреплении плаценты к рубцово-измененному миометрию. Для снижения интраоперационной кровопотери могут быть использованы как эндоваскулярные методы блокады кровотока, так и швы на ложе плаценты. Наиболее эффективным является временная баллонная окклюзия общих подвздошных артерий.



