Сокращение случаев материнской смертности является приоритетной задачей акушерства и гинекологии. По данным Всемирной организации здравоохранения, ведущая роль в структуре материнской смертности принадлежит массивным акушерским кровотечениям, занимающим от 18,6 до 36% случаев, существенный вклад в долю которых вносят нарушения плацентации: 20% случаев приходится на плотное прикрепление плаценты, 10% – на предлежание и 7% – на врастание плаценты [1–4]. Неуклонный рост частоты проведения кесарева сечения во всем мире способствует увеличению количества случаев врастания плаценты: у женщин с оперативным родоразрешением в анамнезе риск врастания плаценты увеличивается с 11% после первой операции до 60% после трех и более операций кесарева сечения [5, 6].
При родоразрешении беременной с врастанием плаценты реализуются три основных подхода: выполнение одномоментной или отсроченной органоуносящей операции, проведение органосохраняющей операции, а также консервативная выжидательная тактика с оставлением плаценты in situ [7–10]. Органосохраняющая хирургия при врастании плаценты имеет несомненные преимущества: сохранение репродуктивного потенциала, снижение величины интраоперационной кровопотери и трансфузионной терапии, относительно более быстрая реабилитация. Однако, несмотря на развитие современных технологий, процент выполняемых гистерэктомий по акушерским показаниям остается достаточно высоким: 134,2 на 100 тыс. родов [7, 11, 12]. Совершенствование методик органосохраняющих операций остается актуальной задачей современного акушерства.
В настоящем исследовании обобщен опыт хирургической тактики родоразрешения беременных с врастанием плаценты в ГБУ РО «Перинатальный центр» за 2019–2021 гг. Целью исследования явилось проведение анализа эффективности двух методик родоразрешения при врастании плаценты, применяемых в ГБУ РО «Перинатальный центр».
Материалы и методы
Проведен ретроспективный сравнительный анализ исходов 57 наблюдений оперативного родоразрешения путем кесарева сечения по поводу врастания плаценты за период 2019–2021 гг. в ГБУ РО «Перинатальный центр».
В 2019–2021 гг. в ГБУ РО «Перинатальный центр» были родоразрешены 14 975 беременных (100%). Оперативное родоразрешение было выполнено 5873/14 975 (39,2%) пациенткам, из которых у 66/5873 (1,1%) показанием к операции явилось врастание плаценты. Проводился клинико-анамнестический анализ медицинской документации всех беременных женщин, включенных в исследование. Критерии включения: 1) рубец на матке после операции кесарева сечения; 2) подтвержденный диагноз placenta increta по данным гистологического исследования. В исследование не включались 20 беременных с антенатально выявленной несостоятельностью рубца на матке, 3 беременные с антенатально выявленным врастанием плаценты с последующим гистологическим подтверждением диагноза placenta percreta и 6 – с интраоперационно выявленным врастанием плаценты (с гистологической верификацией placenta increta у 1 пациентки; placenta accreta – у 5).
Диагноз «врастание плаценты» устанавливался антенатально по данным ультразвукового исследования и допплерографии; определяли ультразвуковые признаки врастания и размер плацентарного дефекта. В 12/57 (21%) случаях для подтверждения диагноза потребовалось проведение магнитно-резонансной томографии.
Всем беременным, включенным в исследование, проводилось плановое оперативное вмешательство в объеме нижнесрединной лапаротомии. Исходя из полученных ультразвуковых и интраоперационных данных и, соответственно, применяемой различной техники оперативного вмешательства, все пациентки (57; 100%) были разделены на 2 группы.
Первую группу составили 32/57 (56,1%) пациентки, у которых по данным ультразвукового исследования наблюдали плацентарный дефект <120 мм в наибольшем диаметре и отсутствие трудностей при отсепаровке мочевого пузыря. В данной группе проводилась интраоперационная ультразвуковая навигация с целью определения верхнего края плаценты. После чего выше верхнего края маточной аневризмы обнаруживали «окно» в стенке матки, свободное от плацентарной ткани, в котором впоследствии выполнялся разрез. Рассекалась пузырно-маточная складка с отсепаровкой и дистальным низведением мочевого пузыря, после чего выполняли кесарево сечение в нижнем маточном сегменте согласно полученным данным, наложение дистального гемостаза, метропластику.
Во 2-ю группу вошли 25/57 (43,9%) пациенток с размером плацентарного дефекта >120 мм в наибольшем диаметре, что требовало больше времени для тщательного низведения мочевого пузыря с целью визуализации нижнего края неизмененного миометрия и не позволяло использовать надплацентарный доступ. Пациенткам 2-й группы проводились корпоральное кесарево сечение для извлечения плода (плацента остается in situ), ушивание разреза на матке; после чего накладывали дистальный гемостаз, рассекали пузырно-маточную складку, выполняли второй разрез на матке выше грыжевого выпячивания с последующей метропластикой. В качестве одного из основных этапов операции у пациенток обеих групп (57; 100%) применялся дистальный гемостаз, включающий наложение силиконового жгута (катетера Фолея) на уровне нижнего края маточной аневризмы с вовлечением маточных артерий и крестцово-маточных связок.
Эффективность техники оперативного вмешательства оценивали по следующим критериям: разрезу на матке, перевязке сосудов, кровоснабжающих матку, объему кровопотери, объему и структуре трансфузионной терапии, изменению уровня гемоглобина до и после оперативного вмешательства, времени операции, длительности пребывания в стационаре после родоразрешения.
Статистический анализ
Статистический анализ производился с помощью пакета программ R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Проверка данных на нормальность распределения была выполнена с помощью теста Шапиро–Уилка. Вычисляли средние значения и средние квадратические отклонения, медиану и квартили, минимальные и максимальные значения в выборке для количественных показателей; для качественных показателей – частоты встречаемости и процентную долю. Сравнение количественных показателей в группах проводилось с помощью теста Манна–Уитни, частот – с помощью точного теста Фишера. Для итоговой оценки изучаемых клинических исходов строили таблицы сопряженности и рассчитывали разность рисков (РР) с 95% доверительным интервалом (ДИ) для бинарных признаков, статистическую значимость оценивали методом точного теста Фишера. Различия считались статистически значимыми при уровне критерия значимости (p) <0,05.
Результаты
Все беременные с врастанием плаценты, включенные в исследование, были сопоставимы по демографическим, антропометрическим характеристикам, соматической и акушерско-гинекологической патологии (табл. 1). Средний возраст женщин составил 33,7 (4,93) года. Анализ показателей гемоглобина до операции не имел статистически значимых различий (в 1-й группе – 114 (12) г/л; во 2-й группе – 111 (8,06) г/л) (p=0,49) (табл. 1).
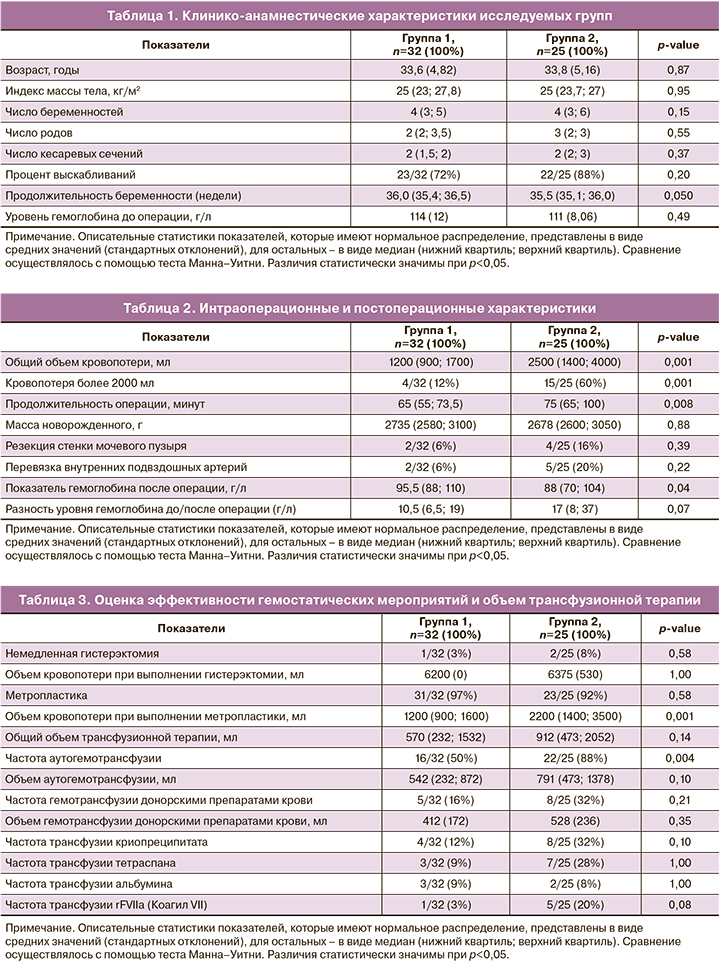
В соответствии с принятыми в данной работе критериями оценки эффективности оперативного вмешательства наилучший гемостатический эффект был получен в 1-й группе. Общий объем кровопотери был больше во 2-й группе и составил 2500 (1400; 4000) мл; в 1-й группе – 1200 (900; 1700) мл соответственно (p=0,001). При этом количество массивных кровопотерь объемом более 2000 мл было ниже в 1-й группе (4/32 (12%)), чем во 2-й (15/25 (60%)) (p<0,001), и величина показателя РР составила 47% (95% ДИ 23–67; p<0,001), что может быть связано с меньшей инвазивностью оперативного вмешательства, проводимого в 1-й группе (табл. 2).
Такие интраоперационные характеристики, как масса новорожденного, оценка по шкале Апгар на 1-й и 5-й минуте, статистически значимо не различались. Закономерно ввиду большего объема и этапности операции, проводимой во 2-й группе, ее длительность была больше, чем в 1-й (75 (65; 100) и 65 (55; 73,5) минут соответственно) (p=0,008) (табл. 2).
В клиническом анализе крови после операции показатель гемоглобина был ниже во 2-й группе (88 (70; 104) г/л) по сравнению с 1-й группой (95,5 (88; 110) г/л) (p=0,04); при этом разница показатели гемоглобина в 1-й и 2-й группе до и после операции статистически значимо не различались (10,5 (6,5; 19) и 17 (8; 37) г/л соответственно) (p=0,07) (табл. 2).
Частота выполняемых гистерэктомий в 1-й и 2-й группе статистически значимо не различалась (p=0,58): 1/32 (3%) случай в 1-й группе; 2/25 (8%) – во 2-й. Показанием к немедленной гистерэктомии в обеих группах явилось начавшееся массивное кровотечение на фоне гипотонии матки, общий объем которого составил 6200 (0) мл в 1-й группе; 6375 (530) – во 2-й (p=1,00) (табл. 3). Обращает на себя внимание снижение величины кровопотери в обеих группах при выполнении органосохраняющей операции: 1200 (900; 1600) мл в 1-й группе и 2200 (1400; 3500) мл – во 2-й (p=0,001), успех выполнения которой в обеих группах (31/32 (97%) пациенток 1-й группы, 23/25 (92%) – 2-й группы) статистически значимо не различался (p=0,58) (табл. 3).
Аутогемотрансфузия чаще проводилась во 2-й группе (22/57 (88%) случая), чем в 1-й (16/57 (50%) случаев соответственно) (p=0,004), величина показателя РР при этом составила 50% (95% ДИ 27–63; p<0,001). Гемотрансфузия донорскими препаратами крови потребовалась в 5/32 (16%) случаях в 1-й группе, в 8/25 (32%) – во 2-й (p=0,21), величина показателя РР составила 66% (95% ДИ 37–84; p<0,001). Объемы аутогемотрансфузии, гемотрансфузии донорских препаратов крови, криопреципитата, тетраспана, альбумина, rFVIIa (Коагила VII) статистически значимо не различались (табл. 3).
Обсуждение
Проблема поиска оптимальных методик оперативного лечения при наличии диагноза «врастание плаценты» особо актуальна ввиду отсутствия универсального протокола проведения органосохраняющей операции у пациенток данной категории. Глубина и площадь врастания, порой определяемые только интраоперационно, являются основными факторами, определяющими хирургическую тактику и исходы для пациенток [13, 14]. На данном этапе отсутствуют четкие критерии для выбора места разреза на матке при проведении кесарева сечения. По данным многих авторов, предпочтительным является донное или корпоральное кесарево сечение, при которых разрез на матке производится в области, не скомпрометированной врастанием плаценты [2, 7, 15–17]. Такой подход вполне оправдан, поскольку достоверно снижает величину интраоперационной кровопотери и дает оперирующей бригаде больше времени для тщательного низведения мочевого пузыря с целью визуализации нижнего края неизмененного миометрия, когда извлечение плода уже произошло; однако подразумевает проведение двух разрезов на матке, что может повысить риск ее разрыва в последующую беременность [7, 16]. Кроме того, определенные клинические ситуации (трудность низведения и отсепаровки мочевого пузыря, обширный плацентарный дефект) не позволяют использовать надплацентарный доступ, ввиду чего в таких случаях оправдано проведение двух разрезов на матке, как и показывает проведенное нами исследование [9]. Исследование Takeda S. et al. подтверждает, что при визуализации обширного дефекта следует выполнять поперечный или вертикальный разрез дна матки в месте, достаточно удаленном от области врастания плаценты [9].
Также существует и другая методика, позволяющая выполнить один разрез на матке в нижнем маточном сегменте выше верхнего края маточной аневризмы. Во многих проведенных исследованиях линия гистеротомии выбиралась в соответствии с предоперационным ультразвуковым исследованием [9, 17, 18]. Однако более достоверные данные возможно получить при проведении интраоперационной ультразвуковой навигации, позволяющей наиболее точно определить верхний край области врастания и, соответственно, необходимое место для выполнения разреза на матке [18, 19].
В изобретении, представленном в 2019 г. Шмаковым Р.Г. и соавт., описываются применение интраоперационной сонографической навигации для определения верхнего края плаценты и проведение одного поперечного разреза как перспективного метода, улучшающего репарацию после оперативного вмешательства и снижающего величину интраоперационной кровопотери [19]. При описанной методике в качестве метода гемостаза применялся комплексный компрессионный гемостаз, подразумевающий использование трех силиконовых турникетов, из которых два накладывали на уровне перешейка через «окна», формируемые в широких связках матки с двух сторон, и один – на уровне шейки матки [8, 19].
Нами представлена модифицированная методика, при которой один силиконовый жгут (катетер Фолея) накладывается на уровне нижнего края маточной аневризмы с вовлечением маточных артерий и крестцово-маточных связок, подобную методику описывает в своей работе и Altal O. [20]. В исследовании, проведенном Виницким А.А. и соавт., продемонстрирована сравнительная оценка нескольких методов хирургического гемостаза, из которых лучший гемостатический эффект был получен в группе, в которой применялся комплексный компрессионный гемостаз [8].
Интраоперационная ультразвуковая навигация, размер плацентарного дефекта и клинический опыт позволяют определить тип разреза на матке. Техника операции, описанная у пациенток 1-й группы, ассоциирована с лучшим гемостатическим эффектом при условии возможности проведения одного разреза на матке; в то время как оперативное лечение, включающее два разреза на матке, позволяет безопасно извлечь плод в случаях, когда визуализируется обширный размер плацентарного дефекта и наблюдаются технические сложности при отсепаровке и низведении мочевого пузыря. Метод дистального гемостаза не уступает по своей эффективности рентгенэндоваскулярным методикам, но при этом не требует специализированного оборудования и наличия эндоваскулярного хирурга, а также может применяться как временная мера в случае интраоперационного обнаружения врастания плаценты и необходимости ожидания квалифицированной бригады хирургов [8, 20].
Заключение
Проведенный анализ двух техник оперативного вмешательства, применяемых при родоразрешении беременных с врастанием плаценты, свидетельствует о возможности, безопасности и целесообразности проведения органосохраняющей операции; соответственно дальнейшая разработка и стандартизация оперативных доступов и методов лечения данной категории пациенток представляются перспективными.



