Актуальной проблемой в свете развития хирургии матки и роста количества кесаревых сечений (КС) является патология прикрепления плаценты (PAS). КС при врастании плаценты, как правило, сопровождается острым, массивным кровотечением. Акушерские кровотечения являются одной из основных причин материнской смертности и осложняют до 8% всех родов [1]. Примерно 10% всех кровотечений в акушерстве приходится на долю приращения плаценты и нарушений ее отделения [2]. Этиология и патогенез данного состояния до сих пор остаются недостаточно изученными. В настоящее время средняя частота приращения плаценты составляет 1 случай на 1000–2500 родов [3, 4]. Учитывая тенденцию к росту частоты КС и хирургии матки во всем мире, линейно возрастает риск врастания плаценты [5]. В настоящее время активно разрабатываются и внедряются методики органосохраняющего вмешательства с использованием различных ангиографических и хирургических методов регионального блока кровотока [2, 5–8]. Однако для реализации такого подхода пациентка не должна находиться в обычном городском родильном доме, который не располагает нужными возможностями и наличием разнопрофильных отделений в своей структуре. Родоразрешение беременной с PAS должно проводиться в плановом порядке, а операционная бригада должна состоять из специалистов разного профиля: акушеров-гинекологов, сосудистых хирургов, интервенционных хирургов, анестезиологов, трансфузиологов, неонатологов, а при прорастании плаценты в соседние органы и анатомические структуры список смежных специалистов значимо расширяется [2]. Безусловно, что для обеспечения правильной маршрутизации таких пациенток важна своевременная пренатальная диагностика [8–11]. Диагностика приращения плаценты осложняется скудной клинической картиной и отсутствием специфических ультразвуковых признаков при нормальной локализации и неглубокой инвазии плаценты в миометрий. Для своевременного выявления приращения плаценты необходимо проявлять особенную клиническую настороженность у женщин с КС и миомэктомией в анамнезе, а также при предлежании плаценты. «Золотым стандартом» первичной диагностики врастания плаценты является ультразвуковая визуализация [9]. Полученные данные при ультразвуковом исследовании (УЗИ) существенно зависят от навыков врача; также не всегда можно вывести для осмотра зону интересов и достоверно оценить признаки инвазии.
Магнитно-резонансная томография (МРТ) необходима для более точной визуализации, оценки топографии, взаимоотношения тканей, особенно при локализации области врастания по задней стенке матки, малодоступной для ультразвуковой визуализации.
Как правило, наилучшую визуализацию врач получает в Т2-взвешенных проекциях. Важен и срок выполнения исследования, особенно важно, что нормальный миометрий физиологически истончен к доношенному сроку гестации, а плацента принимает неоднородную структуру, и, учитывая, двигательную активность плода, отличить в достаточной мере патологию от нормы крайне сложно. Принимая во внимание упомянутые выше особенности, оптимальный срок для проведения МРТ находится в промежутке между 30 и 35 неделями беременности [8, 9, 12, 13].
Совместный консенсус Общества абдоминальной радиологии (SAR) и Европейского общества урогенитальной радиологии (ESUR) выделил 7 основных анализируемых признаков врастания плаценты по данным МРТ: внутриплацентарные темные полосы Т2, выпячивание матки/плаценты, потеря ретроплацентарной линии Т2, истончение/разрыв миометрия, разрыв стенки мочевого пузыря, фокальная экзофитная плацентарная масса и аномальная сосудистая сеть плацентарного ложа [11, 13].
Дополнительный интерес в прогностическом плане вызывает симптом «обнаженного сосуда», представляющий собой хотя бы 1 линейную структуру диметром 5 мм и длиной около 2 см. Сама по себе гиперваскуляризация – признак при МРТ, имеющий специфичность до 80%; значения чувствительности колеблются от 42 до 69% [14]. При макроскопическом исследовании выявляется сеть субхорионических ветвистых стволовых сосудистых структур диаметром 3–5 мм, длиной 2–8 см [15]. Свое название они получили ввиду того, что минимально окружены тканями хориона и, проникая через толщу плаценты, давали минимальное количество ветвей. Dighe M. из Вашингтона опубликовала сходные данные о значимости диаметра внутриплацентарной сосудистой сети плода в прогнозе врастания плаценты; диаметр сосуда 2 мм или более часто встречался при наличии PAS, тогда как диаметр сосуда 3 мм или более был ассоциирован с более глубокой степенью инвазии и риском перипортальных кровотечений [16].
Важной задачей в диагностике врастания плаценты является не только выбор тактики, срока родоразрешения, доступа, техники операции и метода деваскуляризации, но и снижение ложноположительных результатов, что может приводить к гипердиагностике и увеличению перинатальной заболеваемости ввиду досрочного родоразрешения [17].
Цель исследования: изучить возможности МР-диагностики в оптимизации тактики хирургического лечения пациенток с врастанием плаценты.
Материалы и методы
Исследование представлено ретроспективным анализом медицинских карт пациенток (средний возраст 36,4 (5,1) года), родоразрешенных в клинике акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России в период с 2017 по 2021 гг. Беременные с врастанием плаценты (n=49) были разделены на 2 группы в зависимости от исхода оперативного родоразрешения: 1-я группа включила 34 пациентки, которым удалось выполнить КС и метропластику, 2-я группа – 15 пациенток, подвергшиеся вынужденной гистерэктомии. В группу сравнения вошли 42 беременные без патологии прикрепления плаценты. Причинами для так называемой органоуносящей операции (гистерэктомии) в группе 2 послужила техническая невозможность выполнения метропластики ввиду прорастания тканей плаценты в параметрии и в области внутреннего зева и/или тотальное циркулярное прорастание тканей шейки матки.
Все пациентки родоразрешены в период 34–36 недель гестации, в сроки, достаточные для благоприятного прогноза адаптации новорожденного, но и достаточно ранние для того, чтобы свести к минимуму риск экстренной операции в связи с развитием родовой деятельности. Извлечение плода выполнялось через «классический» корпоральный разрез на матке либо доступом по Фритчу в зависимости от зоны плацентации. После погружения пересеченной пуповины в полость матки разрез ушивался двухрядным швом с дальнейшей метропластикой в зоне врастания. Региональный блок кровотока во всех случаях осуществлялся наложением турникетов на общие подвздошные артерии и подвешивающие связки яичников до начала этапа метропластики. Средний объем кровопотери в случаях, завершенных метропластикой, при гравиметрии составил 2253 (729) мл, в ситуациях, потребовавших гистерэктомии, кровопотеря составила 3500,0 (2375; 5230) мл, технология Cell-Saver была применена во всех случаях.
Всем пациенткам до операции было выполнено и УЗИ, и МРТ. МРТ проводилась в сроках с 20 по 36 недели гестации (медиана 32 недели) на МР-томографах с напряженностью магнитного поля 1,5 Тл, с использованием стандартных последовательностей (Т1-, Т2-взвешенных изображений) с жироподавлением, DWI c b=1000, с задержкой и без задержки дыхания в трех ортогональных плоскостях, ориентированных по оси матки и оси плаценты, в положении пациенток лежа на спине. Из исследования были исключены 2 пациентки с PAS и многоплодной беременностью, а также 1 пациентка с металлоконструкцией черепа и 1 беременная, страдающая клаустрофобией.
Статистический анализ
Статистическая обработка данных выполнена с использованием программы StatTech v. 3.1.8, Microsoft Excel. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия Хи-квадрат Пирсона. Анализ чувствительности, специфичности, положительной и отрицательной прогностических ценностей выполнялся с использованием метода четырехпольных таблиц.
Результаты
При анализе полученных томограмм исследовались следующие признаки:
- нарушение маточно-плацентарного интерфейса (потеря гипоинтенсивной линии);
- однородность/гетерогенность структуры плаценты;
- толщина плацентарного диска;
- наличие внутриплацентарных «черных» полос;
- интрамуральная и параметральная гиперваскуляризация;
- деформация стенки мочевого пузыря;
- истончение миометрия.
Также было отмечено наличие особых диагностических находок, таких как «мостовидные» сосуды, представляющие собой перпендикулярные сосуды на границе плаценты с миометрием, и симптом «обнаженного» сосуда – сосуд диаметром 3–4 мм длиной более 2 см, не дающий на своем пути коллатеральных веток (табл. 1).

Для описанных качественных признаков нами были вычислены чувствительность (Se), специфичность (Sp) и прогностическая ценность. Также проведены анализ частоты встречаемости в зависимости от морфологического типа врастания и корреляция с операционным исходом. При вычислении данных показателей нами были сравнены данные МРТ беременных с истинным врастанием плаценты (гистологически верифицированы, n=45) с данными МРТ пациенток, которым диагноз не был подтвержден гистологически (группа сравнения, n=42) (табл. 2).
Исходя из полученных данных можно сделать вывод, что наиболее специфичным МР-признаком для диагностики врастания плаценты является наличие гипоинтенсивных лент в плацентарной ткани, соответствующих наличию патологической васкуляризации этих тканей.

Согласно полученным данным, при сравнении в различных по глубине типах врастаний были установлены существенные различия в изменениях стенки мочевого пузыря (p=0,005, используемый метод: Хи-квадрат Пирсона). Наличие деформации контура стенки мочевого пузыря было выявлено в 85,7% случаев placenta percreta; однако признак также встречался и при менее глубокой инвазии тканей плаценты, не доходящей до стенки мочевого пузыря. Наличие деформации стенки мочевого пузыря и подозрения на экзофитные включения в просвете мочевого пузыря нередко дают ложноположительные результаты ввиду буллезного отека, обнаруживаемого на предоперационной цистоскопии, и расширения подслизистых сосудов.
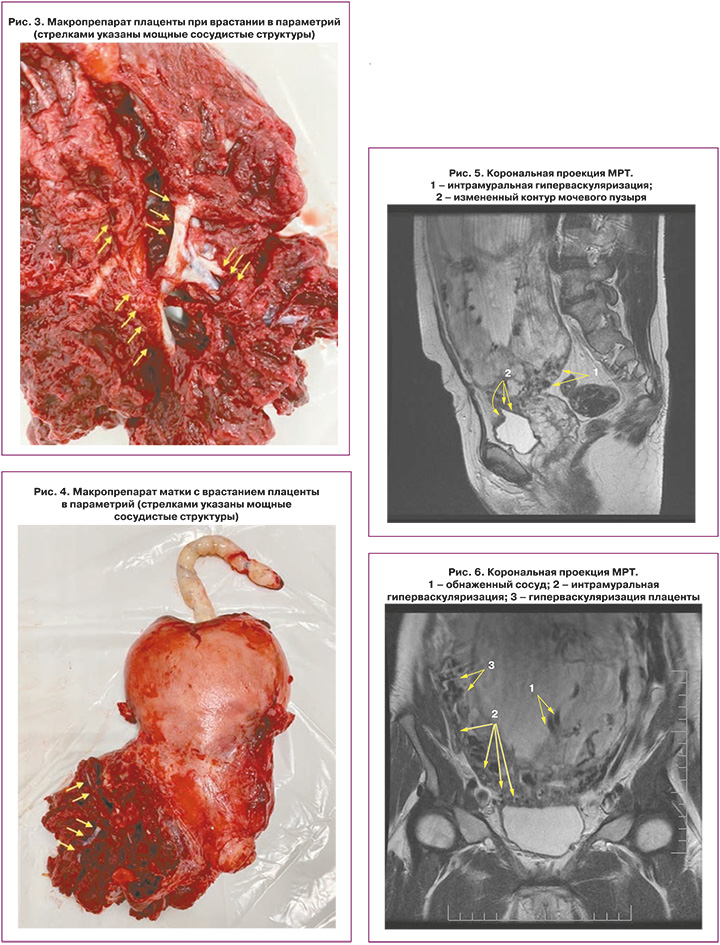
Также стоит выделить особый тип плацентарной гиперваскуляризации, а именно включение в плацентарной ткани изменений по типу «обнаженного сосуда» (рис. 1, 2). Мы провели анализ встречаемости данного признака среди наших пациентов. Любопытным наблюдением явилось то, что данный симптом в нашей выборке встречался только при наличии placenta percreta – 6 случаев, а именно при поражении параметриев, и не встречался при плацентарной инвазии, ограниченной миометрием. «Мостовидные сосуды» были менее специфичны, тем не менее, их наличие также сопровождало тяжелые формы врастания, обусловленные более глубокой инвазией ворсин хориона, – 8 случаев.
Является ли симптом «обнаженного сосуда» патогномоничным для параметральной инвазии или нет, еще предстоит выяснить; однако в ходе исследования установлена его связь с частотой гистерэктомий в группах с наличием симптома «обнаженного сосуда», что, вероятно, обусловлено мощной сосудистой сетью коллатералей и неоангиогенезом. Во всех случаях обнаружения данного признака впоследствии была выполнена вынужденная гистерэктомия (рис. 3–6, пациентка Н., 37 лет).
Стоит отметить, что медианные значения толщины плаценты составили 49 (16) мм и находились в диапазоне от 22 до 79 мм. Толщина миометрия также не была достоверным диагностическим маркером инвазии, так как в конце III триместра в норме толщина миометрия здоровой матки может достигать около 2 мм. Данный признак лишь вводит в заблуждение и не нашел корреляционной связи с морфологией врастания и операционными исходами.
Заключение
Безусловно, МР-диагностика является вспомогательным методом диагностики врастания плаценты, и первично всем пациенткам группы риска должно быть выполнено УЗИ матки и плаценты. Однако при необходимости оценки патологических изменений кровоснабжения матки и топографии плацентарной инвазии МРТ представляет больший интерес в сравнении с ультразвуковой диагностикой.
Достаточно высокой чувствительностью обладают нарушения строения маточно-плацентарного интерфейса – 82,2% и наличие широких гипоинтенсивных лент в плаценте – 73,3% (Sp 100%), а также такие маркеры патологической инвазии плаценты, как интрамуральная и параметральная гиперваскуляризация (Se 62,2%, Sp 83,3%). Сопоставление этих данных, возможно, позволит прогнозировать тактику родоразрешения: подобрать уровень и метод блока регионального кровотока, состав хирургической бригады и предположить конечный объем оперативного вмешательства.
Возможно, что при ожидаемой глубокой инвазии в шейку матки и параметрии, когда технически восстановление нормальной анатомии матки с высокой степенью вероятности невозможно, целесообразно сдвинуть сроки вмешательства ближе к доношенному сроку гестации.



