С начала XX в. избыточное отложение жировой ткани стали рассматривать не только как косметический эффект. С 1922 г. Г.Ф. Лангом была обнаружена ассоциация между ожирением, артериальной гипертонией и подагрой. Позднее изучение механизмов кардиометаболических расстройств обнаружило связь метаболического синдрома (абдоминального ожирения) с повышением уровня андрогенов у женщин, что объясняет развитие у них ановуляторного бесплодия, нарушений менструального цикла, синдрома поликистозных яичников (СПЯ), невынашивания беременности [1, 2]. В числе женщин с метаболическим синдромом 56,1% страдают ожирением и 33,1% имеют избыточную массу тела. При этом синдром в большей степени ассоциирован с висцеральным типом ожирения: скоплением жировой ткани в брыжейке кишечника, сальнике, средостении и забрюшинном пространстве, по ходу сосудов и нервов, с формированием прослойки между мышцами и органами [3]. Жировая ткань (адипоциты) – эндокринный орган, секретирующий ряд биологически активных веществ: лептин, фактор некроза опухоли, ингибитор I активатора плазминогена, интерлейкин-6, интерлейкин-8, ангиотензин II, резистин и др. [4]. В основе метаболического синдрома лежат инсулинорезистентность, избыточное поступление в кровоток свободных жирных кислот, дислипидемия. Это нередко приводит к бесплодию и приросту частоты осложнений беременности: ранним потерям беременности, преждевременным родам, гестационному сахарному диабету, макросомии, врожденным порокам развития плода, мертворождениям [5].
Механизм ановуляции при ожирении, несмотря на многочисленные исследования, остается неясным. Гиперандрогенемия вследствие гиперинсулинемии у пациенток с избыточной массой тела приводит к апоптозу гранулезных клеток, что может влиять на функцию яичников. Было показано, что выработка эстрогена гранулезными клетками стимулируется инсулином [6]. Влияние фолликулостимулирующего гормона (ФСГ) на продукцию эстрадиола и прогестерона усиливается инсулином. Это продемонстрировано у женщин с СПЯ и резистентностью к инсулину. В развивающемся фолликуле повышается уровень эстрогенов, ФСГ увеличивает избыток андрогенного субстрата, что приводит к нарушенному уровню эстрогенов в развивающемся фолликуле, инсулин также усиливает стероидогенез, усиливая действие лютеотропного гормона (ЛГ) на клетки гранулезы. ЛГ стимулирует стероидогенез и ингибирует дальнейший митоз и окончательную дифференцировку клеток гранулезы в преовуляторном фолликуле [7]. Повышенный уровень эстрогенов из-за периферической избыточной секреции нарушает ось гипоталамус-гипофиз-яичники, избыток как эстрогенов, так и андрогенов играют роль в ановуляции, наблюдаемой у этих пациенток.
Таким образом, в результате усиленного стероидогенеза за счет инсулина и его взаимодействия с ЛГ неблагоприятная среда вызывает прекращение роста фолликулов, развивается преждевременная лютеинизация, останавливается рост фолликулов, что приводит к нарушениям менструального цикла и олигоановуляции, вызванных ожирением [8].
Интерес исследователей в последнее время прикован к изучению роли микронутриентной и витаминной недостаточности в патогенезе метаболического синдрома, а также к способам нутритивной поддержки при различных состояниях [9]. Так, миоинозитол (МИ) способствует нормализации уровня андрогенов и пролактина в сыворотке крови и устранению проявлений гиперандрогенемии, в том числе при СПЯ [9]. Также МИ участвует в регуляции менструального цикла, способствуя его нормализации [9], и играет роль (при совместном применении с фолиевой кислотой) в созревании яйцеклетки при подготовке к оплодотворению в циклах вспомогательных репродуктивных технологий [10]. D-хироинозитол (ДХИ) способствует улучшению метаболических показателей углеводного и липидного обмена при повышенной массе тела. Инозитол рекомендован при инсулинорезистентности, а также с целью нормализации менструального цикла и овуляции при СПЯ [11]. Прием фолиевой кислоты рекомендован при планировании беременности и на протяжении I триместра с целью профилактики дефектов невральной трубки и других пороков у плода [12].
Учитывая вышеобозначенное, актуальным представлялось изучение применения комбинации МИ и ДХИ (соотношение 5:1) в сочетании с марганцем и фолиевой кислотой у женщин с избыточной массой тела и ановуляцией на фоне модификации образа жизни на этапе прегравидарной подготовки.
Материалы и методы
На базе клиник Москвы, Нижнего Новгорода, Новосибирска, Краснодара, Екатеринбурга, Воронежа на протяжении 2021–2022 гг. было проведено описательное исследование оценки результатов модификации образа жизни (диета и физические нагрузки) с включением в качестве нутритивной поддержки комбинации 1000 мг МИ и 200 мг ДХИ (соотношение 5:1), 200 мкг фолиевой кислоты и 5 мг марганца (Дикироген) у 197 женщин репродуктивного возраста с избыточной массой тела или ожирением и ановуляцией на протяжении 2–4 месяцев. Критерии включения: отсутствие наступления беременности, избыточная масса тела или ожирение, окружность талии (ОТ) более 80 см, отсутствие приема гормональных препаратов в течение 3 месяцев до включения в исследование, отсутствие заболеваний, требующих хирургического лечения, отсутствие заболеваний, требующих систематического приема лекарственных препаратов.
Критерии оценки результатов: положительный тест на овуляцию, регулярность менструального цикла, индекс массы тела (ИМТ), ОТ, уровень глюкозы в сыворотке крови, уровень свободного тестостерона, ФСГ, ЛГ.
Всем женщинам в качестве 1-й линии терапии рекомендовали модификацию образа жизни – физические упражнения и коррекцию питания (на основании представленных дневников питания). В качестве нутритивной поддержки рекомендована комбинация МИ и ДХИ в соотношении 5:1 (Дикироген, Pizeta Pharma SpA, Италия, номер свидетельства о государственной регистрации RU.77.99.88.003.R.003342.09.21 от 03.09.2021) по схеме: 1 саше 2 раза в день во время приема пищи, предварительно растворив в ½ стакана воды. В состав Дикирогена входит 1000 мг МИ, 200 мг ДХИ, 200 мкг фолиевой кислоты и 5 мг марганца в форме органической соли – марганца пидолата (в связи с тем, что фолиевая кислота и марганец являются синергистами инозитолов) [13].
Осмотр и обследование пациенток, включенных в исследование, проводились в 2 визита: 1-й визит – сбор исходных данных; 2-й визит – через 80–90±3 дня (табл. 1).
Статистический анализ
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился с использованием программы IBM SPSS Statistics v.18 (IBM Corporation).
Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро–Уилка (при числе исследуемых менее 50) или критерий Колмогорова–Смирнова (при числе исследуемых более 50), а также показатели асимметрии и эксцесса.
В случае описания количественных показателей, имеющих нормальное распределение, полученные данные объединялись в вариационные ряды, в которых проводился расчет средних арифметических величин (M) и стандартных отклонений (SD).
Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей (Q1–Q3).
Номинальные данные описывались с указанием абсолютных значений и процентных долей.
Статистическая значимость различий принималась при значении р<0,001.
Результаты
Пациентки, включенные в исследование, были в возрасте от 19 до 44 лет, средний возраст – 30,76 (4,96) года. Медиана менархе пациенток – 13 (12;14) лет. Пациентки обращались с жалобами на ненаступление беременности у 197/197 (100%) женщин, нарушения менструального цикла были у 70/197 (35,53%), в том числе менструации были редкими у 11/197 (5,58%) женщин.
Медиана роста пациенток – 165 (163;170) см, масса тела – 80,18 (10,84) кг, ИМТ (Ме) – 28,7 (27,2; 30,5) кг/м2, ОТ (Ме) – 88 (81; 94) см.
В течение всего периода наблюдения только 15/197 (7,6%) пациенток сообщили о том, что соблюдали предложенную гипокалорийную диету и физическую активность. 182 женщины не смогли придерживаться рекомендаций. Все пациентки отметили хорошую переносимость средства Дикироген и отсутствие побочных эффектов.
В течение периода наблюдения на фоне приема средства «Дикироген» были отмечены снижение массы тела на 2,5 кг, уменьшение ИМТ в среднем на 0,5 см и уменьшение ОТ на 1,75 см (табл. 2).
У большинства пациенток менструальный цикл стал соответствовать нормальным показателям [14]. При первичном обращении он был регулярным у 119/197 (60,4%), через 80–90 дней – у 173/197 (87,81%) (табл. 3). Значительно уменьшилась частота скудных менструальных выделений – в 3,6 раза. При первичном обращении менструации были скудными у 25/197 (12,69%), на 2-м визите – у 7/197 (3,55%) женщин.
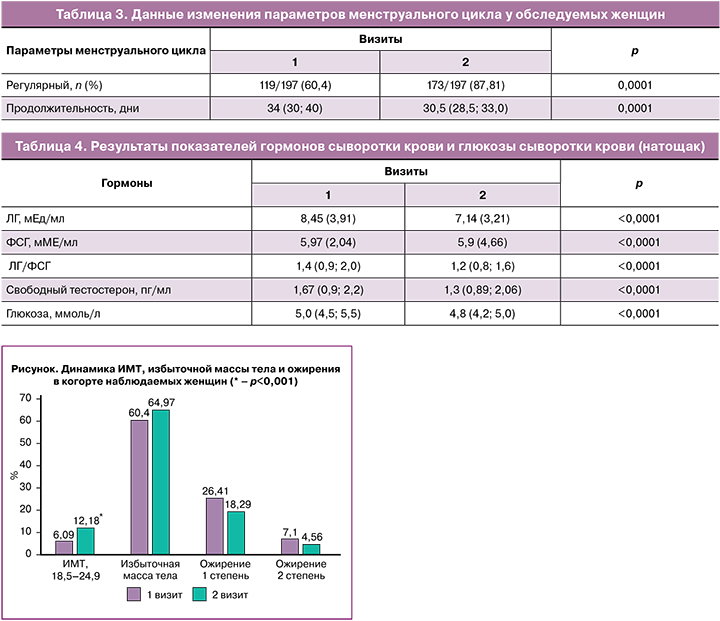
В течение 80–90 дней наблюдалась редукция массы тела у женщин, принимавших Дикироген. Количество женщин с ожирением 2-й степени уменьшилось с 7,1 до 4,56%, с ожирением 1-й степени – с 26,41 до 18,29%. Таким образом, пациентки с ожирением перешли в группу женщин с избыточной массой тела; количество их увеличилось с 60,4 до 64,97%. В 2 раза больше стало женщин с нормальной массой тела: на 1-м визите их было 6,09%, на 2-м – 12,18% (рисунок).
В течение периода наблюдения уменьшилось содержание ЛГ с 8,45 (3,91) до 7,14 (3,21) мЕД/мл и отношение ЛГ/ФСГ – с 1,4 (0,9; 2,0) до 1,2 (0,8; 1,6) (р<0,0001). Значительно уменьшилось среднее значение глюкозы сыворотки крови натощак – с 5,0 (4,5; 5,5) до 4,8 (4,2; 5,0) ммоль/л (р<0,0001) и количество женщин с уровнем глюкозы (натощак) выше 5,1 ммоль/л – с 37,2 до 12,1%, т.е. в 3,07 раза.
В течение 80–90 дней беременность наступила у 30/197 (15,2%) пациенток, тест на овуляцию ко 2-му визиту был положительным у 96/197 (48,73%) женщин.
Обсуждение
Около половины женщин репродуктивного возраста, планирующих беременность, имеют избыточную массу тела и ожирение [1, 15]. Это неблагоприятно влияет на репродуктивное здоровье и нередко приводит к аномальным маточным кровотечениям [1] и дефициту железа [16], нарушениям овуляции, бесплодию и ранним потерям беременности [17]. Наиболее яркий пример хронической ановуляции у женщин – это СПЯ с избыточной масой тела и ожирением [18]. Исследования Chavarro J.E. et al. [19] и Rich-Edwards J.W. et al. [20] выявили взаимосвязь между величиной ИМТ и относительным риском нарушений овуляции, поскольку имела место корреляция между избыточной массой тела и уровнем ЛГ. Нарушения пульсовой секреции гормонов гипоталамо-гипофизарно-яичниковой системы у лиц с избыточной массой тела могут усугубляться сопутствующей тканевой инсулинорезистентностью и гиперинсулинемией, что может потенцировать действие ЛГ на гранулезные клетки фолликула и повышать вероятность преждевременной лютеинизации [18]. Кроме того, нарушение секреции жировой тканью адипокинов, в частности лептина, концентрация которого значительно повышена у женщин с ожирением, также неблагоприятно влияет на процессы овуляции [21]. Уровни лептина варьируют в зависимости от фазы менструального цикла, а это означает, что он играет значительную роль в регуляции гормонального баланса у женщин и необходим для овуляции [22]. Адипокин стимулирует гипофиз к секреции ЛГ, а также может активировать рецепторы гонадотропин-рилизинг-гормона в гипоталамусе, которые, в свою очередь, стимулируют секрецию ЛГ [23]. Таким образом, снижение массы тела до зачатия у женщин с избыточной массой тела является одним из ключевых элементов, ведущих к успеху в зачатии за счет регулирования гормонального баланса, снижения концентрации лептина и индукции спонтанной овуляции [24–26]. У женщин с ожирением обычно наблюдается снижение концентрации адипонектина, действие которого в основном связано с повышением чувствительности тканей к инсулину [21]. Считается, что этот адипокин взаимодействует с гипоталамо-гипофизарно-гонадной осью и регулирует секрецию гонадотропин-рилизинг-гормона. Адипонектин может также усиливать экспрессию инсулиновых рецепторов яичников и снижать синтез андрогенов в яичниках, что может привести к восстановлению овуляции, особенно у женщин с СПЯ [27].
К отсутствию овуляцию также приводят повышенный уровень андрогенов и ЛГ в сыворотке крови при нормальном или слегка сниженном уровне ФСГ, что необходимо для пролиферации гранулезных клеток яичников. Таким образом, роль ЛГ представляется значимой в механизме нарушений овуляции [18]. Кроме того, высокая частота пульсирующей секреции гонадотропин-рилизинг-гормона приводит к нарушению соотношения ЛГ/ФСГ. Антральные фолликулы, не способные перейти в преовуляторную фазу у женщин с СПЯ и ожирением, чувствительны к действию ФСГ. Нормализация его уровня обычно приводит к восстановлению овуляцию и фертильности [18]. Результаты исследования Teede H. et al. [28] дополнительно указали на ключевую роль антимюллерова гормона, продуцируемого преантральными и антральными фолликулами, в генезе аномальной активности гонадотропин-рилизинг-гормона и, как следствие, увеличении ЛГ и андрогенов. Известно также, что повышенный уровень андрогенов в крови, воздействуя на многочисленные метаболические пути, может привести к преждевременной остановке пролиферации гранулезных клеток, что приводит к отсутствию образования доминантных фолликулов [18].
Открытие инозитола относится к 1850 г., однако в начале XXI в. было обнаружено его участие в передаче эндокринных сигналов; наиболее интересным с терапевтической точки зрения явилось инсулин-сенсибилизирующее действие. Инозитол входит в состав фосфолипидов клеточных мембран и является важным компонентом поддержания структуры клеток [29]. Он существует в форме девяти стереоизомеров и преимущественно представлен МИ и ДХИ. Помимо функции мессенджеров в передаче сигнала инсулина и участия в метаболизме глюкозы, инозитолы связаны с репродуктивной системой, действуя как модуляторы стероидогенеза. МИ является вторичным мессенджером ФСГ и непосредственно участвует в фолликуло- и оогенезе. Он регулирует пролиферацию и созревание гранулезных клеток в яичниках, опосредует ФСГ-индуцированную выработку антимюллерова гормона, играет ключевую роль в развитии и транспорте зрелых ооцитов, а также положительно влияет на качество эмбрионов [30]. Исследование Ravanos K. et al. [31] убедительно показало, что соотношение МИ:ДХИ в фолликулярной жидкости значительно выше в образцах бластоцист хорошего качества. Клинические исследования эффективности МИ в программах ВРТ у женщин с СПЯ [32] также продемонстрировали, что прием МИ с фолиевой кислотой в цикле стимуляции значительно снижает общую дозу гонадотропинов, продолжительность стимуляции и увеличивает частоту наступления беременности в сравнении с теми, кто принимал фолиевую кислоту без МИ. ДХИ нейтрализует стимулирующее действие инсулина на стероидогенез и выработку андрогенов тека-клетками яичников. ДХИ дозозависимо уменьшает повышенную под действием инсулина экспрессию генов ферментов стероидогенеза [33].
Результаты нашего исследования показали, что у женщин с избыточной массой тела и ожирением с жалобами на ненаступление беременности и отсутствием овуляции применение в качестве нутритивной поддержки биологически активной добавки к пище «Дикироген» в сочетании с комплексной терапией (диета+физическая активность) привело к снижению массы тела на 2,5 кг, уменьшению ИМТ в среднем на 0,5 см и уменьшению ОТ на 1,75 см. Количество женщин с ожирением 2-й степени уменьшилась в 1,55 раза; с ожирением 1-й степени – в 1,4 раза. Пациентки с ожирением перешли в группу женщин с избыточной массой тела; количество их увеличилось с 60,4 до 64,97%; в 2 раза больше стало женщин с нормальной массой тела.
Уменьшение массы тела, ИМТ, ОТ привело к тому, что нормальный менструальный цикл ко 2-му визиту встречался в 1,41 раза чаще. Значительно уменьшилась частота скудных менструальных выделений – в 3,6 раза. В течение периода наблюдения уменьшилось содержание ЛГ – с 8,45 (3,91) до 7,14 (3,21) мЕД/мл и отношение ЛГ/ФСГ – с 1,4 (0,9; 2,0) до 1,2 (0,8; 1,6) (р<0,0001). Значительно уменьшилось среднее значение глюкозы сыворотки крови натощак – с 5,0 (4,5; 5,5) до 4,8 (4,2; 5,0) ммоль/л (р<0,0001) и количество женщин с уровнем глюкозы натощак выше 5,1 ммоль/мл – в 3,07 раза.
В течение 80–90 дней наблюдения беременность наступила у 30/197 (15,2%) пациенток, тест на овуляцию ко второму визиту был положительным у 96/197 (48,73%) женщин.
Заключение
Модификация образа жизни (физические упражнения и коррекция питания) с введением в рацион биологически активной добавки к пище «Дикироген» приводило к снижению массы тела, нормализации менструального цикла, снижению содержания глюкозы (натощак) в сыворотке крови, изменению соотношения ФСГ/ЛГ и снижению ЛГ, а также наступлению беременности у 15,2% пациенток, положительному тесту на овуляцию у половины из них (48,73%) при хорошей переносимости (побочные эффекты не были зарегистрированы). Женщинам с ожирением и избыточной массой тела, с жалобами на отсутствие овуляции и ненаступление беременности мы рекомендуем комплексную терапию, включающую диету, физические нагрузки и биологически активную добавку к пище «Дикироген», содержащую МИ и ДХИ в соотношении 5:1, фолиевую кислоту и марганец в форме органической соли.



