Принимая во внимание факт значительной поддержки государством процедур вспомогательных репродуктивных технологий (ВРТ), очевидна актуальность задачи повышения эффективности программ экстракорпорального оплодотворения (ЭКО) [1].
Качество ооцитов и эмбрионов считается основной проблемой ЭКО при вспомогательной репродукции. Инозитол играет роль в передаче сигналов фолликулостимулирующим гормоном (ФСГ), созревании ооцитов и развитии эмбриона [2]. Согласно данным зарубежных исследователей, проанализировавших в метаанализе итоги лечения 935 пациенток с бесплодием в различных протоколах ВРТ, включение в рацион женщин за 3 месяца до протокола 2000–4000 мг мио-инозитола (МИ) и 400 мкг фолиевой кислоты (ФК) в сутки приводило к достоверному увеличению частоты наступления беременности и уменьшало риск самопроизвольного аборта [3]. Однако данный анализ не продемонстрировал существенной разницы в количестве извлеченных ооцитов на стадии MII, количестве дней стимуляции и использованных доз гонадотропинов.
Среди немногочисленных отечественных исследований по изучению эффективности применения МИ и ФК в прегравидарной подготовке к ЭКО выделяется работа Э.В. Вартанян и соавт., которые изучали действие инозитола на женщин моложе 38 лет после операций на яичниках, проходящих подготовку к ЭКО. В исследовании показано, что на фоне приема инозитола такими женщинами наблюдается повышение числа зрелых ооцитов и эмбрионов высокого качества, а также показана большая частота наступления беременности на перенос эмбриона [4].
Цель исследования – оценить эффективность дотации МИ и ФК в прегравидарной подготовке к ЭКО у пациенток с бесплодием и влияние этих веществ на качество эмбрионов и частоту наступления беременности.
Материалы и методы
Дизайн исследования – проспективное нерандомизированное открытое сравнительное клиническое исследование в параллельных группах.
В исследование включены 92 пациентки с бесплодием, планирующие ЭКО, которые проходили обследование и лечение в период с ноября 2018 г. по сентябрь 2020 г. в сети клиник репродуктивных технологий «Центр ЭКО» (Москва, Петрозаводск, Липецк, Симферополь, Смоленск).
В ходе исследования были сформированы 2 группы: в I вошли 46 пациенток, получавших прегравидарную подготовку, включающую прием комплекса МИ и ФК, во II – 46 пациенток, подобранных по принципу «случай-контроль», прошедших стандартную подготовку (прием ФК 400 мкг) перед вступлением в протокол ЭКО. Подбирая пары, соблюдали соответствие женщин в них по возрасту, индексу массы тела (ИМТ), продолжительности бесплодия, числу предшествующих попыток ЭКО, если таковые были, а также равноценных по количеству антральных фолликулов на момент старта протокола и стартовой дозы гонадотропина.
Протокол исследования создавали с учетом положений Хельсинкской декларации Всемирной Медицинской Ассоциации (пересмотр 2008 г.), а также документа «Международные этические рекомендации по проведению биомедицинских исследований с участием людей». Все пациентки дали информированное согласие на участие в исследовании.
Критериями включения в исследование стали: возраст пациенток 18–45 лет, наличие бесплодия, соответствие принципу «случай-контроль», оговоренному выше. Критерии исключения составили тяжелые соматические заболевания, резус-отрицательная кровь, психические заболевания и когнитивные расстройства.
Всем пациенткам проводилось комплексное обследование в соответствии с приказом №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Прегравидарная подготовка включала: в I группе – прием комплекса МИ в дозе 4000 мг и ФК в дозе 400 мкг (Фертина, Orion Pharma, Финляндия) в течение 12 недель перед процедурой ЭКО, во II – прием ФК в той же дозе с такой же продолжительностью лечения.
Протоколы с антагонистами гонадотропного рилизинг-гормона (а-ГнРГ) включали введение гонадотропинов 150–300 МЕ в сутки в зависимости от числа антральных фолликулов со 2–5-го дня менструального цикла, антагонист ГнРГ начинали вводить при наличии фолликула диаметром 14 мм до дня введения триггера. В случае наличия более 15 фолликулов диаметром от 11 мм производили замену триггера в протоколах с аГнРГ на агонист ГнРГ. Двойной триггер использовали при субоптимальном ответе для повышения количества зрелых ооцитов. Забор ооцитов проводился через 35–37 ч после введения триггера трансвагинально иглой Kitazato 19G 325 mm при наличии более 3 фолликулов.
Поддержка лютеиновой фазы проводилась препаратами прогестерона 600 мг в сутки во влагалище или дидрогестерона 30 мг в сутки перорально со дня пункции до 10 недель от переноса эмбриона. В случае переноса эмбрионов при использовании триггера агониста ГнРГ дополнительно назначались препараты эстрогенов (17β-эстрадиол, 0,1% гель для наружного применения, от 2 до 4 мг, или эстрадиола валерат, драже от 2 до 6 мг, внутрь) со дня пункции и препарат хорионического гонадотропина человека (ХГЧ) 5000 ME в/м на 5-е сутки.
Полученные зрелые ооциты оплодотворялись in vitro через 40±1 ч после введения триггера. Оценка оплодотворения производилась через 17±1 ч после него. Культивация эмбрионов проводилась до 3–5 суток в одношаговой среде LifeGlobal Global Total в увлажненной атмосфере с 6% содержанием CO2. После оценки качества эмбрионов по классификации Гарднера принималось решение о переносе, биопсии и криоконсервации. Перенос производился с помощью катетера Kitazato #213325, а в случае осложненных переносов использовался катетер Фридмана с проводником C.C.D. TDT. Оставшиеся эмбрионы были заморожены витрификационным методом на носителях Kitazato Cryotop с использованием растворов Kitazato Vitrification Medium VT601 [5].
Схема исследования представлена на рисунке.

Эффективность лечения оценивалась по первичным исходам, которые включали такие показатели, как суммарная доза гонадотропина, продолжительность стимуляции, количество ооцитов в МII, количество эмбрионов на момент переноса, и по вторичным – частота наступления беременности, определяемой биохимически и клинически.
Диагноз биохимической беременности ставился на основании уровня β-ХГЧ в крови через 10–14 дней после переноса эмбриона, диагноз клинической беременности подтверждался при УЗ-визуализации плодного яйца в матке через 3–4 недели после переноса, диагноз прогрессирующей беременности верифицировался через 10 недель после переноса.
Статистический анализ
Статистический анализ полученных результатов проводился при помощи пакета программ Statistica 6.0 (Statsoft, США). Для количественных признаков рассчитывались медиана и интерквартильный размах (Me [Q25–75%]), для качественных – абсолютная величина (n) и доля (%) от общего объема группы. При межгрупповом сравнении показателей (их распределение отличалось от нормального) использовали критерий Манна–Уитни. Различия между качественными признаками проверялись при помощи критерия χ2 и точного теста Фишера (при выборках малого объема). Если достигнутый уровень различий не превышал 0,05, их считали статистически значимыми [6]. Количественную оценку взаимосвязи лечебного фактора и исхода оценивали по величине отношения шансов (ОШ). Для демонстрации силы связи вычисляли 95% доверительный интервал (95% ДИ) по методу Woolf.
Результаты
Анализ медико-социальных показателей и анамнеза пациенток обеих групп на момент вступления в протокол ЭКО показал отсутствие различий между ними (табл. 1).
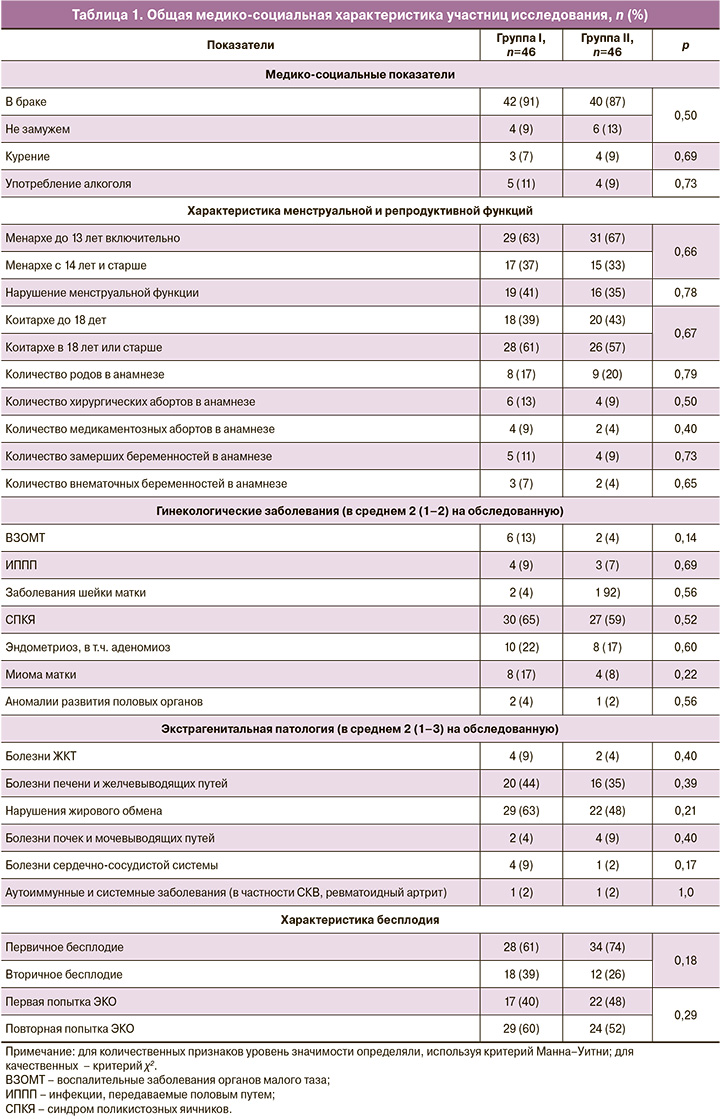
Пациентки находились в среднем репродуктивном возрасте 33 (32–38) и 34 (32–39) года соответственно (р=0,71), большинство имели ожирение I степени (ИМТ 31 (22–34) и 32 (22–36) кг/м2 соответственно, р=0,47), большая часть из них в анамнезе имели неудачный опыт ВРТ. Продолжительность бесплодия в обеих группах составила 7 (5–9) лет, р=0,75, и количество повторных попыток ЭКО была одинаковым – 2 (2–3), р=0,68.
У пациенток, прошедших прегравидарную подготовку к программе ЭКО с помощью комплекса МИ и ФК, были отмечены статистически значимо меньшая суммарная доза гонадотропина и продолжительность стимуляции, а также наблюдалась тенденция к большей частоте переноса нативного эмбриона (табл. 2).

В остальном показатели течения программы ЭКО у пациенток не продемонстрировали значимых различий. Причины сегментирования цикла также были сопоставимы в обеих группах. Таковыми явились направление эмбриона на преимплантационное генетическое тестирование (20% от всех переходов в криопротокол в группе I и 15% – в группе II), маточный фактор, под которым подразумевали неудовлетворительное состояние эндометрия, а также риск синдрома гиперстимуляции яичников (СГЯ). Несмотря на отсутствие значимых различий, тенденция к более высокой частоте этого осложнения наблюдалась в группе II.
На этапе культивации эмбрионов было обнаружено, что как число зрелых ооцитов, так и количество эмбрионов высокого качества на 3-и и 5-е сутки были статистически значимо выше у женщин из группы I по сравнению с аналогичными показателями у женщин из группы II (табл. 3).
Поскольку часть циклов были переведены в криопротокол, провели анализ исходов программ ЭКО после переноса нативного и витрифицированного эмбриона (табл. 4).
Говоря о сегментированных циклах ЭКО, следует отметить, что на фоне приема МИ более высоким оказалось медианное число замороженных эмбрионов: в группе I оно составило 8 (2–12), а в группе II – 6 (1–10), р=0,04. К моменту окончания наблюдения не все сегментированные циклы оказались завершены, в первую очередь из-за сложной эпидемиологической ситуации весной 2020 г., связанной с вирусной инфекцией COVID-19.
В группе I таких циклов оказалось 9 (56%), а в группе II – 6 (28%), р=0,12.
Расчет ОШ наступления положительного исхода (биохимическая, клиническая и продолжающаяся беременность) при переносе нативного эмбриона и использовании комплекса МИ и ФК по сравнению с ФК был проведен у женщин с ожирением, СПКЯ и при повторной попытке ЭКО. Он показал, что у пациенток с ожирением ОШ в достижении биохимической беременности составило 4,8 (95% ДИ 0,98–23,54; р=0,05). В достижении клинической беременности, которая продолжалась до окончания срока наблюдения (10 недель), у пациенток с ожирением ОШ=5,2 (95% ДИ 1,06–25,97; р<0,001), с СПКЯ – ОШ=2,7 (95% ДИ 0,43–16,94; р=0,01), без СПКЯ – ОШ=1,5 (95% ДИ 0,25–8,98; р=0,003). Количество попыток ЭКО не имело статистического значения.
Таким образом, анализ исходов завершенных циклов позволил отметить, что включение в прегравидарную подготовку МИ положительно сказывается на частоте удовлетворительных исходов программ ЭКО, в том числе у женщин с ожирением и/или СПКЯ.
Обсуждение
Повышение результативности программ ВРТ – задача, актуальная во всем мире. Учитывая неблагоприятно высокую частоту распространенности женского ожирения, являющегося дополнительным фактором, осложняющим преодоление бесплодия, в том числе силами программ ЭКО [7], полученные нами данные позволяют рекомендовать женщинам с ИМТ более 30 кг/м2 включать в рацион при подготовке к циклам ЭКО комбинацию МИ и ФК. Как показало наше наблюдение, вероятной причиной наблюдаемого положительного влияния на исходы программы ВРТ этих биологически активных веществ может быть улучшение чувствительности ткани яичника к стимулу гонадотропином. Подобное заключение было сделано Caprio F. и соавт. [8], отмечавшими меньшую суммарную дозу гонадотропина на фоне приема МИ. Следует отметить, что в это исследование были включены женщины с бедным ответом на стимуляцию, но с нормальным ИМТ (от 23,3± 2,3 до 24,2±2,0 кг/см2), тогда как нам удалось наблюдать подобный эффект у женщин с ожирением.
Исследователи отмечают позитивное влияние МИ на качество ооцитов, однако в основном публикации касаются когорты женщин с СПКЯ. Действительно, среди причин неудач программ ЭКО у таких пациенток называют низкое качество ооцитов и (или) эмбрионов, а также риск СГЯ. Предваряя программу ВРТ приемом комплекса МИ и ФК за 3 месяца до стимуляции в цикле ЭКО, исследователи фиксируют улучшение реагирования ткани яичника на гормональный сигнал при меньшей дозе ФСГ, необходимой для оптимального развития фолликулов. Кроме того, отмечается снижение уровня эстрадиола в день триггера овуляции, что способствует снижению риска СГЯ и уменьшает число отмененных или незавершенных по этой причине циклов ЭКО [9–11]. В отношении риска СГЯ мы также смогли отметить тенденцию к его уменьшению в группе пациенток, принимавших МИ (1 против 4; р=0,17).
Вместе с тем не все авторы единодушны во мнении о целесообразности включения МИ в рацион перед циклом ЭКО. В обзоре Gupta D. и соавт. утверждается, что улучшение качества ооцитов и эмбрионов у женщин с СПКЯ после приема МИ перед программой ЭКО не является статистически значимым [12].
В наше наблюдение были включены женщины как с СПКЯ, так и без него. Выявленное нами снижение суммарной дозы гонадотропина в программе ЭКО согласуется с данными, полученными Chiu T.T.Y. и соавт. В их исследование также были взяты женщины как с СПКЯ, так и без этого заболевания. Авторы отмечают, что количество ФСГ, используемого для стимуляции яичников во время циклов ЭКО, снижается у женщин, чья фолликулярная жидкость содержит более высокие уровни МИ. По этим причинам включение МИ в рацион женщин, которым предстоит ВРТ, признается оправданным [13].
Нами отмечено, что прием МИ перед вступлением в программу ЭКО ассоциирован с извлечением зрелых ооцитов, а также получением эмбрионов хорошего качества. Аналогичные результаты удалось выявить Alviggi С. и соавт., показавшим, что прием женщинами с СПКЯ перед программой ЭКО курса МИ приводил к увеличению количества ооцитов MII: 6,3±2,5 против 4,5±2 у женщин, не принимавших МИ (р=0,03) [14]. Есть мнение, что СПКЯ не обязательно ассоциирован с ожирением, но при этом выявляется скрытое ожирение, оцениваемое по количеству висцеральной жировой ткани [15]. Вообще, в литературе редко упоминается ИМТ как маркер определенной группы прибегающих к ВРТ женщин, которым требуются дополнительные меры, в частности прегравидарной подготовки. Наше исследование показывает, что прием МИ такими женщинами за 12 недель до начала стимуляции в цикле ЭКО оказывает благоприятное влияние как на течение программы ВРТ, так и на ее результат.
Заключение
Включение в рацион женщины перед программой ЭКО комплекса МИ в дозе 4000 мг и ФК 400 мкг способствует уменьшению суммарной дозы используемого гонадотропина, сокращению продолжительности стимуляции, увеличению количества качественных ооцитов (МII) и эмбрионов на момент переноса.
В циклах ЭКО с переносом нативного эмбриона прием комплекса МИ и ФК способствует повышению частоты наступления биохимической беременности, а витрифицированного эмбриона – частоты и клинической, и продолжающейся беременности, а также снижению количества неудачных исходов, в том числе неразвивающейся беременности.
Прием комплекса МИ и ФК перед программой ЭКО способствует повышению вероятности достижения клинической и продолжающейся беременности по сравнению с приемом только ФК у женщин с ожирением и/или СПКЯ в циклах переноса нативного эмбриона.



