Согласно данным Всемирной организации здравоохранения, рак шейки матки (РШМ) является четвертым по распространенности среди женщин во всем мире; по оценкам, в 2018 г. ожидается 530 000 новых случаев заболевания и 270 000 смертей [1]. В Европе в 2016 г. было зарегистрировано 58 000 новых случаев РШМ. В США подсчитали, что в 2018 г. будет зарегистрировано 13 240 новых случаев РШМ и 4170 смертей [2]. В России ежегодно от РШМ умирают более 6000 больных, уровни одногодичной летальности остаются достаточно высокими, в среднем до 20% [2]. При анализе повозрастной структуры заболеваемости отмечается два пика: 35–39 лет и 60–64 года; при этом результаты многочисленных мировых статистических исследований свидетельствуют о неуклонном увеличении частоты выявления РШМ в репродуктивном возрасте [1, 2]. Так, например, в России за период 2006–2016 годов прирост заболеваемости РШМ в возрастной группе 20–29 лет составил 25,7%, а в группе 30–39 лет – 62,9%, при среднем темпе прироста 2,33% и 6,78% в год соответственно. Эти показатели являются весьма тревожными как в масштабе России, так и в общемировом, так как этот контингент больных является репродуктивно значимой частью женского населения и наиболее активной в социальном отношении группой населения [3, 4].
Основным прогностическим фактором, непосредственно влияющим на продолжительность жизни больных при РШМ, является степень распространения опухоли. По данным литературы, среднестатистическая общая пятилетняя выживаемость составляет 59%, при этом при микроинвазивном раке – 95–97%, при IБ стадии – 80–81%, при II – 75–76%, при III – 44-46% и при IV – 22–23% [5]. В связи с этим необходимы разработка и внедрение в практическое здравоохранение новых органосохраняющих подходов, способных обеспечить не только высокую эффективность лечения с онкологической точки зрения, но и полноценную медико-социальную реабилитацию больных РШМ [6, 7]. Основная задача органосохраняющей хирургии у больных РШМ состоит в сохранении менструальной и репродуктивной функций, без ущерба онкологической радикальности лечения [8, 9].
Таким образом, в настоящее время разработка новых технологий органосохраняющего лечения является приоритетной областью современных исследований в онкологии.
Клиническое наблюдение
Представлено клиническое наблюдение успешной реализации репродуктивной функции после радикальной трахелэктомии у больной РШМ IБ стадии. Больная К., 37 лет, поступила в отделение гинекологии НИИ онкологии Томского НИМЦ в июне 2017 г. Из анамнеза: менархе в 14 лет, установились сразу, по 4 дня через 28 дней, регулярные, умеренные, безболезненные. В 2002 г. – 1-е роды, в 2012 г. – сальпингэктомия слева по поводу пиосальпинкса. В 2013 г. впервые была выявлена эрозия шейки матки, проведена диатермокоагуляция в условиях женской консультации.
В мае 2017 г. в гинекологическом отделении по месту жительства была взята биопсия шейки матки, гистологическое заключение биоптата шейки матки: плоскоклеточный РШМ с инвазией до 6 мм. По данным жидкостной цитологии №2726: комплексы клеток, подозрительные на плоскоклеточный рак. При поступлении в НИИ онкологии проведено полное клинико-лабораторное обследование. При осмотре в зеркалах и бимануальном исследовании выявлено: наружные половые органы развиты правильно, оволосение по женскому типу, влагалище емкое. Шейка матки увеличена до 4,5 см, эрозирована, контактно кровоточит, на участке от 11 до 4 ч условного циферблата визуализируются единичные папиллярные разрастания. Своды эластичные, свободные. Тракции за шейку матки безболезненные, выделения из половых путей слизистые, скудные. Тело матки нормальных размеров, плотное, подвижное, безболезненное при пальпации. Область придатков матки справа свободна, слева в спайках, придатки ограниченно подвижные. Проведено кольпоскопическое исследование: влагалищная часть шейки матки покрыта многослойным плоским эпителием. В области передней губы маточного зева после применения 5% раствора уксусной кислоты четко визуализируется выпуклый участок эпителия, который слегка прокрашивается в уксусно-белый цвет. В направлении наружного зева видны многочисленные открытые железы. Между 11 и 4 ч условного циферблата визуализируются атипии сосудов высокой степени, многочисленные грубые точки, грубые мозаичные структуры, разорванные спутанные сосуды, а также трубчатые структуры капилляров. При соприкосновении с тканью отмечается повышенная кровоточивость. Проведение пробы Шиллера показало, что в области передней и задней губы маточного зева визуализируются многочисленные участки эпителия с отрицательной реакцией на йод. Взяты мазки-отпечатки для цитологического исследования и выполнена биопсия шейки матки под контролем кольпоскопии (участок от 2 до 4 ч). Цитологическое заключение: плоскоклеточный неороговевающий РШМ. Гистологическое заключение: плоскоклеточный неороговевающий РШМ с инвазией до 6–7 мм умеренной степени дифференцировки. Далее был проведен анализ ДНК вируса папилломы человека (ВПЧ), для выделения которого использовались соскобы из цервикального канала шейки матки. Применялась технология количественной мультиплексной полимеразной цепной реакции в режиме реального времени; у больной был выявлен 18 тип ВПЧ, lg>5. Опухолевый маркер SCC (антиген плоскоклеточной карциномы) в сыворотке крови – 1,7 нг/мл. По данным ультразвукового исследования (УЗИ), магнитно-резонансной томографии (МРТ) органов малого таза, брюшной полости: матка 34×31×42 мм, расположена обычно, с четкими ровными контурами. Миометрий однородной структуры, не изменен, М-эхо – 4 мм. Шейка матки 48×36×37 мм, зернистого неоднородного характера, в ее толще – единичные анэхогенные жидкостные включения до 5 мм, внутренний зев не расширен, цервикальный канал также не расширен. Контуры передней и задней губы неровные, четкие, определяются гиперэхогенные линейные штрихи без акустических эффектов. Яичники нормальных размеров, без патологии. Лимфатические узлы не увеличены.
После дообследования было принято решение о проведении органосохраняющего лечения в объеме: лапароскопии, радикальной трахелэктомии. Операция была проведена 16 января 2017 г. с использованием новых технологий, разработанных в Томском НИИ онкологии – определением сторожевых лимфатических узлов с целью улучшения ранней диагностики микрометастазов (патент РФ №2535614) и установкой имплантата из никелида титана для формирования запирательного аппарата матки и укрепления зоны анастомоза (патент РФ №2521848, патент РФ №2661077).
Предварительно за сутки до операции в подслизистое пространство по периметру опухоли был введен радиофармпрепарат «Алотех», введенная доза составила 80 МБк. Далее была выполнена регистрация распределения радиоактивного наноколлоида в тазовой области в режиме однофотонной эмиссионной компьютерной томографии на гамма-камере с двумя фиксированными детекторами «E.CAM180» (Siemens) спустя 18 ч после введения радиофармпрепарата «Алотех». Исследование выполняли при настройке гамма-камеры на фотопик излучения 99mTc (140 кэВ) при ширине энергетического окна дифференциального дискриминатора 15%. Для исследования использовали высокоразрешающий параллельный коллиматор для низких энергий излучения. Изображение регистрировали в 16 проекциях в матрицу 64×64. Время экспозиции на одну проекцию составляло 30 с. В результате проведенного исследования была определена предварительная локализация сторожевых лимфатических узлов: справа в области наружной подвздошной артерии, слева – в области запирательной ямки.
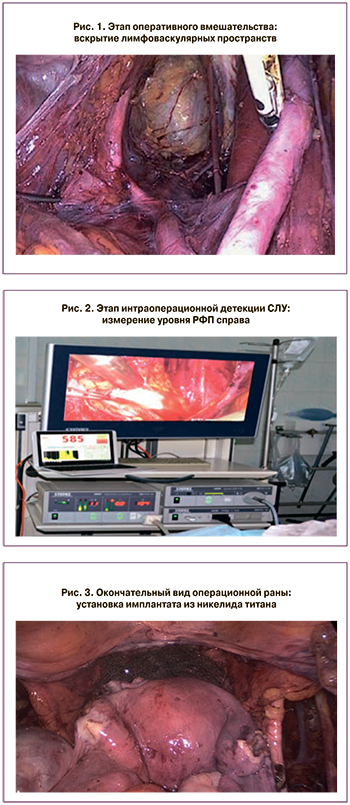 Оперативное вмешательство осуществлялось лапароскопическим доступом, выполнялось в условиях карбоксиперитонеума 12 мм рт. ст. и общего комбинированного обезболивания с применением миорелаксантов. Положение пациентки – в стандартной литотомической позиции с установкой маточного манипулятора с атравматичным наконечником. Этапы оперативного вмешательства представлены на рис. 1–3.
Оперативное вмешательство осуществлялось лапароскопическим доступом, выполнялось в условиях карбоксиперитонеума 12 мм рт. ст. и общего комбинированного обезболивания с применением миорелаксантов. Положение пациентки – в стандартной литотомической позиции с установкой маточного манипулятора с атравматичным наконечником. Этапы оперативного вмешательства представлены на рис. 1–3.
Первым этапом была проведена ревизия органов малого таза, из особенностей – выявлен спаечный процесс в области левых придатков и в переднем своде. Спайки рассечены, и далее было проведено вскрытие лимфоваскулярных пространств (пузырно-влагалищное, паравезикальные (медиальное и латеральное), параректальные (медиальное – Okabayashi, латеральное – Latzko), прямокишечно-влагалищное) с целью подготовки к интраоперационному определению сторожевых лимфатических узлов (рис. 1).
Для интраоперационной детекции сторожевых лимфатических узлов использовался лапароскопический гамма-сканер RadPointer – система, состоящая из гамма-зонда для измерения локальных концентраций радиофармпрепарата и специального программного обеспечения (рис. 2). Сторожевым считался лимфоузел с наибольшим уровнем гамма-излучения [10]. При помощи сканера был определен уровень радиоактивности в месте введения радиофармпрепарата (составил 1789 импульсов в секунду) и в проекции расположения сторожевых лимфатических узлов (справа 585 в области проксимального отдела наружной подвздошной артерии, слева 852 в области запирательной ямки). Полученные значения выражены в виде цифрового эквивалента с отображением полученных результатов на дисплее ноутбука (рис. 2). Далее выявленные лимфоузлы выделялись из окружающей клетчатки и извлекались в специализированном контейнере через 10-мм троакар. Далее была проведена тазовая лимфодиссекция в пределах стандартных границ с дальнейшей резекцией параметриев, туннелированием мочеточников, пересечением шеечной ветви маточной артерии и отсепаровки окружающих тканей от сводов влагалища. В отделении патоморфологии было проведено морфологическое экспресс-исследование выделенных сторожевых лимфатических узлов: лимфоузел разрезали острой бритвой на параллельные пластины размером 2 мм. С поверхности срезов делали мазки-отпечатки – по 6–10 на стекло. На один лимфоузел приходилось 4–6 стекол. Препараты просматривались с помощью микроскопа Zeiss Axio Scope. A1. После получения результатов морфологического исследования (данных за метастатическое поражение нет) был выполнен второй этап хирургического лечения – трахелэктомия. По линии проксимальной границы резекции морфологическое экспресс-исследование также показало отсутствие опухолевых клеток. Удаленные лимфатические узлы и шейка матки с клетчаткой были направлены на плановое гистологическое исследование.
Завершающим этапом операции явилось наложение маточно-влагалищного анастомоза, после чего проводились формирование запирательного аппарата матки и укрепление зоны анастомоза с использованием имплантата с памятью формы – сетки из сверхэластичной нити никелида титана. В полость малого таза имплантат был проведен через боковое троакарное отверстие. Сетка моделировалась по месту установки в границах от нижнего сегмента матки до верхней трети влагалища (рис. 3). С целью первичной иммобилизации имплантат был зафиксирован отдельными швами по периметру. Размеры сетки из никелида титана (марка ТН-1): ширина 4–5 см, длина 7–8 см, диаметр нити 0,1–0,08 мм, размеры ячейки сетки 3–5 мм. Длина сетчатого имплантата в пределах 5–7 см, что соответствует анатомии дефекта и позволяет сделать не менее одного полного оборота вокруг анастомоза с небольшим перекрытием. Сетчатый имплантат сплетен в виде чулка шириной 4–5 см из сверхэластичной никелид-титановой нити диаметром 0,08–0,1 мм с размером ячеек от 3 до 5 мм [5, 8].
Послеоперационный период протекал гладко, без осложнений. Гистологическое исследование послеоперационного материала №18926-46/18: плоскоклеточный рак с инвазией 7 мм, распространенность 8 мм, хронический цервицит в стадии обострения с незрелой метаплазией, границы резекции без атипии, без опухолевых эмболов и наличия метастазов в лимфоузлах. На контрольном ультразвуковом исследовании органов малого таза (24.12.17): состояние после радикальной трахелэктомии. Пациентка была выписана в удовлетворительном состоянии с рекомендациями о проведении динамического наблюдения 1 раз в 3 месяца в условиях НИИ онкологии.
В апреле 2017 г. (через 4 месяца после радикальной трахелэктомии) обратилась на прием; при контрольном обследовании выявлена беременность 6–7 недель. Наблюдение и ведение беременности проводилось на базе Томского перинатального центра. В сроке 29 недель и 3 дня пациентка была госпитализирована в отделение патологии беременных для динамического наблюдения и подготовки к родоразрешению. За время наблюдения неоднократно проводились УЗИ органов малого таза, кардиотокография плода: длина сформированного аппарата матки составила 1,5–1,8 см, данных за несостоятельность анастомоза выявлено не было.
8 декабря 2018 г. в сроке 38 недель и 3 дня было проведено плановое родоразрешение путем операции кесарева сечения; родилась девочка весом 3390 г, 8–9 баллов по шкале Апгар. При ревизии органов малого таза какая-либо патология и дефекты анастомоза выявлены не были. Интраоперационно было проведено контрольное цитологическое исследование из зоны анастомоза и забор смывов из брюшной полости. Данных за опухолевый процесс выявлено не было.
Послеоперационный период протекал без особенностей, заживление швов первичным натяжением, ребенок развивается без патологических отклонений.
Таким образом, представленное клиническое наблюдение интересно с нескольких позиций: достаточно быстрое наступление беременности после оперативного лечения, что можно объяснить применением менее травматичного лапароскопического доступа при оперативном вмешательстве. Высокая эффективность применения имплантата с памятью формы из никелида титана, позволившего сформировать запирательный аппарат матки во время беременности и укрепить маточно-влагалищный анастомоз, что способствовало вынашиванию беременности до доношенного срока. Кроме того, применение концепции сторожевых лимфатических узлов в дальнейшем позволит сократить объемы лимфодиссекции у данной категории больных, что значительно снизит травматичность операции и улучшит репродуктивные результаты.
Заключение
Приведенное клиническое наблюдение позволило сформулировать некоторые рекомендации при динамическом наблюдении и родоразрешении у данной категории больных:
- рекомендуемые сроки для госпитализации в акушерский стационар беременных пациенток после радикальной трахелэктомии – 27 недель и 3 дня;
- во время оперативного родоразрешения рекомендуется контрольное цитологическое исследование из зоны анастомоза и забор смывов из брюшной полости;
- возможно сохранение матки после родоразрешения путем операции кесарева сечения при отсутствии данных за рецидив опухолевого процесса по результатам интраоперационного морфологического исследования.



