На сегодняшний день рак шейки матки (РШМ) является важнейшей мировой медицинской и социальной проблемой и занимает 2-е место среди всех злокачественных новообразований женской репродуктивной системы после рака молочной железы (РМЖ) [1, 2]. С каждым годом отмечаются рост заболеваемости и «омоложение» возраста пациенток с патологией шейки матки. По данным Международного агентства по изучению рака, стандартизированные показатели заболеваемости РШМ в 2012 г. составили 14,0 случаев на 100 000 женщин: из них в развитых странах – 9,9 ‱o, в развивающихся – 15,7‱o [3–5]. В России более 6,2 тысяч женщин ежегодно умирают от РШМ (4,6% среди всех злокачественных новообразований у женщин) [2]. Углубленное изучение патогенеза, поиск новых методов ранней диагностики и эффективных методов лечения патологии шейки матки представляется нам перспективным научным направлением, и, в конечном итоге, позволит улучшить данную неутешительную статистику.
Развитию диспластических процессов шейки матки способствуют многие внешние и внутренние факторы, наиболее значимыми из которых являются инфицированность вирусом папилломы человека (ВПЧ) [6], локальное воспаление [7] и окислительный стресс [8, 9]. Данная триада запускает триггерный механизм повреждения шеечного эпителия, что в конечном счете может привести к развитию РШМ. Окислительный стресс – это внутриклеточный дисбаланс между повышенным производством активных форм кислорода (АФК), разрушающих биологические молекулы, и сниженной активностью системы антиоксидантной защиты клетки [10]. АФК постоянно генерируются в аэробных клетках путем неполного восстановления молекулярного кислорода в молекулы воды во время митохондриального окислительного фосфорилирования, а также при воспалительных процессах, инфекциях, механических и химических повреждениях клеток, воздействии ультрафиолетового излучения и ионизирующего облучения [11, 12]. Эффект АФК на клетку напрямую зависит от их уровня: низкий уровень АФК поддерживает многие физиологические жизненно необходимые процессы, такие как клеточная пролиферация, дифференцировка и апоптоз, поддержание физико-химических свойств биологических мембран и регуляция активности протеинкиназ. Однако при высоком уровне АФК необратимо повреждают биологические макромолекулы, что приводит к гибели клеток [13].
Параоксоназы – это семейство ферментов, представленное PON1, PON2, и PON3, которые регулируют многие клеточные процессы за счет воздействия на рецепторы, активируемые пероксисомными пролифераторами PPAR [14]. Гены PON1 и PON3 присутствуют практически во всех клетках организма человека, а сами ферменты циркулируют в плазме в состоянии, связанном с липопротеинами высокой плотности (ЛПВП) [14, 15]. PON2 является внутриклеточным ферментом и не обнаруживается в плазме [14, 15]. По химическим свойствам параоксоназы относятся к классу гидролаз. Они нейтрализуют свободные радикалы кислорода, защищают липиды клеточных мембран от перекисного окисления, обладают противовоспалительными свойствами, а также регулируют процессы апоптоза [15]. Снижение активности параоксоназ сопровождается увеличением выраженности окислительного стресса и риска развития сосудистых, обменных нарушений, воспалительных заболеваний и опухолевого роста [16]. Изучив структуру и функции параоксоназ, мы выдвинули предположение, что данные ферменты могут влиять и на развитие диспластических процессов шейки матки. Несмотря на то что факторы риска развития РШМ достаточно хорошо изучены и в практику внедрены многие скрининговые программы, механизмы перехода дисплазии шейки матки в рак до сих пор остаются неизвестными. В связи с этим прогнозирование, ранняя диагностика и лечение остаются дискуссионными вопросами.
Цель исследования – изучить уровень экспрессии генов, кодирующих ферменты PON1, PON2 и PON3, в эпителии шейки матки здоровых женщин и при дисплазии шейки матки (цервикальная интраэпителиальная неоплазия (CIN) I–II и CIN II–III). Провести сравнительный анализ уровня экспрессии PON1, PON2 и PON3 между группами. Выявить взаимосвязь изменения уровня экспрессии параоксоназ с развитием диспластических процессов шейки матки.
Материалы и методы
В исследовании принимали участие 47 пациенток, которые были разделены на 3 группы: 1-я – пациентки с CIN I–II (n=16), 2-я – пациентки с CIN II–III (n=17), 3-я – здоровые женщины (n=14). Проведен анализ экспрессии генов, кодирующих PON1, PON2 и PON3, с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием праймеров, специфичных для данных генов.
Критерии включения в исследование: для 1-й и 2-й групп: пациентки в возрасте от 18 до 46 лет с установленными диагнозами CIN I–II и CIN II–III на основании цитологического и гистологического методов исследования; для группы контроля: женщины в возрасте от 18 до 46 лет с отсутствием патологии шейки матки при кольпоскопическом и цитологическом методах исследования.
Критерии исключения общие: женщины ювенильного, перименопаузального и постменопаузального периода (младше 18 лет и старше 46 лет); онкологические заболевания; острые воспалительные заболевания; тяжелая экстрагенитальная патология; аутоиммунные заболевания.
На первом этапе молекулярно-генетического исследования проводили биопсию шейки матки. При заборе в каждый образец добавляли 1 мл тризола с целью ингибирования работы РНКаз, затем гомогенизировали и быстро замораживали при температуре –80˚С. Выделение тотальной мРНК проводилось по протоколу Matz, 2002 г., синтез первой цепи кДНК – по протоколу фирмы «Евроген» для последующей амплификации генов. Уровень экспрессии PON1, PON2 и PON3 определяли методом ПЦР с обратной транскрипцией в реальном времени с помощью амплификатора LightCycler 96 Real-Time PCR System (Roche) с использованием праймеров, специфичных для PON1, PON2 и PON3 (таблица).
Условия проведения ПЦР следующие: 1 – предварительный нагрев 5 минут, 2 – 45 циклов (10 с – 95°, 30 с – 60°). Нормирование образцов кДНК проводилось по контрольному гену АСТВ, кодирующему актин. Затем проводили анализ экспрессии генов PON1, PON2 и PON3 в образцах.
Статистическая обработка результатов проведена с использованием компьютерной программы IBM SPSS Statistics 20. Описательные статистические данные представлены как абсолютные частотные значения. Значимость различий между выборками оценивали при помощи непараметрического статистического U-критерия Манна–Уитни. Описательная статистика количественных признаков представлена в виде среднего арифметического (М) и стандартной ошибки среднего (m) в формате М (m). Статистически значимыми считали различия при р<0,05.
 Результаты
Результаты
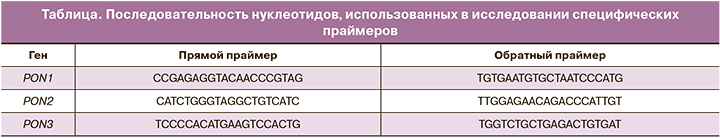
По результатам проведенного нами исследования установлено значимое повышение уровня экспрессии гена PON3 в эпителии шейки матки женщин с диспластическими процессами шейки матки относительно группы контроля (p<0,05, непараметрический критерий Манна–Уитни). Результаты графически отображены на рис. 1.
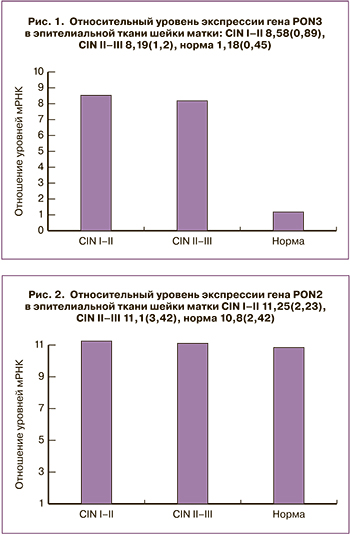
Стоит также отметить, что уровень экспрессии PON3 в 1-й и 2-й группах практически не отличался, следовательно, экспрессия PON3 не зависит от степени тяжести дисплазии. Не выявлено значимых отличий уровня экспрессии PON2 между всеми тремя группами (p>0,05, непараметрический критерий Манна–Уитни, рис. 2). Во всех образцах отсутствовала экспрессия гена PON1.
Заключение
В ходе исследования нами была выявлена четкая взаимосвязь между повышением уровня экспрессии PON3 и наличием CIN. Полученные результаты свидетельствуют о возможной роли фермента PON3 в развитии диспластических процессов; следовательно, определение уровня экспрессии PON3 может иметь определенный клинический потенциал в диагностике предраковых заболеваний шейки матки. Таким образом, требуется проведение дальнейших научных исследований в данном направлении с целью разработки новых прогностических маркеров диагностики дисплазии шейки матки, диагностических маркеров перехода CIN в рак, что позволит повысить качество ранней диагностики предраковых заболеваний шейки матки и оптимизировать дифференцированную лечебную тактику.



