Задержка роста плода (ЗРП) — актуальная проблема современного акушерства, занимающая одно из ведущих мест в структуре перинатальной заболеваемости и смертности. Наряду с инфекционными причинами и врожденными аномалиями развития плода ЗРП вносит весомый вклад в перинатальную смертность [1]. ЗРП оказывает влияние не только на внутриутробное состояние плода, но и на последующее развитие ребенка, определяя уровень его здоровья на протяжении жизни [2–4]. Частота ЗРП в различных странах варьирует и имеет обратную зависимость с уменьшением срока беременности. ЗРП чаще встречается в странах с ограниченными ресурсами. Примерно 10% доношенных детей в развитых странах – это дети, «малые к сроку гестации». В то время как в развивающихся странах этот показатель составляет 23% [5]. На территории РФ в настоящее время данная патология встречается в 5–18% случаев [1, 6].
Ранняя форма встречается в 20–30% случаев и в 50% ассоциирована с ранней преэклампсией, сопряжена с тяжелой плацентарной недостаточностью и хронической гипоксией плода. Поздняя форма ЗРП регистрируется в 70–80% случаев ЗРП и сочетается с преэклампсией не более чем в 10% случаев [7]. Очевидно, что как ранняя, так и поздняя ЗРП связаны с нарушениями функции плаценты, но до сих пор неизвестно, аналогичны ли эти изменения в случае ранней и поздней ЗРП. Плацентарная недостаточность при ранней ЗРП является следствием нарушения ранней имплантации [8]. Не совсем ясно, является ли поздняя ЗРП результатом нарушения ранней имплантации или же исходом нарушений функции плаценты во второй половине беременности. В пользу последнего утверждения свидетельствуют отклонения показателей допплерометрии маточных артерий в III триместре беременности при нормальных показателях в более ранние сроки [9].
Определение сроков манифестации задержки роста плода является важной задачей для клиницистов ввиду разных патогенетических путей и различных по тяжести перинатальных исходов для новорожденных с ранней и поздней формой ЗРП. В связи с недостаточной точностью пренатальной диагностики в ряде случаев ранняя ЗРП диагностируется на более поздних сроках, что повышает вероятность антенатальной гибели плода, а также риски неблагоприятных перинатальных исходов [10]. Вышесказанное определяет необходимость поиска маркеров, позволяющих дифференцировать две патогенетически различные формы данного осложнения беременности и, таким образом, снизить риски для новорожденных.
В настоящее время этиопатогенетические механизмы развития ЗРП до конца не изучены. Известно, что в основе больших акушерских синдромов, в том числе ЗРП, лежит окислительный стресс [11–14]. Большинство исследований свидетельствуют об усилении окислительного стресса при ЗРП. Однако в настоящее время данные о различиях в функциональном состоянии про- и антиоксидантной систем при ранней и поздней форме ЗРП ограничены [15–17].
В связи с чем целью нашего исследования явилось изучение функционального состояния про- и антиоксидантной систем плазмы крови беременной при задержке роста плода с ранней и поздней манифестацией.
Материалы и методы
Были обследованы 82 беременные. Из них основную группу составила 41 пациентка. Подгруппу Ia составили 20 беременных с ранней формой ЗРП (манифестировавшей до 34 недель гестации), подгруппу Ib – 21 пациентка с поздней ЗРП (манифестировавшей после 34 недель беременности). В группу сравнения была включена 41 женщина. Критериями включения в исследование явились: возраст 18–45 лет; одноплодная беременность, наступившая в естественном цикле, в сроке 26–40 недель, добровольное информированное согласие на участие в исследовании; для основной группы – беременность, осложнившаяся ЗРП, для группы сравнения – одноплодная беременность без ЗРП. Критериями невключения для обеих групп явились: тяжелая экстрагенитальная патология; беременность, наступившая в результате ВРТ; преэклампсия; многоплодная беременность; пороки развития плода; генетические и острые инфекционные заболевания матери.
У всех женщин, включенных в исследование, перед родоразрешением производился забор периферической венозной крови. Образцы крови собирали в пробирки VACUETTER® с ЭДТА, затем центрифугировали в течение 20 минут при 300 g (t=4°C), отобранную плазму повторно центрифугировали в течение 10 минут при 14 000 g. В образцах плазмы крови беременных определялись уровни маркеров окислительного стресса (продукты перекисного окисления липидов (ПОЛ): малоновый диальдегид (МДА) и 4-ГН) с помощью спектрофотометрии; активность антиоксидантов: каталазы – полярографическим методом, ГП, супероксиддисмутазы (СОД), а также содержание общего, окисленного и восстановленного глутатиона – спектрофотометрическим методом, содержание СОД1, СОД2, каталазы – с помощью вестернблоттинга.
Статистический анализ
Для статистической обработки результатов использовали скрипты, написанные на языке R, и программу RStudio, а также Microsoft Office Excel 2016 и пакеты прикладных программ Statistica v.13.0, StatSoft Inc. (США). Соответствие анализируемых параметров закону нормального распределения оценивали по значениям теста Шапиро–Уилка. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD) в формате М (SD). Статистический анализ количественных данных с нормальным распределением проводили с помощью теста Стьюдента. Для описания качественных показателей использовали абсолютные значения и процентное соотношение. Для сравнения групп использовали тест χ2. Также определялись отношение шансов (ОШ) и его доверительный интервал (ДИ). Величину порогового уровня значимости p принимали равной 0,05. Для оценки возможности классификации пациентов по группам ранней и поздней форм ЗРП на основании исследуемых параметров были разработаны модели логистической регрессии. В качестве независимых переменных в модели рассматривали параметры, величины которых статистически значимо отличались между указанными группами, в качестве независимой переменной выступала принадлежность пациентки к группе ранней или поздней форм ЗРП. Для каждой модели были определены критерий Вальда, 95% ДИ, ОШ и его ДИ. Качество построенной модели определяли путем построения ROC-кривой, определения площади под ROC-кривой (AUC), а также расчета чувствительности, специфичности, прогностической ценности положительного результата (ПЦПР), прогностической ценности отрицательного результата (ПЦОР) разработанной модели.
Результаты и обсуждение
Все пациентки, включенные в исследование, были сопоставимы по возрасту и массо-ростовым показателям. Следует отметить преобладание хронической артериальной гипертензии (ХАГ) (n=8; 40%; ОШ=0,08; ДИ=0,01–0,7; p≤0,05), миопии (n=11; 55%; ОШ=0,2; ДИ=0,1–0,8; p≤0,05) и варикозного расширения вен (n=5; 25%; р=0,05) в подгруппе ранней ЗРП. Изучение течения беременности показало, что в группе пациенток с ЗРП чаще отмечалась артериальная гипертензия: в I (n=3; 7,3%; ОШ=0,3; ДИ=0,03–3,2); р>0,05), во II (n=5; 12,1%; ОШ=0,4; ДИ=0,1–2,0; р>0,05) и в III триместрах (n=16; 39%; ОШ=0,1; ДИ=0,01–0,6; р≤0,05) с преобладанием в подгруппе ранней ЗРП. Также в основной группе чаще выявляли маловодие (n=26; 65%; ОШ=5,1; ДИ=2–13,1; р≤0,05), что следует рассматривать как одно из проявлений ЗРП.
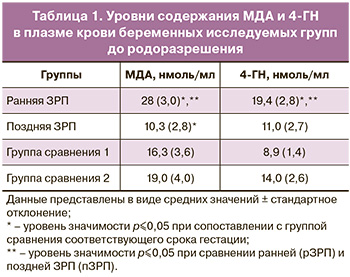 Для получения полного представления о функциональном состоянии про- и антиоксидантной систем, а также определения диагностической роли маркеров окислительных повреждений и антиоксидантной защиты при ранней и поздней формаx ЗРП был оценен окислительный статус плазмы крови беременных в исследуемых группах. Сравнительный анализ установил повышенные уровни продуктов ПОЛ (МДА и 4-ГН) в плазме крови беременных с ранней ЗРП относительно группы сравнения и поздней ЗРП (p<0,001). При поздней ЗРП выявлено статистически значимое снижение (p<0,001) уровня содержания МДА относительно группы сравнения. Данные представлены в таблице 1.
Для получения полного представления о функциональном состоянии про- и антиоксидантной систем, а также определения диагностической роли маркеров окислительных повреждений и антиоксидантной защиты при ранней и поздней формаx ЗРП был оценен окислительный статус плазмы крови беременных в исследуемых группах. Сравнительный анализ установил повышенные уровни продуктов ПОЛ (МДА и 4-ГН) в плазме крови беременных с ранней ЗРП относительно группы сравнения и поздней ЗРП (p<0,001). При поздней ЗРП выявлено статистически значимое снижение (p<0,001) уровня содержания МДА относительно группы сравнения. Данные представлены в таблице 1.
В плазме крови беременных при ранней ЗРП наблюдали сниженную активность антиоксидантных ферментов СОД и ГП относительно группы сравнения и поздней ЗРП, а активность каталазы, напротив, была повышена. Известно, что СОД нейтрализует супероксид-анион с образованием перекиси, которую утилизирует каталаза. Однако, несмотря на увеличенную активность каталазы, ее недостаточно для утилизации перекиси, то есть обеспечения адекватной антиоксидантной защиты, о чем свидетельствуют повышенные уровни продуктов ПОЛ (МДА и 4-ГН) в плазме крови беременных при ранней ЗРП. Интересно отметить, что, несмотря на сниженную активность СОД и ГП при ранней ЗРП, содержание СОД1 и СОД2 было также снижено относительно группы сравнения. При поздней ЗРП отмечалась низкая активность антиоксидантных ферментов СОД и ГП. При этом содержание СОД1, СОД2 и каталазы при поздней ЗРП было статистически значимо снижено относительно группы сравнения (табл. 2).
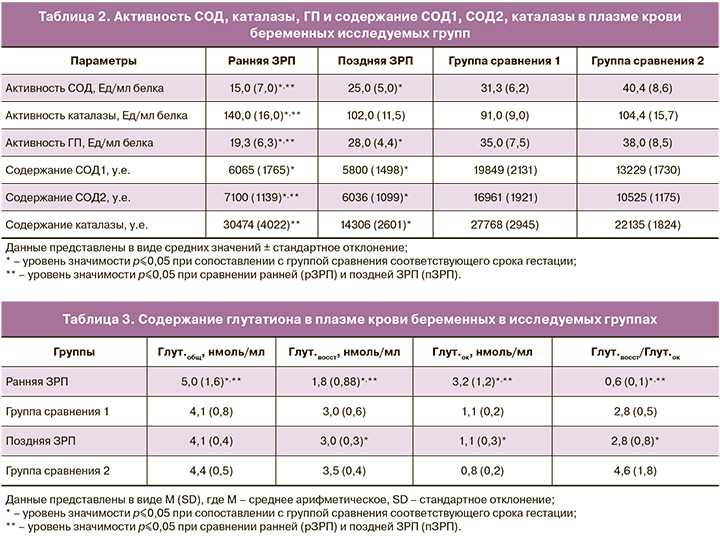
Обобщая данные о состоянии про- и антиоксидантной систем матери, можно сделать вывод о выраженности окислительного стресса при наблюдающейся сниженной антиоксидантной активности в плазме крови беременной при ранней ЗРП. При поздней ЗРП, несмотря на низкие показатели окислительного стресса, активность антиоксидантных ферментов и их содержание находились на подпороговом уровне, что, по-видимому, отражает сниженный общий защитный антиоксидантный потенциал организма матери. Известно, что окислительный стресс нарастает при физиологически протекающей беременности с увеличением срока гестации и сопровождается компенсаторной активностью антиоксидантных ферментов [15, 16]. А нарушение ремоделирования спиральных артерий и последующая аномальная плацентация запускают неконтролируемый окислительный стресс, что наблюдается в случае ранней ЗРП [16]. Низкие показатели окислительного стресса при поздней ЗРП, вероятно, связаны с низким уровнем системного воспалительного ответа различной этиологии, что позволяет пролонгировать беременность с учетом особенностей беременной.
Данные о содержании глутатиона в плазме крови беременных представлены в таблице 3. Следует отметить, что соотношение Глутвосст./Глуток. было сниженным в плазме крови матери как при ранней, так и при поздней ЗРП.
Результаты проведенного исследования указывают на различия в уровнях окислительного стресса при ранней и поздней формах ЗРП. Данные представлены на рисунке.
Принимая во внимание полученные данные, был разработан набор моделей логистической регрессии, позволяющих дифференцировать раннюю и позднюю формы ЗРП. Каждая модель основывалась на одном из параметров, уровни которого статистически значимо отличались между группами ранней и поздней форм ЗРП. Характеристики полученных моделей сведены в таблице 4.
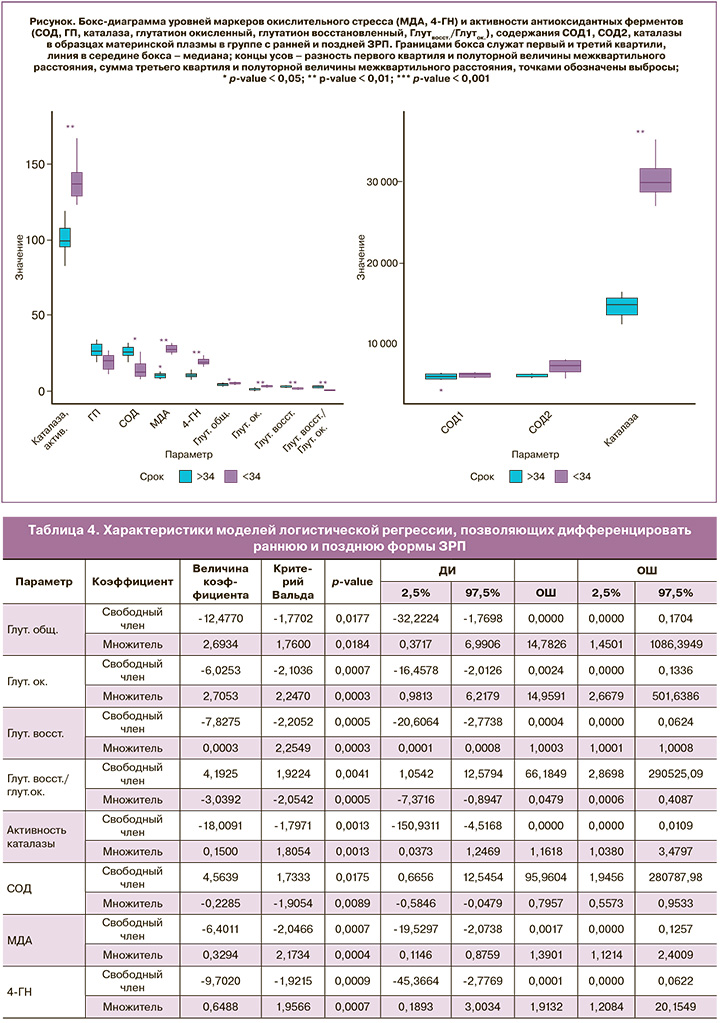
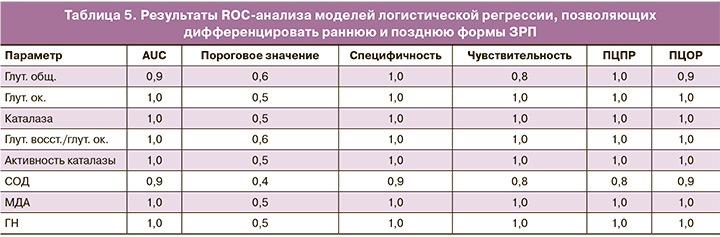
Для оценки эффективности моделей был выполнен ROC-анализ. Результаты ROC-анализа сведены в таблице 5. ROC-анализ продемонстрировал, что определение вышеуказанных специфичных маркеров про- и антиоксидантных систем в плазме крови беременных и использование предложенных моделей логистической регрессии позволяет с высокой чувствительностью и специфичностью дифференцировать раннюю и позднюю формы ЗРП.
Заключение
Таким образом, полученные результаты, с одной стороны, дополнили наши представления о патогенетических особенностях ранней и поздней форм задержки роста плода, с другой, позволили выделить новые неинвазивные маркеры дифференциальной диагностики патогенетически различных форм данного синдрома, что позволит клиницистам определиться с оптимальной акушерской тактикой для улучшения перинатальных исходов. Требуются дальнейшие исследования для уточнения роли выявленных изменений показателей про- и антиоксидантной систем в патогенезе задержки роста плода.



