Семейная средиземноморская лихорадка (ССЛ) – это наследственное, генетически детерминированное аутовоспалительное заболевание с характерной клинической картиной в виде периодических приступов лихорадки и серозитов, которые могут привести к повышению сократительной функции матки и неблагоприятным исходам беременности [1]. Ген MEFV (Mediterranean FeVer) расположен на коротком плече хромосомы 16 (16р13,3) и состоит из 10 экзонов. Большинство связанных с ССЛ миссенс-мутаций находятся в экзонах 2, 3, 5 и 10. Основным препаратом в лечении ССЛ является колхицин. Воздействие ССЛ на репродуктивную систему и пожизненная колхициновая терапия вызывают обеспокоенность по поводу их влияния на исходы беременности. В конце прошлого столетия вышли в свет первые работы, посвященные изучению репродуктивной функции у пациенток с ССЛ [2–4]. Потенциальные осложнения ССЛ (амилоидоз), воздействие самого заболевания (субклиническое воспаление) и лечения (колхицин) могут серьезно повлиять на фертильность и беременность [1, 5, 6]. Особую озабоченность вызывает проблема исходов беременности у женщин с почечным амилоидозом, поскольку при этом повышается риск аборта, мертворождения или ухудшения функции почек [7–9]. В последние годы появились исследования, отмечающие умеренную тенденцию к лучшему исходу беременности у пациенток, получающих колхицин [5]. Согласно приведенным данным, прием колхицина следует продолжать во время беременности, поскольку отказ от лечения может усугубить симптомы и ухудшить прогноз рождаемости [5, 6, 10, 11]. Исследований, изучающих влияние ССЛ и колхицина на течение и исходы беременности, мало. Большинство публикаций представляют собой обзоры, в которых обобщены предыдущие результаты [12–15]. Поэтому мы решили изучить эту проблему среди наших пациенток в Армении.
Цель работы: изучить течение и исходы беременности у пациенток с ССЛ.
Материалы и методы
Проведено обсервационное когортное исследование, сравнивающее исходы 251 беременностей у женщин с CCЛ и 312 беременностей – без ССЛ (проведение исследования одобрено местным Этическим комитетом). В ходе исследования на первом этапе была сформирована группа (когорта) женщин из 4577 пациенток репродуктивного возраста (18–49 лет) с подтвержденным диагнозом ССЛ, которая последовательно выбрана из регистра учета и сбора информации Центра медицинской генетики и первичной охраны здоровья (ЦМГ), Ереван, Армения, за 1998–2018 гг. Регистр включал в себя клинико-лабораторные и генетические данные 32 000 лиц армянской национальности, обследованных на наличие мутаций гена MEFV. На втором этапе сформирована исследовательская группа с нарушениями репродуктивной функции: 211 пациенток, выбранных из числа женщин с подтвержденным диагнозом ССЛ, и 162 пациентки с неподтвержденным диагнозом ССЛ. Изучены течение и исходы беременностей в обеих группах. Критерии включения: завершение беременности или ее прекращение, акушерские осложнения, перинатальные исходы. Критерии исключения: возраст, выходящий за пределы репродуктивного (младше 18 и старше 49 лет), злокачественные новообразования, сердечно-сосудистые и системные заболевания. На всех пациенток была заполнена большая карта, содержащая демографические, клинические и лабораторные исследования, а также результаты акушерско-гинекологического обследования, дородового наблюдения, методов родоразрешения и перинатальных исходов, внесенные в единую компьютеризированную перинатальную базу данных.
Диагноз ССЛ был подтвержден с использованием международных критериев Tel-Hashomer [16] и молекулярно-генетическим анализом 12 наиболее распространенных MEFV-мутаций в армянской популяции. Для каждого пациента была рассчитана степень тяжести заболевания, принимая во внимание возраст начала заболевания, частоту приступов, наличие артропатии, рожистую сыпь, протеинурию и почечные осложнения или плохую реакцию на прием колхицина. Выявлены 3 степени тяжести клинических проявлений ССЛ: легкая (2–5), средняя (6–9), тяжелая (>10) [16, 17].
Молекулярно-генетические методы диагностики ССЛ
Молекулярно-генетическое исследование выполнено под руководством заведующей лабораторией генетики аутовоспалительных заболеваний ЦМГ, д.б.н., проф. А.С. Айрапетян. Материалом для определения мутаций гена MEFV служила цельная периферическая кровь. Забор крови проводили из локтевой вены в специальные пробирки с EDTA для предотвращения свертывания крови и деградации ДНК. Для выделения ДНК использовались специальные наборы MOBIO laboratories (Ultra Clean Blood DNA Isolation Kit, USA). Мутации определялись методом мультиплексной амплификации участка ДНК, содержащего исследуемый ген, с реверс-гибридизацией полученных ампликонов, контролем в параллельном исследовании и визуализации мутаций с помощью ферментативной реакции (Vienna Lab FMF&SAA1 Assay).
Гибридизацию продуктов амплификации производили с тестовой полоской, содержащей аллель-специфичные пробы олигонуклеотидов, иммобилизированных как тест параллельных линий. Анализ охватывал следующие 12 мутаций MEFV: E148Q, P369S, F479L, M680I (G/C), M680I (G/A), I692del, M694V, M694I, K695R, V726A, A744S, R761H.
Акушерско-гинекологическое обследование включало стандартный антенатальный протокол наблюдения за беременностью высокого риска.
Статистический анализ
Результаты исследования обрабатывались с помощью пакета прикладных программ SPSS Statistics 16.0. Для описания количественных данных, имеющих нормальное распределение, использовалось среднее арифметическое (M) и стандартное отклонение (CD). Качественные показатели представлены в абсолютных и относительных величинах (%). При нормальном распределении признаков и равенстве дисперсий в сравниваемых группах использовались параметрические методы статистического анализа. Статистическую значимость различий показателей (p) определяли с помощью t-критерия Стьюдента. Для сравнения групп по качественным бинарным признакам использовался критерий χ2 Пирсона c поправкой Йейтса на непрерывность. В случае количественных ограничений применялся точный критерий Фишера (двусторонний вариант). Для изучения возможной связи между определенным исходом и фактором риска в сравниваемых группах производилась обработка данных с использованием программного обеспечения GraphPad Prism 4 и GraphPad Prism 5. Вычислялся коэффициент относительного риска (ОР) с 95% доверительным интервалом (ДИ). Оценку значимости ОР производили с помощью расчета границ 95% ДИ. Вывод о статистической значимости выявленной связи между фактором риска и исходом при уровне значимости р<0,05 делался в случае, если ДИ не включал 1, т.е. оба значения границ были или выше, или ниже 1. Результаты считались статистически значимыми при значении ОР>1, р<0,05.
Результаты
Изучены течение и исходы 251 беременности у 211 пациенток с ССЛ в возрасте от 18 до 45 лет, в среднем 21,3 (6,4) года – 1-я группа (основная), и 312 беременностей у 162 женщин без ССЛ, средний возраст 31,4 (7,0) года – 2-я группа (контрольная). Без осложнений развивались 149 беременностей (59,3%) в 1-й группе и 190 (61,0%) – во 2-й. Основные осложнения беременности представлены в таблице 1. У пациенток с ССЛ наиболее часто встречались следующие осложнения: ранние выкидыши – 40 в 1-й группе и 51 – во 2-й (15,9% против 16,3%; р=0,326) (ОР=0,9; 95% ДИ 0,7–1,3); эктопические беременности (ЭБ) – 17 в 1-й группе и 9 – во 2-й (6,8% против 2,9%) (ОР=1,5; 95% ДИ 1,1–2,7; р=0,018); угрожающее прерывание беременности (УПБ) – 13 в 1-й группе и 10 – во 2-й (5,2% против 3,2%) (OР=1,3; 95% ДИ 0,7–2,5; р=0,236). Показатели достигли статистической значимости только при ЭБ.
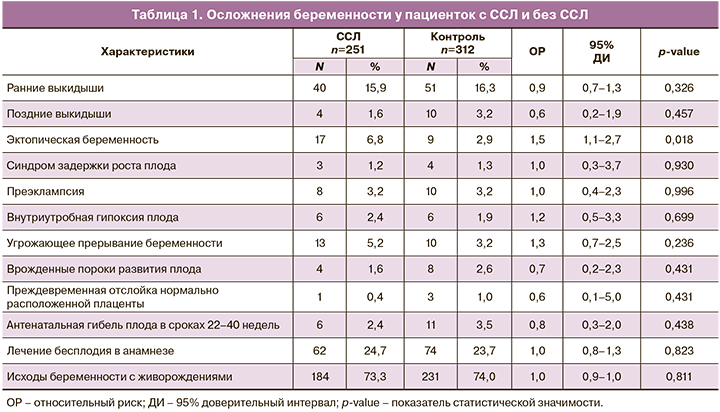
Существенных различий между группами не обнаружено при сравнении следующих показателей: поздние выкидыши – 4 и 10 соответственно (1,6% против 3,2%; р=0,457) (OР=0,6; 95% ДИ 0,2–1,9); ПОНРП – 1 в 1-й группе и 3 во 2-й (0,4% против 1,0%; р=0,431) (OР=0,6; 95% ДИ 0,1–5,0); СЗРП – 3 и 4 соответственно (1,2% против 1,3%; р=0,930) (OР=1,0; 95% ДИ 0,3–3,7); ПЭ – 8 и 10 соответственно (3,2% против 3,2%; р=0,996) (OР=1,0; 95% ДИ 0,4–2,3); внутриутробная гипоксия плода – 6 и 6 соответственно (2,4% против 1,9%; р=0,699) (OР=1,2; 95% ДИ 0,5–3,3); АГП – 6 и 11 соответственно (2,4% против 3,5%; р=0,438) (OР=0,8; 95% ДИ 0,3–2,0); ВПР – 4 и 8 соответственно (1,6% против 2,6%; р=0,431) (OР=0,7; 95% ДИ 0,2–2,3). Число беременностей, наступивших после лечения бесплодия, было сопоставимым в обеих группах: 62 и 74 соответственно (24,7% против 23,7%; р=0,823) (OР=1,0; 95% ДИ 0,8–1,3).
Для изучения влияния колхицина на клиническое течение заболевания и исходы беременности у женщин с ССЛ сравнивались: 131 беременность (52,2%), сопровождающаяся приемом колхицина (1-я группа), со 120 беременностями (47,8%) без колхицина или с нерегулярным приемом препарата (2-я группа). В 1-й группе прием колхицина был регулярным, в дозах 0,5–2,0 мг/сут. Лечение было начато непосредственно после установления клинического диагноза, продолжено в периконцепционном периоде и во время беременности в тех же дозах, как и до беременности, что позволяло достичь контроля над приступами с минимизацией субклинического воспаления между атаками. Во время беременности оценивались частота и интенсивность атак. Ухудшения клинического течения ССЛ не было ни в одном случае. В 116 (88,5%) наблюдениях клиническое течение ССЛ осталось без изменений, и во время 15 (11,5%) беременностей число атак уменьшилось. В 1-й группе частота УПБ и эктопической имплантации плодного яйца была одинаковой и составила 4,6 и 4,6% (по 6 соответственно). Наблюдались следующие осложнения беременности: ранние выкидыши – 18 (13,7%); поздние – 2 (1,5%); СЗРП – 1(0,8%); внутриутробная гипоксия плода и ВПР – по 2 наблюдения соответственно (1,5% и 1,5%); АГП – 3 (2,3%); ПЭ – 4 (3,1%); ПОНРП – 0 (0,0%). Семь беременностей завершились преждевременными родами (ПР) (5,3%), 6 – индуцированными родами (4,6%). Родоразрешение путем кесарева сечения (КС) имело место в 13(9,9%) случаях.
Сто двадцать беременностей во 2-й группе не сопровождались приемом колхицина, или его употребление было нерегулярным и в недостаточных дозах (92 и 28 беременностей соответственно) из-за опасений тератогенного эффекта препарата, а также вследствие несвоевременной диагностики ССЛ. Клиническое течение ССЛ ухудшилось во время 102 беременностей (85,0%), число атак осталось без изменений в 18 наблюдениях (15,0%); ни в одном случае улучшения не наблюдалось. Во 2-й группе частота УПБ составила 7,5% (9 наблюдений); ЭБ – 9,2% (11 наблюдений), ранних выкидышей – 18,3% (22 наблюдения); поздних – 1,7% (2 наблюдения); СЗРП – 1,7% (2 наблюдения); внутриутробной гипоксии плода – 3,3% (4 наблюдения); ВПР – 1,7% (2 наблюдения); АГП – 2,5% (3 наблюдения); ПОНРП – 0,83% (1 наблюдение); ПЭ – 3,3% (4 наблюдения). Десять беременностей завершились ПР (8,3%); индуцированные роды были в 6 случаях (5,0%). Родоразрешением путем КС завершилось 11 беременностей (9,2%).
Таким образом, у пациенток, регулярно употребляющих колхицин в адекватных дозах, клиническое течение заболевания было контролируемым: число атак оставалось без изменений, обнаружено снижение частоты УПБ (4,6% против 7,5%; p=0,236) и внутриутробной гипоксии плода (1,5% против 3,3%; p=0,141). Более благоприятная тенденция наметилась и в отношении исходов беременности. Ранние выкидыши (13,4% против 18,3%; p=0,326); ПР (5,3% против 8,3%; p=0,121) и ЭБ (4,6% против 9,2%; p=0,225) встречались реже, хотя результаты и не достигли статистической значимости. Существенных различий относительно ВПР (1,5% против 2,5%; p=0,365); поздних выкидышей (1,5% против 1,7%; p=0,457); ПЭ (3,1% против 3,3%; p=0,996); ПОНРП (0,0% против 0,83%; p=0,631); СЗРП (0,8% против 1,7%; p=0,930); АГП (2,3% против 2,5%; p=0,738); КС (9,9% против 9,2%; p=0,811) не обнаружено.
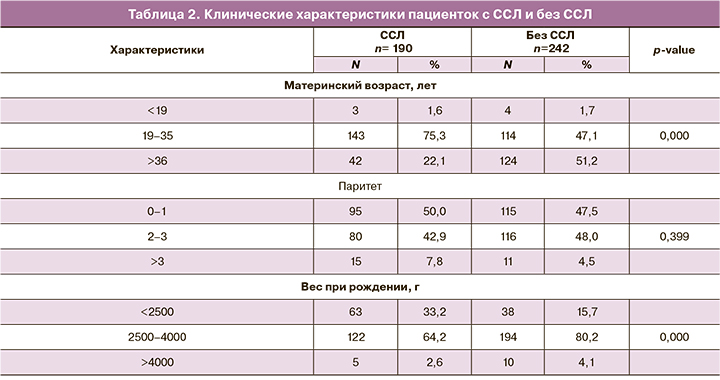
В таблице 2 приведены клинические характеристики женщин с и без ССЛ, беременности которых завершилась родами. Материнский возраст 19–35 лет преобладал в 1-й группе – у 143 пациенток (75,3%). Женщины 2-й группы были старше – 124 пациентки >36 лет (51,2%) (р<0,0001). Паритет у женщин в 1-й группе составлял: 1 – 50,0%; 2–3 – 42,9%; >3 – 7,8%; во 2-й группе соответственно: 1 – 47,5%; 2–3 – 48,0%; >3 – 4,5% (р=0,399). Более высокий средний вес плода при рождении (2500,0–4000,0 г) наблюдался во 2-й группе – у 194 пациенток (80,2%), по сравнению с группой ССЛ, где средний вес плода был ниже у 122 пациенток (64,2%) (р<0,0001).
Основным методом родоразрешения у женщин с ССЛ были спонтанные роды в срок – 130 (68,4%) (ОР=1,1; 95% ДИ 0,7–1,8), что существенно не отличалось от группы контроля – 153 (63,2%; р=0,212) (табл. 3). В группе ССЛ были более высокие показатели спонтанных ПР <37 недель – 17 (8,9%) (OР=1,9; 95% ДИ 1,2–4,4) по сравнению с контрольной группой – 10 (4,1%; р=0,036). Оперативное родоразрешение путем КС выполнено в 24 (12,6%) наблюдениях (ОР=1,0; 95% ДИ 0,5–2,0), в группе контроля – в 32 (13,2%; р=0,794). Спонтанные ПР <37 недель путем КС – в 7 случаях в 1-й (3,7%) (ОР=0,5; 95% ДИ 0,2–0,9) и в 32 случаях – во 2-й группе (13,2%; р<0,001). Статистически значимое преобладание частоты КС в сроке <37 недель во 2-й группе мы объяснили обнаруженными различиями в возрасте пациенток обеих групп. Материнский возраст в контрольной группе был выше, а количество многоплодных беременностей – больше. Индуцированные ПР одинаково часто встречались в обеих группах. При сравнении таких осложнений, как неправильные положения плода и предлежание плаценты, было обнаружено, что неправильные положения плода в 1-й группе встречались чаще – в 9 (4,7%) случаях (ОР=1,3; 95% ДИ 0,5–3,2) по сравнению с 5 наблюдениями во 2-й группе (2,1%; р=0,131), однако эти показатели не достигли статистической значимости.
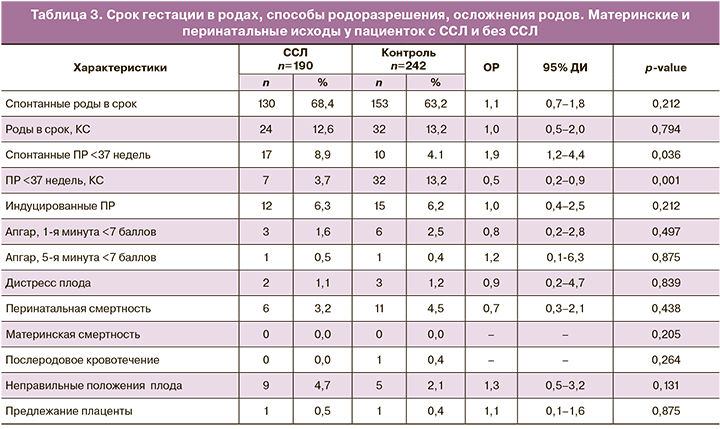
Перинатальные исходы между группами, такие, как низкие баллы по шкале Апгар (<7) на 1-й (1,6% против 2,5%; р=0,497) и 5-й минутах (0,5% против 0,4%; р=0,875); перинатальная смертность (3,2% против 4,5%; р=0,438); ВПР (1,6% против 2,6%; р=0,431); исходы беременности с живорождениями (73,3% против 74,0%; р=0,811) были сопоставимы. Материнская смертность отсутствовала в обеих группах.
Обсуждение
В настоящем исследовании мы сравнивали исходы беременности в двух группах: у пациенток с ССЛ (группа 1) и без ССЛ (группа 2). Женщины из группы ССЛ были моложе. Частота успешной беременности неожиданно оказалась одинаковой в обеих группах (59,3% и 61,0%). Большинство предыдущих исследований было посвящено проблеме изучения влияния колхицина на исход беременностей у пациенток с ССЛ по сравнению со здоровым контролем [2–5, 10, 18–25]. В самом значительном ретроспективно-проспективном когортном исследовании, проведенном в Израиле (период исследования – 2004–2008 гг.), Ben-Chetrit E. et al. сравнивали 179 беременностей женщин с ССЛ, принимающих колхицин, со 197 беременностями без колхицина, а также 312 беременностями у здоровых женщин в группе контроля [5]. Авторы сообщают об отсутствии различий в отношении ранних (8,9, 9,0 и 14,0%) и поздних (1,1, 3,0 и 2,0%) абортов, ВПР (0,5, 2,0 и 0,6%). Была обнаружена умеренная тенденция к лучшему исходу для группы, получавшей колхицин, что дало основание считать колхицин полезным препаратом для применения во время беременности [5]. Наши результаты согласуются с этими данными. В 1970-х гг., до использования колхицина, показатели потери беременности были выше у женщин с ССЛ, чем в общей популяции [4]. В более поздних работах был показан высокий уровень ранних абортов из-за приступов перитонита и преждевременных сокращений матки у пациентов, не получающих колхицин (20,2% против 10,2%) [3], а также высокий уровень абортов среди пациентов с ССЛ по сравнению со здоровым контролем [2].
Большое проспективное обсервационное сравнительное когортное исследование провели в 2010 г. Diav-Citrin O. et al. совместно с двумя тератологическими информационными службами в Израиле [21]. Обследовано 238 беременностей, подвергшихся воздействию колхицина (97,0% в I триместре), и 964 беременности без колхицинотерапии. Авторы сообщили о высоком уровне ПР. Частота основных врожденных аномалий была сопоставима между группами: 10/221 (4,5%) против 35/908 (3,9%). Средний срок гестации в родах был меньше, средний вес плода при рождении – ниже. Сделан вывод, что использование колхицина не подразумевает увеличения цитогенетического риска, а увеличение частоты ПР и низкого веса плода связано с ССЛ. В исследовании Nabil Н. et al. представлены данные о благоприятном исходе беременности у 26 пациентов с ССЛ, получавших колхицин до и после беременности [20]. Yasar O. et al. обнаружили более высокие показатели преждевременного разрыва плодных оболочек, КС и низкого веса плодов у 46 пациенток с ССЛ по сравнению со 138 женщинами в контрольной группе. Показатель ПР у пациенток с ССЛ был выше, чем в контроле, но не имел статистической значимости. Частота ПЭ, СЗРП, гестационного диабета и мертворождения была сопоставимой [18]. Использование колхицина у 25 больных и приступы во время беременности не были связаны с плохими исходами беременности. Среди 10 пациентов, не получающих колхицин, обнаружен высокий показатель привычных выкидышей – 44,4% против 8,1%; р<0,01.
В нашей работе мы сравнивали беременности у пациенток с и без ССЛ с целью изучения возможной взаимосвязи между фактором риска (ССЛ) и исходами беременности. Еще один важный результат нашего исследования касается использования колхицина во время беременности и его влияния на клиническое течение ССЛ и исходы гестации. В 52,2% наблюдений пациентки употребляли колхицин с того времени, когда диагноз был установлен впервые, включая период беременности. Течение и исход беременности не уступали таковым в здоровой когорте, несмотря на лечение колхицином. Частота некоторых осложнений гестации была меньше: ранние выкидыши, ПР, ЭБ, хотя результаты и не достигли статистической значимости. Хромосомной аномалии плода не обнаружено, частота нехромосомных аномалий была похожа на таковую в контрольной группе. Повышенную частоту ЭБ и ранних выкидышей в группе больных с отсутствием/нерегулярным приемом колхицина мы объясняем неконтролируемыми атаками ССЛ, приводящими к сильной сократимости матки, эктопической имплантации плодного яйца, угрозе выкидыша, прерыванию беременности. Этот вывод подтверждает выдвинутую ранее гипотезу, что приступ ССЛ с высокой температурой в начале беременности может привести к ранней потере беременности [18].
Ofir D. et al. провели самое большое популяционное исследование, опубликованное по исходам беременности у пациенток с и без ССЛ, что позволило им впервые описать независимые факторы риска, связанные с ССЛ [19]. Проанализированы течение и исходы 239 беременностей у пациенток с ССЛ с или без применения колхицина и 175 572 беременностей у женщин без ССЛ. Авторы установили, что ССЛ является независимым фактором риска ПР и предположили, что рецидивирующие перитонеальные атаки ССЛ могут вызвать ПР и имитировать осложнения беременности: отслойку плаценты или хориоамнионит. Дифференциальный диагноз возможен только при наличии продромальной стадии атаки ССЛ. Перинатальный исход у пациентов с ССЛ был сопоставим с таковым в группе женщин без ССЛ. Не было получено существенных различий между группами по следующим показателям: низкие баллы по шкале Апгар (<7) через 1 и 5 минут (2,5% против 4,0%; р=0,253 и 0,4% против 0,6%; р=0,783 соответственно); перинатальная смертность (0,8% против 1,3%; р=0,544); ВПР (4,6% против 4,8%; р=0,888), независимо от использования колхицина или его отсутствия [19]. Они выявили более высокую частоту лечения бесплодия у пациентов с ССЛ (5,4%) по сравнению с женщинами без ССЛ (1,9%), но причина этой ассоциации, по их мнению, оставалась неясной [19]. Наше исследование, в отличие от предыдущего, было сопоставимым по частоте бесплодия и ЭКО, поскольку контрольная группа формировалась из числа женщин с нарушениями репродуктивной функции. Возможно, данное обстоятельство и более высокий возраст пациенток в контрольной группе могут объяснить тот факт, что нами не найдено существенной разницы в частоте КС (12,7% против 13,1%), как на это указывают другие авторы [18, 19]. Сравнительно более частое родоразрешение путем КС (18,0% против 12,8%) объясняется опасениями неблагоприятных исходов беременности среди женщин, получивших лечение по поводу бесплодия [19]. Используя методы множественной логистической регрессии, авторы установили, что ССЛ не является независимым фактором риска КС, поскольку КС имеет связь с другими акушерскими факторами риска.
Таким образом, наши результаты соответствовали большинству вышеупомянутых исследований. Тем не менее оставшиеся различия могут быть объяснены отличающимися размерами исследуемых групп, дизайном исследования и режимом лечения колхицином.
Заключение
ССЛ ассоциируется с повышением риска возникновения ПР, более низкого веса плода при рождении и ЭБ. Перинатальный исход сопоставим у пациенток с и без ССЛ. Лечение колхицином во время беременности у пациенток с ССЛ оказывает благоприятный эффект на клиническое течение заболевания и не влияет на исход беременности.



