Монохориальная многоплодная беременность сопровождается высоким уровнем заболеваемости и смертности. При данном типе плацентации достоверно чаще наблюдаются аномалии сердечно-сосудистой системы плодов (4–11%), даже в отсутствие развития фето-фетального трансфузионного синдрома (ФФТС) [1].
При ФФТС сброс крови от одного плода к другому по несбалансированным артерио-венозным анастомозам плаценты приводит к гиперволемии плода-реципиента и гиповолемии плода-донора. Это объясняется особенностью функционирования артерио-венозного анастомоза, ток крови по которому возможен только в одном направлении. Для компенсации гиповолемии у донора усиленно вырабатывается эндотелин II и натрийуретический пептид, которые активизируют ренин-ангиотензин-альдостероновую систему (РААС). Ангиотензин II, являясь мощным вазоконстрикторным веществом, повышает периферическое сосудистое сопротивление и стимулирует продукцию альдостерона корой надпочечников, что ведет к задержке натрия и воды, увеличению объема крови и реабсорбции в почечных канальцах. Хроническая гиперперфузия плода-реципиента и активация РААС плода-донора усугубляет почечную гипоперфузию, приводя к стойкой активации РААС и поддержанию порочного круга. Увеличение объема циркулирующей крови и повышение периферического сосудистого сопротивления приводят к ремоделированию миокарда у плода-реципиента, которое сопровождается широким спектром изменений сердечно-сосудистой системы [2, 3]. Прогрессирование кардиомиопатии проводит к сердечной недостаточности, что и является основной причиной гибели плода реципиента.
Для оценки сердечно-сосудистой системы плодов проводится эхокардиография (Эхо-КГ), которая позволяет диагностировать морфологические и функциональные изменения. При Эхо-КГ осуществляется исследование четырехкамерного среза сердца, срезов через выходные тракты левого и правого желудочков, проекции трех сосудов и трахеи, а также оценивается венозная гемодинамика [4, 5]. Наибольшее внимание исследователей при допплеровской оценке венозной гемодинамики плода в последние годы привлекает изучение кровотока в венозном протоке. При перегрузке правых отделов сердца визуализируется аномальный кровоток в венозном протоке – нулевые и реверсные значения в фазу сокращения предсердий.
Показатель производительности миокарда, также известный как индекс Тэя, является единицей измерения глобальной систолической и диастолической функции миокарда. В нескольких исследованиях было продемонстрировано, что Тэй-индекс коррелирует со степенью дисфункции миокарда даже при ранних стадиях ФФТС [6].
Измерение размеров сердца, расчет кардио-торакального индекса, толщины миокарда желудочков и межжелудочковой перегородки и определение регургитации на атриовентрикулярных клапанах, индекс Тэя, отношение E/A, доказанная обструкция выносящего тракта правого желудочка могут использоваться для оценки прогрессирования ФФТС.
Наличие таких технических трудностей в проведении Эхо-КГ плодов при ФФТС, как выраженное многоводие у реципиента и полное отсутствие вод у донора, обуславливают необходимость высоких требований к специалисту и оборудованию.
Целью данного исследования являлось изучением влияние ФФТС на сердечно-сосудистую систему плодов.
Материалы и методы
Проведено проспективное исследование 145 беременных монохориальной диамниотической двойней, осложненной ФФТС, которые проходили обследование, антенатальное лечение в объеме фетоскопической лазерной коагуляции анастомозов (ФЛКА) плаценты и родоразрешение на базе отделений ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России в период с 2014 по 2019 гг.
Критерии включения: беременные монохориальной диамниотической двойней, осложненной ФФТС, которым выполнялась ФЛКА.
Критерии исключения: пороки развития одного или обоих плодов.
Были сформированы 2 группы: I группа – беременные женщины с ФФТС I–II стадий Quintero (n=100), II группа – с ФФТС III–IV стадий Quintero (n=45). Всем пациентам выполнялась ФЛКА, средний срок оперативного лечения в группах значимо не различался, составляя 20,5 (±1,7) недель. Новорожденные-реципиенты, у которых антенатально была диагностирована кардиомиопатия, также были разделены на 2 группы: I группа – дети с ФФТС I–II стадий (n=37), II группа – с ФФТС III–IV стадий (n=30).
В группах проводилась ультразвуковая экспертная эхокардиография плодов с помощью ультразвуковой системы Voluson E8 (GE MedicalSystems, Zipf, Австрия) в сроках беременности 16–26 недель, а также в раннем неонатальном периоде (первые 7 дней жизни) и перед выпиской ребенка из стационара (в среднем на 21-й день).
Эхо-КГ включала исследование следующих параметров: толщина стенки миокарда желудочков.
Диагностическим критерием гипертрофии миокарда желудочков являлось превышение толщины стенок желудочков или межжелудочковой перегородки двух стандартных отклонений от ожидаемого среднего значения для гестационного срока (рис. 1); размеры сердца (выраженность кардиомегалии).
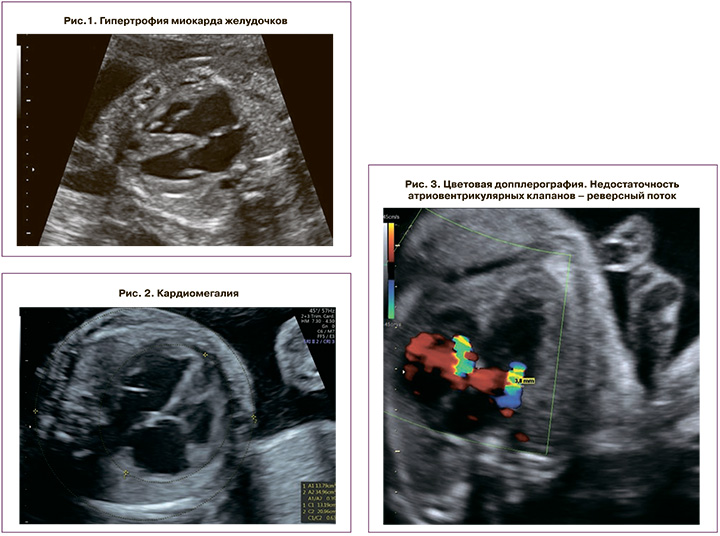
Кардиомегалия плода считалась умеренной при кардиоторакальном соотношении (КТИ) >1/3, но <50%; выраженной – при КТИ ≥50% (рис. 2); состояние клапанного аппарата.
Недостаточность клапанов считалась умеренной, когда ширина регургитационного потока не превышала 25% площади предсердия; выраженной – при ширине потока >25% площади предсердия (рис. 3); венозная гемодинамика.
Венозный проток оценивался на поперечном или сагиттальном срезе брюшной полости плода с помощью цветного допплеровского картирования. При перегрузке правых отделов сердца регистрируются аномальный кровоток в венозном протоке – его снижение (повышение пульсационного индекса более 95 перцентили), а впоследствии – появление нулевого и реверсного типа кривой. Оценка кривой классифицировалась как нормальная при положительной А-волне или аномальная – при отсутствующей или отрицательной А-волне (рис. 4). Также при прогрессировании кардиомиопатии определяется пульсирующий спектр кровотока в вене пуповины (рис. 5); функция миокарда.
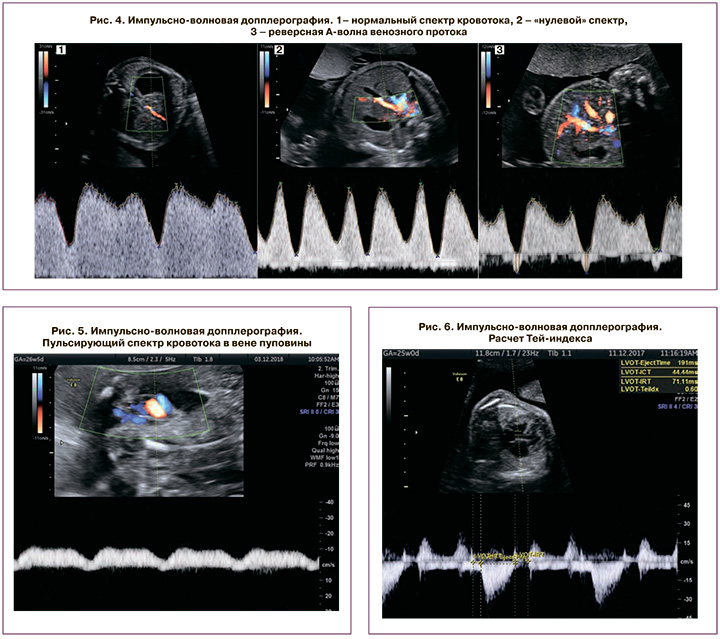
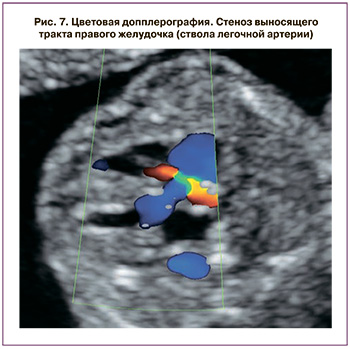
Для оценки функции миокарда использовался индекс производительности миокарда, или Тей-индекс (рис. 6). Увеличение Тей-индекса более 0,35±0,05 считалось признаком кардиомиопатии; выявление врожденных пороков сердца, возникающих вследствие ФФТС (рис. 7).
 Диагностическими критериями кардиомиопатии плода и новорожденного являлись такие изменения сердечно-сосудистой системы, как гипертрофия миокарда, кардиомегалия, недостаточность атриовентрикулярных клапанов, венозной гемодинамики (нулевая или реверсная А-волна венозного протока, пульсация вены пуповины), производительности миокарда (Тей-индекс более 0,33) и наличие обструкции выносящего тракта правого желудочка.
Диагностическими критериями кардиомиопатии плода и новорожденного являлись такие изменения сердечно-сосудистой системы, как гипертрофия миокарда, кардиомегалия, недостаточность атриовентрикулярных клапанов, венозной гемодинамики (нулевая или реверсная А-волна венозного протока, пульсация вены пуповины), производительности миокарда (Тей-индекс более 0,33) и наличие обструкции выносящего тракта правого желудочка.
Статистический анализ
Для статистической обработки данных и построения графиков использовали электронные таблицы Excel (Microsoft, США) и пакет программ GraphPadPrism 8 (GraphPadSoftware, США). Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение), для их сравнения использовали t-test. Данные с распределением, отличным от нормального, представлены как медиана (интерквартильный размах); для их сравнения использовали критерий Манна–Уитни. Качественные данные представлены как абсолютное значение (n) и %, для их сравнения использовали точный тест Фишера и χ2. Различия считали статистически значимыми при p<0,05. Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России.
Результаты
Кардиомиопатия плода-реципиента в исследуемой когорте встречалась в 54,2% (83 из 145) случаев. Кардиомиопатия выявлялась значительно чаще у плода-реципиента при III и IV стадиях ФФТС – 87,9% и 100%, чем при I и II – 36% и 44% соответственно, р<0,001.
Антенатальная летальность плода-реципиента с кардиомиопатией была значительно выше, чем среди плодов без данного осложнения – 19,3% и 4,8% соответственно, р=0,01, отношение шансов 4,7 (95% ДИ 1,3–15,7). При этом частота антенатальной летальности среди реципиентов с кардиомиопатией не зависела от стадий ФФТС - при I и II она составляла 11,9% (5 из 42), а при III и IV – 26,8% (11 из 41), р=0,11.
Наиболее часто диагностируемыми эхографическими признаками кардиомиопатии реципиента являются гипертрофия миокарда и кардиомегалия. Гипертрофия миокарда встречалась чаще при III и IV стадиях ФФТС (100%) по сравнению с I и II (73,8%), р=0,001. Также для III–IV стадий ФФТС была характерна более выраженная кардиомегалия – медиана кардиоторакального индекса – 0,61 по сравнению с I–II стадией – КТИ – 0,51, р=0,04.
Анализ индекса производительности миокарда (Тей-индекс) левого желудочка не выявил статистических отличий при разных стадиях ФФТС. При этом медиана значений Тей-индекса при кардиомиопатии была статистически больше – 0,53, чем в случаях ФФТС без кардиомиопатии реципиента – 0,31, р<0,001.
Стеноз легочной артерии и дисфункция атриовентрикулярных клапанов встречались чаще при III и IV стадиях ФФТС – 46,3% и 68,3% по сравнению с I и II – 11,9% и 28,6%, р=0,007 и 0,004.
Для III и IV стадий ФФТС было характерно появление патологического кровотока в венозном протоке и пульсация вены пуповины, что не встречалось при I и II стадиях.
Частота встречаемости гидроперикарда превалировала при III и IV стадии ФФТС – 21,9% по сравнению с I и II – 4,8%, р=0,03.
В таблице 1 представлена частота встречаемости эхографических маркеров кардиомиопатии реципиента при разных стадиях ФФТС.
Среди обследованных новорожденных с антенатально диагностированной кардиомиопатией только в 25,4% случаев (17 из 67) сохранялись ее признаки. Общая частота постнатальной кардиомиопатии при I–II и III–IV стадиях ФФТС статистически не различалась – 27% и 23,3% соответственно, р=0,78. При этом сравнение частоты при I–II и III–IV стадиях ФФТС таких эхографических признаков, как кардиомегалия, стеноз легочной артерии, дисфункция атриовентрикулярных клапанов, гидроперикард, показало статистически значимое различие. Частота эхографических признаков кардиомиопатии новорожденных представлена в таблице 2.

Обсуждение
При ФФТС в 70% случаев возникают нарушения сердечно-сосудистой системы плода-реципиента по данным Эхо-КГ [1]. Среди них наиболее часто выявляются аномальный кровоток в венозном протоке, гипертрофия миокарда, регургитация на атриовентрикулярных клапанах [3]. Данные изменения обусловлены гемодинамическими изменениями, которые возникают вследствие сброса крови от плода-донору к плоду-реципиенту через несбалансированные анастомозы плаценты.
Кардиомиопатия плода-реципиента в данном исследовании встречалась в 54,8% случаев. Очевидно, что частота нарушений сердечно-сосудистой системы увеличивалась с прогрессированием ФФТС: она была минимальной при I стадии (36%), максимальной при IV (100%), р<0,001. По данным ряда авторов, было выявлено, что наличие кардиомиопатии плода-реципиента повышает риск его внутриутробной гибели при лазерной коагуляции сосудистых анастомозов плаценты [7, 8]. Антенатальная летальность плода-реципиента с кардиомиопатией была почти в 5 раз выше (19,3%), чем среди плодов без данного осложнения (4,8%), р=0,01.
Фетоскопическая лазерная коагуляция сосудистых анастомозов плаценты является этиотропной терапией ФФТС и оказывает влияние на фетальную гемодинамику. При успешном исходе операции улучшение гемодинамических параметров наступает в течение нескольких дней [9, 10]. В нашем исследовании успешная внутриутробная коррекция ФФТС позволила снизить частоту кардиомиопатии реципиента в 4 раза.
Только у 25,4% новорожденных были выявлены признаки кардиомиопатии. Однако под действием измененной гемодинамики у плода-реципиента может сформироваться такой врожденный порок сердца, как стеноз легочной артерии, встречающийся в 7,8% случаев, в то время как его распространенность в популяции только 0,03% [11]. В исследуемой нами когорте стеноз легочной артерии выявлен у 11,9% (8) новорожденных.
Заключение
Кардиомиопатия плода-реципиента является распространенным осложнением ФФТС, частота которого увеличивается по мере прогрессирования заболевания. Наличие кардиомиопатии повышает риск антенатальной гибели плода-реципиента. Устранение гемодинамического дисбаланса в результате хирургической коррекция ФФТС способствует нормализации сердечной функции плодов, что иллюстрирует адаптивность развивающегося сердца. Тем не менее у выживших плодов-реципиентов риск стеноза легочной артерии и кардиомиопатии может сохраняться.



